
Khimia / Химия / ХИМИЯ НОВЫЕ ЛАБЫ / лаба 23-24 железо / ОПЫТЫ НУЖНОЕ!!!
.docЖЕЛЕЗО
Опыт № 1. Взаимодействие железа с кислотами.
В четыре пробирки налили по пять капель следующих кислот: 2 н. HCl, 2 н. H2SO4, концентрированную H2SO4, 2 н. HNO3. В каждую пробирку положили кусочек железной стружки. Пробирку с концентрированной серной кислотой нагрели. Затем в каждую пробирку добавили по капле 0,01 н. раствора роданида калия. Растворы окрасились в красный цвет в пробирках с концентрированной серной и азотной кислотами, это вызванной тем, что в них присутствуют ионы Fe3+.
-
Fe+2HCl=FeCl2
-
Fe+H2SO4=FeSO4+H2
-
2Fe+6H2SO4(K)=Fe2(SO4)3+3SO2+6H2O
-
Fe+4HNO3=Fe(NO3)3+NO+2H2O
Fe3++3SCN-=Fe(SCN)3
Опыт №2. Характерные реакции на ионы железа.
А) Взаимодействие солей железа (II) с гексацианоферратом (III) калия.
Приготовили в пробирке соль Мора (NH4)2SO4FeSO46H2O и добавили каплю раствора гексацианоферрата (III) калия (красная кровяная соль).
(NH4)2SO4FeSO46H2O +K3[Fe(CN)6]=KFe[Fe(CN)6]+ (NH4)2SO4+6H2O+K2SO4
Б) Взаимодействие солей железа (III) с гексацианоферратом (II) калия.
Поместили в пробирку 2-3 капли раствора хлорида железа (III) и добавили одну каплю раствора гексацианоферрата (II) калия (желтая кровяная соль).
FeCl3+K4[Fe(CN)6]= KFe[Fe(CN)6]+3KCl
В) Взаимодействие солей железа (III) с роданидом калия.
Поместили в пробирку 2-3 капли раствора железа (III) и добавили каплю раствора роданида калия. То же самое проделали с солью Мора.
FeCl3+3KSCN=Fe(SCN)3+3KCl - кроваво-красный
(NH4)2SO4×FeSO4×6H2O +2KSCN=(NH4)2SO4+Fe(SCN)2+K2SO4+6H2O
Опыт №3. Восстановительные свойства железа (II).
А) Восстановление перманганата калия. Поместили в пробирку 5 капель раствора перманганата калия и 2 капли 2 н. раствора серной кислоты. Добавили к раствору один микрошпатель соли железа (II). Раствор обесцветился.
2KMnO4+2FeSO4+4H2SO4=2MnSO4+ Fe2(SO4)3+K2SO4+4H2O – обесвечивание р-ра
Б) Восстановление пероксида водорода. Приготовили в двух пробирках раствор Мора. В одну добавили 3 капли 2 н. раствора серной кислоты и 3 капли 3 %-ного раствора перекиси водорода, а затем в обе пробирки добавили по 0.01 н. раствора роданида калия.
-
H2O2 + H2SO4 + 2FeSO4= Fe2(SO4)3 + 2H2O
Fe2(SO4)3 + 6KSCN=2Fe(SCN)3+3K2(SO4)3 - кроваво-красный
-
(NH4)2SO4×FeSO4×6H2O +2KSCN=(NH4)2SO4+Fe(SCN)2+K2SO4+6H2O
Опыт №4. Получение гидроксида железа (III) и исследование его свойств
Налить в две пробирки по 5 капель раствора хлорида железа (III) и добавить по 3 капли 2 н. раствора щелочи до получения бурого осадка гидроксида железа (III). Испытала полученный гидроксид на растворимость в 2 н. кислоте и щелочи.
FeCl3+3KOH = Fe(OH) 3↓+3KCl - бурый осадок
Fe(OH) 3 + 3НCl = FeCl3+ 3H2O – растворение
Fe(OH) 3 +3KOH = K3[Fe(OH)6] – растворение
Опыт №5. Окислительные свойства железа (III)
а) Окисление иодида калия. В пробирку с 3 каплями раствора FеС13 добавить 1 - 2 капли раствора иодида калия
4FeCl3+4KI = 2I2 + 4KCl +4 FeCl2 - желтый цвет
б) Окисление цинка. В пробирку с 3 каплями раствора FеС13 поместить кусочек цинка
FeCl3+ Zn = Fe + ZnCl2
Опыт №6. Гидролиз солей железа (II) и железа (III)
а) Гидролиз сульфата железа (II). Поместить в пробирку 5 капель нейтрального раствора лакмуса и добавить два микрошпателя соли Мора. Взболтать содержимое пробирки
2FeSO4 + 2НОН = (FeОН)2SO4 + H2SO4
2Fe2+ + 2НОН = 2(FeОН)+ + 2Н+ среда кислая
б) Гидролиз хлорида железа (III). Поместить в две пробирки по 5 капель нейтрального раствора лакмуса и добавить по 2 микрошпателя хлорида железа (III).
-
FeCl3+ НОН = FeОНCl2 + НС1
Fe3+ + НОН = FeОН2+ + Н+ среда кислая, лакмус красный
-
FeОНCl2 + НОН
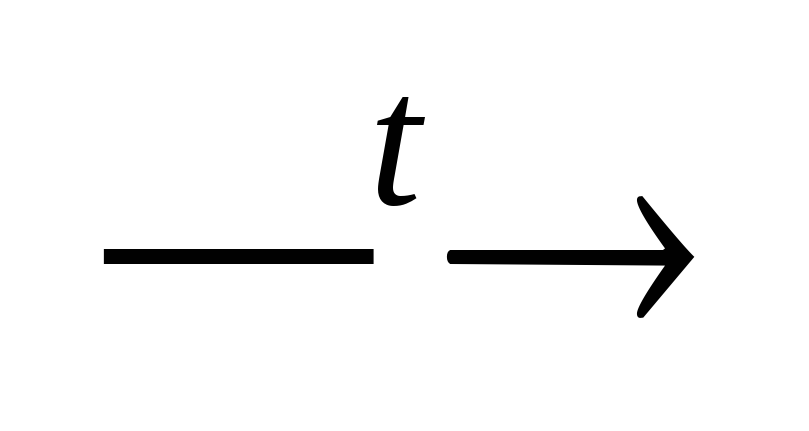 Fe(ОН)2Cl
+ НС1
Fe(ОН)2Cl
+ НС1
FeОН2+ + НОН = Fe(ОН)2+ + Н+ среда кислая, лакмус более красный
-
Fe(ОН)2Cl + НОН
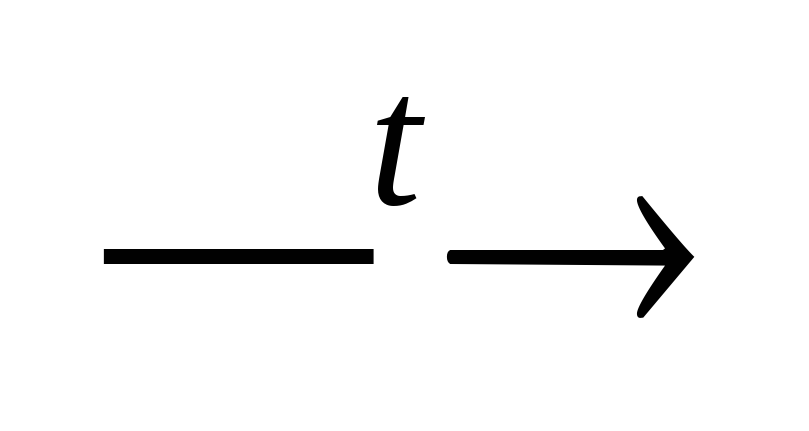 Fe(ОН)3
↓+
НС1
Fe(ОН)3
↓+
НС1
Fe(ОН)2+ + НОН= Fe(ОН)3↓+ Н+ среда кислая, лакмус более красный
2FeCl3 + 3Na2CO3 + 3НОН = 2Fe(ОН)3 ↓+ 6NaCl + 3CO2
2 Fe3+ + 3 CO32- + 3НОН = = 2Fe(ОН)3 ↓+ 3CO2
КОБАЛЬТ. НИКЕЛЬ
Опыт 1. Получение гидроксидов кобальта (II) и никеля (II) и исследование их свойств
а) Получение гидроксида кобальта (II) и его окисление. Влить в две пробирки по 2 - 3 капли раствора соли кобальта и добавить по каплям раствор гидроксида натрия. Сначала появляется синий осадок основной соли кобальта, который затем меняет цвет на розовый вследствие образования гидроксида кобальта (II).
CoCl2 + NaOH = NaCl + Co(OH)Cl ↓ - синий осадок
Co(OH)Cl + + NaOH = NaCl + Co(OH)2↓ - розовый осадок
В одной пробирке размешать осадок стеклянной палочкой для обеспечения лучшего соприкосновения Со(ОН)2 с кислородом воздуха, в другую - добавить 3 % - ного раствора пероксида водорода.
-
4 Co(OH)2 + О2 + 2H2O = 4 Co(OH)3↓ - темно-бурый осадок
-
2Co(OH)2+ H2O2= 2 Co(OH)3↓ - темно-бурый осадок
б) Получение гидроксида никеля (II) и его окисление. Налить в три пробирки по 2 - 3 капли раствора соли никеля (II) и добавить по каплям раствор гидроксида натрия до выпадения осадка гидроксида никеля (II).
NiCl2 + 2NaOH = 2NaCl + Ni(OH)2↓ – белый студенистый осадок
В первой пробирке перемешать осадок стеклянной палочкой, во вторую пробирку добавить 2 - 3 капли 3 % - ного раствора пероксида водорода, в третью - каплю бромной воды.
-
4Ni (OH)2 + О2 + 2H2O = 4Ni (OH)3↓ - черно-бурый осадок
-
2Ni (OH)2+ H2O2= 2Ni (OH)3↓ - черно-бурый осадок
-
2Ni (OH)2+ Br2 + 2H2O =2HBr + 2Ni (OH)3↓ - черно-бурый осадок
Опыт 2 Получения сульфидов кобальта и никеля
Налить в две пробирки по 2 - 3 капли раствора соли кобальта и попробовать получить сульфид кобальта, прибавляя сероводородную воду и сульфид аммония. Такие же опыты провести с раствором соли никеля (II).
CoCl2 + H2S = CoS↓ + 2HCl
CoCl2 + (NH4)2S = CoS↓ + 2(NH4)Cl
NiCl2 + H2S = NiS↓ + 2HCl
NiCl2 + (NH4)2S = NiS↓ + 2(NH4)Cl
Опыт 3 Комплексные соединения кобальта и никеля
а) Получение аммиачного комплекса кобальта. Влить в пробирку 3-4 капли раствора соли кобальта и добавить по каплям 25 % - ный раствор аммиака. Вначале выпадет осадок гидроксида кобальта (II). Затем осадок растворится вследствие образования комплексного основания кобальта [Со(NНз)6](ОН)2.
CoCl2 + 2NH4OH = 2NH4Cl + Co(OH)2↓- розовый осадок
Co(OH)2+ 6NH3 = [Со(NНз)6](ОН)2 ярко-розовый
Полученный раствор разлить в две пробирки. В одной из них тщательно перемешать раствор стеклянной палочкой и наблюдать за изменением окраски вследствие окисления полученного комплексного соединения кобальта (II) в комплексное соединение кобальта (III) с координационным числом, равным 6.
[Со(NНз)6](ОН)2 + О2= [Со(NНз)6](ОН)3 желтый
Прилить две капли раствора сульфида аммония.
[Со(NНз)6](ОН)3 + 3(NH4)2S = Со2S3↓ +12NH3 + 4H2O
Во вторую пробирку добавить 2-3 капли 3 % - ного раствора пероксида водорода.
2[Со(NНз)6](ОН)2 + H2O2= Co(OH)3↓ +12NH3
б) Получение аммиачного комплекса никеля. Растворить один микрошпатель сухого хлорида никеля (II) в 5 каплях воды. Добавить по каплям раствор 2 н. щелочи до выпадения осадка и затем 5 капель 25 % - ного раствора аммиака до растворения осадка.
NiCl2 + 2NaOH = 2NaCl + Ni(OH)2↓ – белый студенистый осадок
Ni(OH)2 + 6NH3 = [Ni(NH3)6](OH)2 – синий
Подействовать на полученный раствор раствором сульфида аммония
[Ni(NH3)6](OH)2 + (NH4)2S = NiS + 8NH3 + 2H2O
