
Khimia / Химия / ХИМИЯ НОВЫЕ ЛАБЫ / Лаба 25 цинк / 5
.rtfМинистерство образования Российской Федерации
Владимирский Государственный Университет
Кафедра Химии
Лабораторная работа по общей и неорганической химии №25
"Цинк. Кадмий"
Выполнил
Студент группы Хб-108
Якимова К. А.
Проверил
Преподаватель
Орлин Н.А.
2009
 Теоретическая
часть:
Теоретическая
часть:
В виде простых веществ цинк, кадмий и ртуть – серебристые металлы. По химической активности цинк и его аналоги уступают щелочно-земельным металлам. Цинк – химически активный металл, легко растворяется в кислотах и при нагревании в щелочах:
Zn + 2OH3+ + 2H2O = H2 + [Zn(H2O)4]2+
Zn + 2H2O + 2OH- = H2 + [Zn(OH)4]2-
Кадмий в щелочах практически не растворяется, а в кислотах – менее энергично, чем цинк; ртуть же растворяется только в кислотах, являющихся достаточно сильными окислителями за счет своих анионов. При этом могут получиться производные как Hg(II), так и Hg(I). При действии на Hg концентрированной азотной кислоты получается Hg(NO3)2:
Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O
При действии на избыток ртути разбавленной азотной кислоты получается Hg2(NO3)2:
6Hg + 8HNO3 = 3Hg2(NO3)2 + 2NO + 4H2O
Цинк и кадмий по отношению к HNO3 и концентрированной H2SO4 ведут себя значительно активнее. Цинк, например, очень разбавленную азотную кислоту восстанавливает до иона аммония:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
При нагревании цинк и его аналоги весьма энергично взаимодействуют с активными неметаллами. Ртуть взаимодействует с иодом и серой при обычных условиях.
Hg + S = HgS
Соединения Zn(II), Cd(II), Hg(II).
В подгруппе цинка с увеличением атомного номера устойчивость однотипных бинарных соединений уменьшается.
При растворении соединений Э(II) в воде, а также при взаимодействии ЭО или Э(ОН)2 с кислотами образуются устойчивые аквакомплексы типа [Э(Н2О)4]2+ и [Э(Н2О)6]2+. Из других катионных комплексов наиболее устойчивы аминокомплексы типа [Э(NH3)4]2+ и [Э(NH3)6]2+, легко образующиеся действием аммиака на растворы солей:
ZnSO4 + 4NH3 = [Zn(NH3)4]SO4
Аммиакаты ртути (II) образуются только при большом избытке аммиака и в присутствии солей аммония. Взаимодействие HgCl2 с NH3 в концентрированном растворе NH4Cl приводит к выпадению осадка [Hg(NH3)2]Cl2.
HgCl2 + 2NH3 = [Hg(NH3)2]Cl2
Цинк и его аналоги образуют различного рода цинкаты, кадмиаты и гидраргираты (меркураты). Так, Zn(OH)2 легко растворяется в щелочах за счет образования растворимых гидроксоцинкатов.
Zn(OH)2 + 2KOH = K2[Zn(OH)4]
тетрагидроксоцинкат калия
Или при кипячении – до цинкатов и воды.
Zn(OH)2
+ 2KOH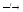 K2ZnO2
+ 2Н2О
K2ZnO2
+ 2Н2О
цинкат калия
Гидроксид кадмия кислотные свойства проявляет в меньшей степени, чем Zn(OH)2.
Для Zn в комплексных соединениях характерны координационные числа 4 (для небольших лигандов) и 6 (для лигандов больших размеров).
Опыт №1. Растворение цинка в кислотах и щелочах.
В пробирку поместили 4-5 капель 2н. раствора серной кислоты, добавили 1 микрошпатель цинковой пыли и подогрели. То же проделали и с концентрированной серной кислотой.
Проверили растворимость цинка в соляной кислоте и гидроксиде натрия.
Zn + H2SO4(разб.) = ZnSO4 + H2
4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S + 4H2O
Zn + 2HCl = ZnCl2 + H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Опыт №2. получение гидроксидов цинка и кадмия и исследование их свойств.
В две пробирки налили по 3-4 капли раствора соли цинка, а в две другие - соли кадмия. В каждую пробирку добавили по 2 н. раствора гидроксида натрия, получили белые студенистые осадки.
Zn+2NaOH=Zn(OH)2+Na2SO4
CdSO4 +2NаOH=Cd(OH)2+ Na2SO4
Далее к полученным гидроксидам добавили кислоты, а в другие две пробирки избыток щелочи. Во всех случаях осадки растворились.
Zn(OH)2 + H2SO4 = [Zn(H2О)2]SO4
Cd(OH)2 + H2SO4 = [Cd(H2О)2]SO4
Zn(OH)2+ NаOH = Na2[Zn(OH)4]
Cd(OH)2+ NаOH = Na2[Cd(OH)4]
Опыт №3. Получение комплексных соединений цинка и кадмия.
Поместили в одну пробирку 2 капли раствора соли цинка, а в другую раствор соли кадмия и добавили в каждую по 2 капли 2 н. раствора гидроксида аммония. Добавляли в каждую пробирку гидроксида аммония до полного растворения осадков.
Для обеих ионов – комплексообразвателей характерное координационное число равно 4.
ZnSO4 + 4NH4OH = [Zn(NH3)4]SO4 + 4Н2O
CdSO4 + 4NH4OH = [Cd(NH3)4]SO4 + 4Н2O
Опыт №4. Восстановительные свойства цинка.
В тигель поместили 2 микрошпателя цинковой пыли, 4 капли раствора нитрата калия и 2-3 капли концентрированного раствора гидроксида натрия. Медленно нагрели содержимое тигля до слабого кипения. Поднесли к тиглю лакмусовую бумажку. Она посинела.
3Zn
+ 2KNO3
+ 4NaOH(конц)
+ 2H2O
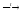 2Na2[Zn(OH)4]
+ К2[Zn(OH)4]
+ 2NO
2Na2[Zn(OH)4]
+ К2[Zn(OH)4]
+ 2NO
