
Khimia / Химия / ХИМИЯ НОВЫЕ ЛАБЫ / Лаба 17 / Опыт 1,2
.docОпыт № 1. Окислительные и восстановительные свойства серы
а) Взаимодействие серы с цинком.
В смеси порошка цинка и порошка серы при нагревании протекает реакция с образованием сульфида цинка.
Сера выступает в качестве окислителя.
S + Zn = ZnS
б) Взаимодействие серы с азотной кислотой.
В пробирку был добавлен порошок серы и концентрированная азотная кислота. При нагревании пробирки наблюдалось выделение бурого газа и уменьшение количества серы в пробирке, из которой, после остывания, было взято несколько капель раствора и смешано в другой пробирке с хлоридом бария и дистиллированной водой. Образовался белый осадок – сульфат бария.
Сера выступает в качестве восстановителя.
S + HNO3 (K) = H2SO4 +6NO2 + 2H2O
H2SO4 + BaCl2 = BaSO4 + 2HCl
Опыт № 2. Окислительные и восстановительные свойства серы (IV)
а) Взаимодействие сернистой кислоты с сероводородом и йодом
В две пробирки было налито: в первую – сероводородной воды, во вторую – йодной воды. Затем в обе было добавлено сернистой кислоты.
Сернистая кислота выступает в качестве восстановителя.
H2SO3 + 2H2S = 3S + 3H2O
H2SO3 + I2 = H2SO4 + HI
б) Взаимодействие сульфита натрия с дихроматом калия.
В пробирке были смешаны растворы дихромата калия, серной кислоты и несколько кристаллов сульфита натрия. В процессе достаточно бурной реакции оранжевая окраска раствора перешла в зеленую.
Сера проявляет восстановительные свойства.
2K2Cr2O7 + 8H2SO4 + 3Na2S = 2Cr2(SO4) 3 + 3Na2SO4 + 2K2SO4 + 8H2O
Опыт № 3.Окислительные свойства серной кислоты.
А) Взаимодействие металлов с разбавленной серной кислотой: Налили в три пробирки по 6 капель разбавленной серной кислоты и опустили в пробирки металлы: в первую – кусочек цинка. Во вторую – железа, в третью – меди. Пронаблюдали за реакциями.
Zn+H2SO4=ZnSO4+H2
Fe+H2SO4=FeSO4+H2
Cu+H2SO4≠
В пробирках с цинком реакция шла более интенсивно, чем с железом, а с медью – не шла. Это объясняется тем, что медь стоит после водорода в ряду активности металлов, поэтому реакция не шла. А в пробирке с цинком реакция шла интенсивнее, т.к. цинк стоит левее железа. В качестве окислителя выступает ион Н+.
Б) Взаимодействие металлов с концентрированной серной кислотой: В три пробирки налили 6 капель концентрированной серной кислоты. В первую пробирку насыпали несколько микрошпателей порошка меди. Во вторую – цинка, в третью – кусочек цинка.
2H2SO4+Cu=CuSO4+2H2O+SO2
H2SO4+Zn=ZnSO4+S+2H2O
H2SO4+Zn=ZnSO4+H2S+2H2O
В пробирке с порошком цинка реакция шла интенсивнее, чем с кусочком цинка. Наблюдали выпадение серы в чистом виде. В пробирк с медью выделилися оксид серы (IV).
Опыт №4. Изучение свойств тиосерной кислоты и тиосульфатов.
А) Взаимодействие тиосульфата натрия с хлором и бромом: В две пробирки налили по 6 капель раствора тиосульфата натрия и добавили по каплям в одну пробирку хлорную воду, а в другую – бромную воду до появления осадка серы.
Na2S2O3+Cl2=Na2SO4+S+2HCl
Na2S2O3+Br2=Na2SO4+S+2HBr
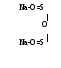
Тиосульфат натрия
Б) Взаимодействие тиосульфата натрия с йодом: В пробирку налили 6 капель йодной воды и добавили по каплям раствор тиосульфата натрия до исчезновения йодной окраски воды (коричневый цвет потом обесцветился). В этом опыте сера не выпадала в чистом виде.
2Na2S2O3+I2=Na4S2O6+S+2NaI
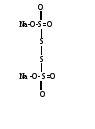
Тетратианат натрия
В) Взаимодействие тиосульфата натрия с хлоридом железа (III): Налили в пробирку 6 капель раствора хлорида железа (III) и столько же капель раствора тиосульфата натрия. Содержимое перемешали. Сначала раствор был темно-коричневого цвета(Na[Fe(S2O3)2]), но после перемешивания он изменил свою окраску на желтый (FeS4O6).
FeCl3+Na2S2O3= Na[Fe(S2O3)2]
Na[Fe(S2O3)2]+FeCl3= FeS4O6+FeCl2+NaCl
Опыт № 5. Окислительные свойства пероксисульфатов.
В фарфоровой тщательно смешали три микрошпателы порошка пероксисульфата аммония с 6 каплями раствора сульфата никеля и 6 каплями гидроксида натрия 6 н. Чашку поставили на штатив нагрев до появления черного осадка гидроксида никеля (III).
2NiSO4+(NH4)2S2O3+6NaOH=2NI(OH)3+(NH4)2SO4+3Na2SO4
