
Khimia / Химия / ХИМИЯ НОВЫЕ ЛАБЫ / Лаба 3 и 4 / v 1
.1.docПрактическая часть
Опыт 1. Приготовление 10% раствора сульфида натрия.
Рассчитаем, сколько граммов сульфата натрия и воды требуется для приготовления 50 г раствора, в котором массовая доля растворенного сульфата натрия составляет 10%.
ω=0,1
ω=![]()
mв-ва = 50*0.1=5г (Na2SO4)
mр-ра =50 г
mН2О = 50-5 =45 г
Взвесим на технических весах расчетное количество соли и перенесем его в стакан на 100 мл. Отмерим мерным цилиндром расчетное количество дистиллированной воды и прильем в стакан. Перемешаем раствор до полного растворения соли, перельем в мерный цилиндр и измерим плотность ареометром.
ρпракт.=1.091 г/мл
По найденной плотности определим с помощью таблицы практическое значение массовой доли сульфата натрия в приготовленном растворе. Вычислим относительную ошибку опыта, считая теоретическое значение массовой доли 10%.
Решение:
Пусть объем равен 1000 мл.
mр-ра =ρV=1.091*1000=1091 г
mв-ва = mр-ра *ω=1091г*0.1=109.1г
![]()
nв-ва= =0.768
моль
=0.768
моль
См=![]() =0.768
моль/л
=0.768
моль/л
ρтеор
=
ρпракт
=>
ŋ=
![]() =
0%
=
0%
Значит и малярная концентрация равна теоретической.
Вывод: Мы научились на основе данной процентной концентрации определять молярность раствора. Делать растворы веществ с минимальными погрешностями. Измерять плотность данного вещества.
Опыт 2. Приготовление 1.5н раствора сульфата алюминия из кристаллогидрата.
Рассчитаем,
сколько граммов кристаллической соли
Al2(SO4)3![]() требуется
для приготовления 50 мл 1.5 н раствора
Al2(SO4)3
в расчете на безводную соль.
требуется
для приготовления 50 мл 1.5 н раствора
Al2(SO4)3
в расчете на безводную соль.
Решение: Cн=1.5 н V=50 мл.
Cн=![]() nэ=
nэ=![]()
nэ=1.5
![]() 0.05=0.075
моль
0.05=0.075
моль
Мэ=![]() г/моль
г/моль
m(Al2(SO4)3)=nэ![]() Mэ=57
Mэ=57
![]() 0.075=4.275
г.
0.075=4.275
г.
М(Al2(SO4)3
![]() 18Н2О)=342+324=666
моль
18Н2О)=342+324=666
моль
![]() г
г
Взвесим расчетное количество кристаллогидрата на технических весах. С помощью микроворонки перенесем навеску соли в мерную колбу на 50 мл, смывая кристаллы соли дистиллированной водой. Нальем колбу до половины и перемешаем раствор до полного растворения соли. Доведем водой уровень раствора до метки, последние капли добавим при помощи пипетки. Приготовленный раствор перельем в цилиндр на 50 мл и измерим плотность раствора ареометром.
ρтеор = 1.077 г\мл
По найденной плотности найдем массовую долю соли.
ω%=7.45%
Пересчитаем массовую долю на нормальную концентрацию. Это будет практическое значение нормальности раствора. Найдем относительную ошибку опыта, считая теоретическое значение нормальности 1,5 н.
Решение: пусть объем равен 1 л.
Cн=![]()
mр-ра=ρ![]() V=1.077
V=1.077
![]() 1000=1077
г
1000=1077
г
mв-ва=
mр-ра
*
ω=1077![]() 0.0745=80.24
г
0.0745=80.24
г
См=![]() n=
n=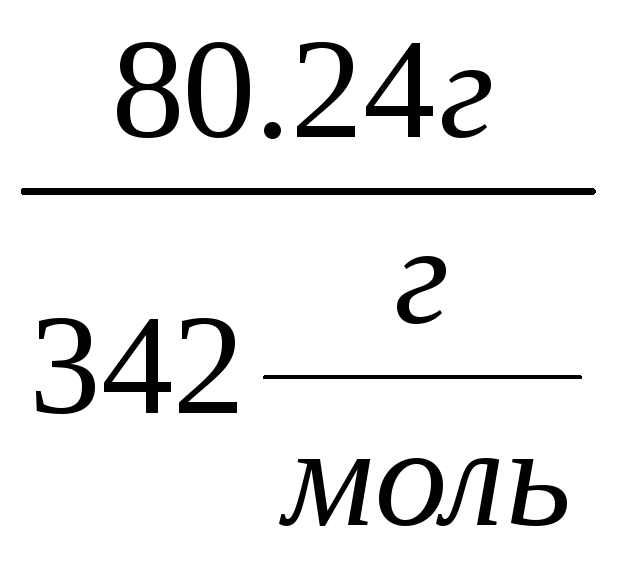 =
0.23 моль См=
=
0.23 моль См=![]() моль/л
моль/л
Э
=![]() Сн
=
6
Сн
=
6![]() См=1.4моль/л
См=1.4моль/л
η
=![]() =6.6%
=6.6%
Вывод: Мы научились рассчитывать, сколько необходимо кристаллогидрата в расчете на безводную соль. Определять плотность раствора, и переводить процентную концентрацию в молярную и нормальную.
