
Laby_po_Khimii / Гальванические элементы
.docМинистерство образования Российской Федерации
Владимирский государственный университет
Кафедра химии и экологии
Лабораторная работа № 15
«Гальванические элементы»
Выполнил:
студент группы ЭС – 107
Петрова А.С.
Приняла:
Кузурман В.А.
Владимир 2008
Цель работы:
Определить ЭДС цинк-медного гальванического элемента.
-
Краткое теоретическое введение.
Электрохимические процессы – это гетерогенные, окислительно-восстановительные процессы, сопровождающиеся возникновением электрического тока или протекающие под действием электрического тока на границе раздела: электрод-раствор или расплав электролита. Электрохимические реакции протекают в источниках электрической энергии: гальванических элементах, аккумуляторах, топливных элементах, при электрохимической коррозии металлов и сплавов, в процессах электролиза и др.
При погружении металла в раствор электролита, содержащий ионы этого металла, на границе раздела «металл-раствор» устанавливается подвижное равновесие:
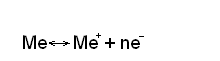
Или с учетом гидратации ионов:

Этому равновесию соответствует определенный скачок потенциала, называемый равновесным электродным потенциалом. Электродный потенциал можно вычислить по уравнению Нернста:
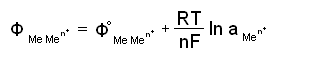
Где
![]() - стандартный электродный потенциал,
В; n
– количество электронов в электродной
реакции;
- стандартный электродный потенциал,
В; n
– количество электронов в электродной
реакции;
![]() - активная концентрация ионов металла,
моль/л
- активная концентрация ионов металла,
моль/л
Активная концентрация иона может быть рассчитана по формуле:
![]() ≈ Cm * f
≈ Cm * f
Где Cm – молярная концентрация электролита, моль/л, f – коэффициент активности иона.
Стандартные потенциалы металлических электродов определяют по отношению к стандартному водородному электроду, потенциал которого условно принят равным 0. Если концентрация ионов отличается от стандартных условий, потенциал водородного электролита может быть вычислен по уравнению Нернста. Для растворов слабых электролитов
![]() = 0,059*lg
[H
= 0,059*lg
[H![]() ]
]
Если известен рН раствора, то потенциал водородного электрода может быть рассчитан по формуле
![]() = - 0,059 * рН
= - 0,059 * рН
Из двух любых электродов, имеющих разные потенциалы, можно составить гальваническую цепь или собрать гальванический элемент. Конструктивно, гальванический элемент можно представить как систему, состоящую из двух электродов, погруженных в раствор электролитов. Для замыкания внутренней электрической цепи растворы соединяют электролитическим мостиком. Внешняя цепь замыкается металлическим проводником. Подключаются измерительные приборы.
Разность потенциалов катода и анода при силе тока во внешней цепи близкой к 0 составляет ЭДС элемента
ЭДС = φк – φа
Вычислив по уравнению Нернста потенциалы катода и анода, можно рассчитать теоретическое значение ЭДС.
При работе гальванического элемента на аноде протекают реакции окисления, на катоде – восстановления.
-
Приборы и реактивы:
Потенциометр, медная и цинковая пластины, мерные колбы на 50мл – 2шт., мерные цилиндры на 10мл – 2 шт., растворы: сульфата цинка 0,05М; сульфата меди(11) 0,1М и 0,05М
-
Ход выполнения работы.

Приготовить 0,005М раствор ZnSO4 путем разбавления 0,05М раствора этой соли и, соответственно, раствор 0,1М CuSO4 разбавлением 0,5М раствора. Растворы налить отдельно в стаканчики на 50 мл. Собрать гальванический элемент как показано на рисунке. Для этого погрузить цинковую пластину в раствор сульфата цинка, а медную в раствор сульфата меди. Опустить солевой мостик, содержащий хлорид калия в растворы солей. Электроды с помощью проводов подключить к высокоомному входу потенциометра. Измерить разность потенциалов электродов, которая должна соответствовать практическому значению ЭДС элемента.
Рассчитать теоретическое значение ЭДС данного элемента по уравнению Нернста, учитывая, что коэффициент активности ионов цинка в 0,005М растворе сульфата цинка = 0,48, а коэффициент активности ионов меди в растворе сульфата меди = 0,16. Рассчитать относительную ошибку опыта.
-
Результаты
-
Вывод.
В ходе работы определили ЭДС медно-цинкового гальванического элемента. Рассчитали ее теоретическое значение и вычислили погрешность.
