attachments_05-10-2012_14-50-39 / ДЗ-2(ТПВ-1)
.docТема II. ХИМИЧЕСКАЯ СВЯЗЬ
Задание 1: Для четырех, указанных по варианту молекул (табл.), с позиций метода валентных связей показать образование молекул и ответить на следующие вопросы:
1. Каков тип гибридизации центрального атома в молекуле и валентный угол между связями?
2. Какова пространственная структура молекулы?
3. Сколько σ- и π-связей содержит молекула?
4. Определить полярность связей и полярность молекулы в целом.
Пример решения
Для ответа на вопросы задания рассмотрим молекулу CdI2.
1. Сначала определяем тип гибридизации центрального атома. Для этого выписываем валентные электроны центрального атома 48Cd.
5s
4d
4d![]()



З
5p
5s
4d
Таким образом Cd предоставляет на связь два неспаренных электрона.
Далее выписываем валентные электроны йода.
5s
5p

У йода имеется один неспаренный электрон. Следовательно, согласно Льюису молекула CdI2 выглядит следующим образом:
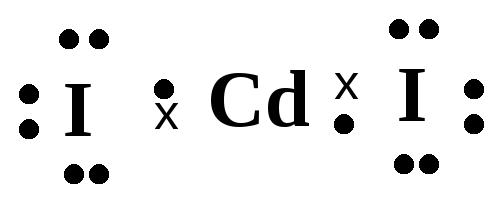 .
.
Далее изображаем молекулу CdI2 с использованием представлений о гибридизации орбиталей центрального атома.
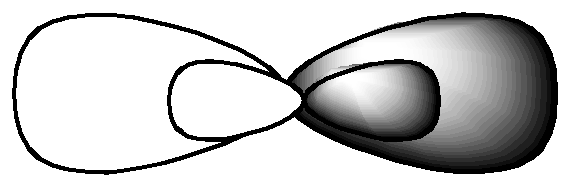
Отмечаем, что у Cd имеются две внешние орбитали: s и р. Представим s- и р-орбитали на рис. 2.1.
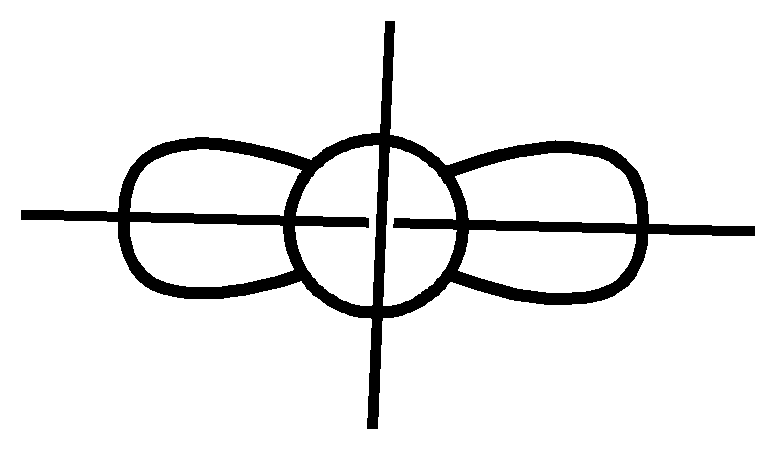
Рис. 2.1
Таким образом, с одной р-орбиталью йода кадмий связывается с помощью s-орбитали, а с другой – с помощью р-орбитали. Так как связи отличаются по форме и энергии, то такая молекула не будет устойчивой. Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис. 2.2.
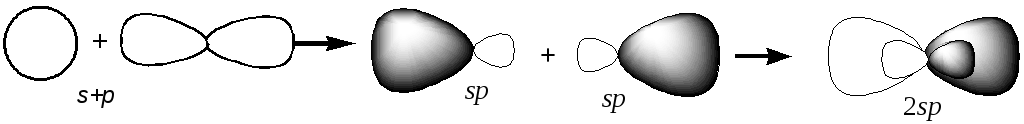
Рис. 2.2
Гибридизация – процесс, в результате которого происходит перестройка валентных орбиталей центрального атома и образование смешанных гибридных орбиталей, одинаковых по форме и энергии.
Таким образом, при гибридизации s- и p-орбиталей образуются две равноценные sp-гибридные орбитали (s + p = 2sp). По аналогии: s + p + p = 3sp2, образуются три равноценные sp2-гибридные орбитали; s + p + p + p = 4sp3, образуются четыре равноценные sp3-гибридные орбитали.
Гибридные орбитали центрального атома располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180 о; sp2 – 120 о; sp3 – 109 о. Расположение гибридных орбиталей под определенным углом показано в табл. 2.1.
Таблица 2.1
|
Тип гибридизации: |
sp |
sp2 |
sp3 |
|
Расположение гибридных орбиталей в простран-стве |
|
|
|
|
Теоретический валентный угол |
180 о |
120 о |
109 о |
В соответствии с данными табл. 2.1 в молекуле CdI2 реализуется sp-гибридизация, и валентный угол составляет 180 о.
Чтобы изобразить молекулу в целом, остается показать перекрывание полученных гибридных орбиталей центрального атома с валентными орбиталями боковых атомов. В случае рассматриваемой молекулы CdI2 боковым атомом является 53I. Так как это р-элемент, то его валентные наружные электроны имеют орбиталь в виде гантели. В случае, если это будет s-элемент, то форма орбитали в виде шара.
"Подводя" валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 2.3).
I Cd I
Рис. 2.3
2. Разберем вопрос о пространственной структуре молекулы. Пространственная структура молекулы связана с типом гибридизации и расположением боковых атомов вокруг центрального атома (табл. 2.2).
Таблица 2.2
|
Тип гибри- дизации |
sp
|
sp2 |
sp3 |
sp3 |
sp3 |
|
Простран-ственная структура
|
|
|
|
|
|
|
Форма молекулы |
линейная |
треугольная |
тетраэдрическая |
пирамидальная |
угловая |
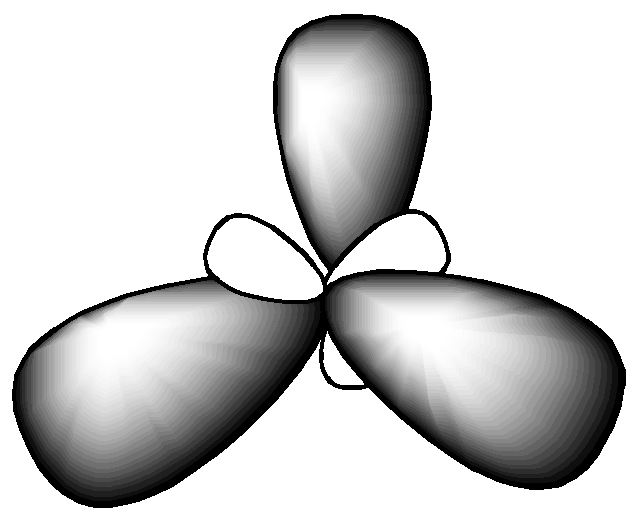
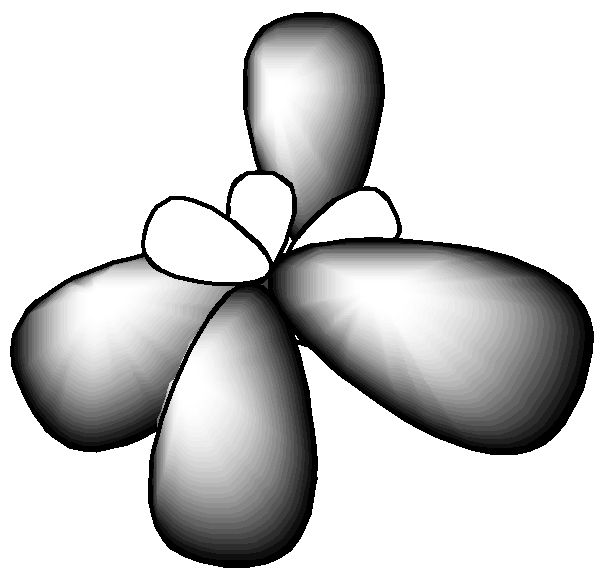
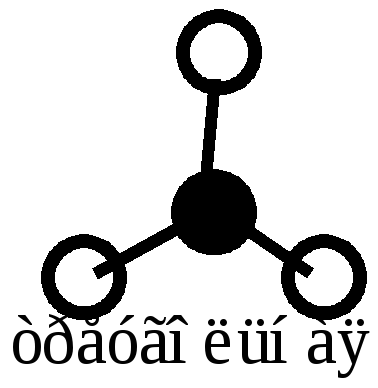
Как видно из табл. 2.2, при sp3 гибридизации может реализоваться тетраэдрическая форма, пирамидальная или угловая в зависимости от числа боковых атомов (4, 3, 2 – соответственно). В данном типе гибридизации могут оставаться неиспользованные орбитали, которые влияют на величину валентного угла.
Из рис. 2.3 следует, что рассматриваемая молекула CdI2 имеет линейную форму.
3. Теперь отметим наличие σ и π связей в молекуле. Если область перекрывания находится на оси связи, такая связь σ - типа (сигма тип), если область перекрывания расположена по обе стороны от оси связи – это π-тип (пи тип) ( рис. 2.4).



а) б) в)
σ - тип
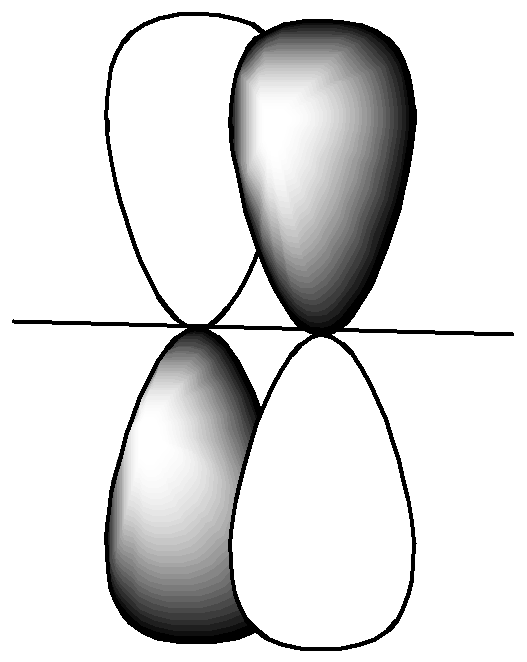
π - тип
Рис. 2.4. Типы связей
Исходя из рисунка 2.3. делаем вывод, что в молекуле CdI2 две ковалентные связи σ-типа.
4. Определим полярность связи и молекулы в целом. Полярность связи обусловлена наличием диполя, образованного за счет оттягивания валентных электронов в сторону более электроотрицательного атома. В связи Cd–I в молекуле CdI2 более электроотрицательным элементом является йод. Поэтому связь Cd–I является полярной.
Для определения полярности молекулы необходимо учитывать: а) полярность связи; б) пространственную структуру молекулы.
Молекула CdI2 неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются.
Рассмотрим молекулу OF2.
Выписываем валентные электроны центрального атома – кислорода.
2р
2s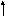


Далее надо перевести электроны в возбужденное состояние. Однако, на втором энергетическом уровне свободных орбиталей нет, поэтому распаривание электронов невозможно. Если в качестве центрального атома будет похожий элемент, но находящийся в третьем периоде, то для таких простых молекул, которые предлагаются в задании не следует при возбуждении переводить электроны с 3s и 3р на 3d, так как на это необходимы большие затраты энергии.
Так как у атома кислорода имеется два неспаренных электрона, то он может образовать две связи. Выписываем валентные электроны фтора: 2s22p5
2s
2p

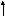
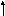
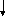
У фтора имеется один неспаренный электрон. По представле-ниям Льюиса молекула OF2 может быть изображена следующим образом:
 .
.
Далее определяем тип гибридизации центрального атома – кислорода. Для этого производим "сложение": s + p + p + p = 4sp3. При этом не следует писать 2s или 2р, так как речь идет не об электронах (например, на 2s- подуровне), а их действительно 2, а об орбиталях, т.е. пространстве вероятного нахождения электронов. Рисуем четыре оси и гибридные облака. Подводим валентные орбитали F (это р-элемент). Получаем угловую молекулу с теоретическим валентным углом 109 о (рис. 2.5).

Рис. 2.5
Связи О–F – полярные, молекула в целом тоже полярна, так как в вершине угла заряд со знаком "+", а в противоположной стороне "-". Происходит оттягивание электронов в сторону F, т.е. образуется диполь. Две связи О–F – ковалентные, σ-типа.
|
Номер варианта |
Формулы молекул |
|||
|
1 |
CaCl2 |
NF3 |
PCl5 |
CH4 |
|
2 |
CdF2 |
PH3 |
TeF6 |
C2H4 |
|
3 |
CuCl2 |
SbBr3 |
SCl2O |
CH2O |
|
4 |
MgBr2 |
AsCl3 |
GeBr4 |
C2Cl2 |
|
5 |
ZnI2 |
H2S |
AsF5 |
PbBr4 |
|
6 |
BeH2 |
SCl2 |
BrF5 |
SbCl3 |
|
7 |
HgCl2 |
CH3Cl |
SClF5 |
N2 |
|
8 |
SrBr2 |
H2Se |
PF5 |
CO2 |
|
9 |
BCl3 |
H2Te |
CCl2O |
PbBr4 |
|
10 |
AlH3 |
SF2 |
SnCl4 |
COS |
|
11 |
GaBr3 |
SiH4 |
SCl2O2 |
CaH2 |
|
12 |
CuF2 |
CH4 |
SbCl5 |
C2H2 |
|
13 |
SrBr2 |
Cl2 |
SF6 |
SnH4 |
|
14 |
CoCl2 |
GeH4 |
ClF5 |
SO3 |
|
15 |
MgBr2 |
CHCl3 |
PCl3O |
CO |
|
16 |
HgF2 |
SiCl4 |
NCl3 |
CS2 |
|
17 |
CaBr2 |
CH2Cl2 |
SCl2O |
SbF3 |
|
18 |
CdCl2 |
SiF4 |
BrF5 |
SO3 |
|
19 |
ZnF2 |
PbBr4 |
C2H4 |
SCl2O2 |
|
20 |
BeI2 |
PCl3O |
SF4 |
C2H2 |
|
21 |
ZnCl2 |
SbCl3 |
COS |
IF5 |
|
22 |
CdH2 |
AsBr3 |
CO |
SCl2O2 |
|
23 |
MgH2 |
SbF3 |
COF2 |
PCl5 |
|
24 |
CaH2 |
SnCl4 |
BiF3 |
CO2 |
|
25 |
SrH2 |
CF4 |
SO3 |
AsF5 |
|
26 |
ZnBr2 |
OF2 |
NCl3 |
SCl2O |
|
27 |
GaH3 |
CCl4 |
BrF5 |
SO2 |
|
28 |
AlH3 |
SnBr4 |
CO |
SCl2O2 |
|
29 |
InCl3 |
H2Te |
PBr3O |
SiF4 |
|
30 |
ZnH2 |
PbCl4 |
IF5 |
CS2 |
|
31 |
MnCl2 |
PH3 |
CO2 |
SCl2O |
|
32 |
CoCl2 |
AsF3 |
SCl2O2 |
C2H2 |
|
33 |
NiBr2 |
SO3 |
PBr3 |
CH2Cl2 |
|
34 |
FeBr2 |
SbF3 |
N2 |
PCl3O |