
физика лекц / Лекция 21
.docЛекция 21.
ЭЛЕМЕНТЫ КВАНТОВОЙ МЕХАНИКИ.
21.1. Гипотеза де-Бройля.
Как известно, действенность во взглядах на природу света получила название корпускулярно-волнового дуализма.
В 1924 г. Луи де Бройль высказал предположение, что это двойственная природа характерна не только для света, а имеет универсальный характер. Частицы вещества должны обладать не только корпускулярными, но и волн волновыми свойствами. Из этого следовало, что формулы характеризующие фотоны света, должны распространяться на частицы. Для фотонов справедливы соотношения:
![]()
Из
последней формулы получим
![]() (21.1)
(21.1)
или
![]() (21.1`)
(21.1`)
По гипотезе де Бройля (21.1) можно применить для определения длины волны элементарной частицы (электрона, протона и т.д.). Зависимость (21.1) называют еще формулой де Бройля.
В
релятивистском случае, когда масса
частицы зависит от ее массы и скорости,
т.е.
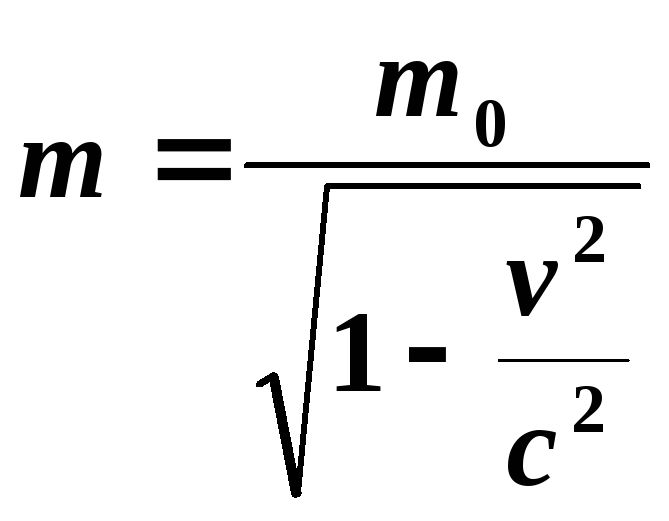 , то
, то
![]() ,
,
где mо - масса покоящейся частицы, m - масса частицы, движущейся со скоростью , h - постоянная Планка. Для электрона в электронно-лучевой трубке с ускоряющем напряжением 2кВ 0,3 А. Известно, что видимый свет имеет 5500 А, поэтому обнаружить волну такой длины достаточно трудно.
Рис.
21.1
монокристалле никеля или лития, затем улавливались по разным направлениям электронной ловушкой
и их интенсивность измерялась включенным гальванометром.
Зависимость интенсивности отраженных электронов от угла рассеяния имела вид, изображенный на рис. 21.2, т.е. наблюдалась типичная дифракционная картина. Дифракционная картина, рассчитанная по формуле (21.1) и экспериментальная хорошо совпадают. Таким образом опытным путем подтверждена гипотеза де Бройля.
Позднее она подтверждалась неоднократно, например, в опытах Тартаковского и Томсона при рассеянии электронов на фольге, в опытах В.А.Фабриканта с отдельным электроном.
Рис. 21.2
20.2. Соотношение неопределенностей Гейзенберга
Если
частица - волна, то как же определить ее
точное положение в пространстве? В 1927
г. это рассмотрел Гейзенберг. Материальная
точка определяется в пространстве в
каждый момент времени координатами и
скоростью, т.е. импульсом. На основании
![]() можно определить в любой последующий
момент времени и координату и импульс,
причем с какой угодно точностью.
можно определить в любой последующий
момент времени и координату и импульс,
причем с какой угодно точностью.
Это в классической механике, а для элементарной частицы, как показал Гейзенберг, координата и импульс определяются, лишь, с какой-то точностью x и y .
Чтобы определить положение и импульс, например, электрона, его надо "осветить" фотонами и получить рассеянный фотон. В следствие дифракции, определение координаты не может быть точнее , т.е. x . При рассеянии фотона у электрона изменяется импульс на величину
px порядка импульса фотона: p=h/ .
Отсюда погрешность в определениях: x p > h/ > h
Аналогично для других координат, т.е.
x px > h
y py > h (21.2)
z pz > h
Зависимости (21.2) называются соотношениями неопределенностей Гейзенберга. Они существуют не только для координат и импульсов. Например, частица с энергией W на определенном энергетическом уровне находится в течение времени t. В этом случае соотношение неопределенностей
W t > h
Соотношение неопределенностей имеют принципиальный характер. Их нельзя связывать с уровнем развития физики. Они служат критерием насколько можно применять понятия классической механики к микромиру.
21.3. Волновая функция и ее статистический смысл
Волны де Бройля не электромагнитные, они имеют квантовую природу и не имеют аналогов в классической физике. Известно, что любая волна по природе характеризуется волновой функцией. В квантовой механике состояние списывается с помощью волновой функции . Физический смысл волновой функции (или - функции) можно показать на примере дифракции электронов.
С волновой точки зрения наличие максимумов числа электронов в некоторых направлениях означает, что эти направления соответствуют наибольшей интенсивности волн де Бройля. Но интенсивность пропорциональна квадрату амплитуды волны ( I ~ [A]2 ). В нашем случае A . Интенсивность дает вероятность того, что частица находится в этой точке, т.е. []2 - квадрат модуля амплитуды волн де-Бройля в данной точке определяет вероятность того, что частица находится в этой точке.
Вероятность dW того, что частица находится в элементе объема dV , пропорциональна []2 и dV , т.е. dW=[]2dV
Физический смысл имеет не сама функция , а квадрат ее модуля: ||2 = *
(где * - функция, комплексно сопряженная с ). Величина []2 имеет смысл плотности вероятности
![]() (21.3)
(21.3)
т.е. определяет вероятность пребывания частицы в данной точке пространства. Вот почему волны де-Бройля называют иногда "волнами вероятности". Волновая функция должна удовлетворять условию нормировки
![]() (21.4)
(21.4)
Действительно, вероятность найти частицу во всем бесконечном пространстве: равна единице. Условие (21.4) говорит об объективном существовании частицы во времени и пространстве.
Из физического смысла волновой функции следует, что она должна быть однозначной, конечной, непрерывной во всех областях изменения координат. Волновая функция - основная характеристика состояния объектов в микромире, находится она путем решения уравнения Шредингера
21.4. Уравнение Шредингера
Уравнение Шредингера играет в квантовой механике такую же роль, что и уравнение Ньютона в классической механике. Как и уравнение движения Ньютона в классической механике, уравнение Шредингера в квантовой механике не выводится, а постулируется. Уравнение нельзя вывести из каких-либо известных ранее соотношений. Справедливость его доказывается тем, что выводы квантовой механики, полученные с помощью этого уравнения в атомной и ядерной физике, находятся в хорошем согласии с опытом.
Уравнение Шредингера имеет вид:
![]() (21.4)
(21.4)
Оно
было предложено Шредингером в 1926 г. и
называется временным уравнением
Шредингера (уравнение Шредингера со
временем). Здесь:![]() - приведенная постоянная Планка; m
- масса частицы; i
- мнимая единица;
- оператор Лапласа, а
- приведенная постоянная Планка; m
- масса частицы; i
- мнимая единица;
- оператор Лапласа, а
![]() -
в декартовых координатах.
-
в декартовых координатах.
Как следует из уравнения, вид волновой функции определяется потенциальной энергией U , т.е. характером сил действующих на частицу. Вообще говоря потенциальная энергия U есть функция координат и времени: U=U(x,y,z,t).
Д ля
стационарного силового поля (т.е. не
изменяющегося во времени) U
не зависит явно от времени, U
= U(t)
и является функций только координат:
U=U(x,y,z).
Оказывается, в этом случае волновая
функция распадается на два множителя,
один из которых зависит только от
времени, второй - только от координат:
ля
стационарного силового поля (т.е. не
изменяющегося во времени) U
не зависит явно от времени, U
= U(t)
и является функций только координат:
U=U(x,y,z).
Оказывается, в этом случае волновая
функция распадается на два множителя,
один из которых зависит только от
времени, второй - только от координат:
(x,y,z,t)=![]() (x,y,z),
где E
- полная энергия частицы.
(x,y,z),
где E
- полная энергия частицы.
Подставляя это выражение во временное уравнение Шредингера, получаем:
![]()
Сокращая
на общий множитель
![]() ,
запишем
,
запишем
![]() или
или
![]() (21.5)
(21.5)
Уравнение (21.5) называется уравнением Шредингера для стационарной состояний или стационарное уравнение Шредингера. В стационарное уравнение Шредингера входит в качестве параметра полная энергия частицы Е. В теории дифференциальных уравнений доказывается, что уравнения такого вида, как уравнения Шредингера, имеют решения однозначные, конечные, непрерывные не при любых значениях параметра Е, а лишь при некоторых избранных значениях. Эти значения называются собственными значениями энергии, а соответствующие им решения уравнения Шредингера, называются собственными волновыми функциями.
