
Сборник методичек по физике - УГНТУ / Гусманова21
.pdf1
Министерство образования и науки Российской Федерации Государственное образовательное учреждение Высшего профессионального образования
«УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра физики
ДИФФУЗИЯ ГАЗОВ
Учебно-методическое пособие к лабораторной работе по молекулярной физике
6-1
Уфа 2010

2
Учебно-методическое пособие содержит краткую теорию, инструкции и контрольные вопросы по выполнению лабораторной работы по теме «Диффузия газов». Пособие предназначено для студентов всех форм обучения УГНТУ.
Составители: Гусманова Г.М., доц., канд.хим.наук Мукаева Г.Р., доц., канд.техн.наук
Рецензент: Маненкова Л.К., доц., канд. физ.-мат. наук
СУфимский государственный нефтяной технический университет, 2010
3
Лабораторная работа 6-1
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ДИФФУЗИИ ПАРОВ ВОДЫ В ВОЗДУХЕ МЕТОДОМ ГОРИЗОНТАЛЬНОЙ ТРУБКИ
Цель работы: изучение явления диффузии, определение коэффициента диффузии.
Приборы и принадлежности: стеклянная трубка, микроскоп, секундомер, исследуемая жидкость, линейка, психрометр.
ТЕОРИЯ МЕТОДА
Диффузия относится к явлениям переноса. Все явления переноса возникают в газах в результате небольшого отклонения от равновесного состояния, нарушения полной хаотичности движения молекул, что сопровождается отклонением от максвелловского закона распределения молекул по скоростям. Именно отклонениями от этого закона объясняется направленныйперенос массы (диффузия), импульса упорядоченного движения (вязкость) и внутренней энергии (теплопроводность).
Диффузией называется явление самопроизвольного взаимного проникновения и перемешивания частиц соприкасающихся газов (а также жидкостей и твердых тел). При постоянной температуре явление диффузии состоит в переносе массы газа из мест с большей концентрацией в места с меньшей его концентрацией вследствие беспорядочного (теплового) движения молекул. В химически чистых газах при постоянной температуре из-за малых случайных отклонений от средних значений плотности (или концентрации) происходит диффузия молекул газа в среде того же газа - это явление называют самодиффузией . Для смеси газов диффузия вызывается различием в концентрациях отдельных газов в разных частях объема смеси.
В химически однородном газе перенос вещества при диффузии подчиняется
закону Фика ( 1855 г. ) :
|
mуд D |
dρ |
, |
|
(1) |
|
|||||
|
|
dx |
|
|
|
где mуд- удельный поток массы, равный массе вещества m , |
диффундирующего |
||||
за время dt через площадку S, расположенную перпендикулярно направлению переноса вещества. Т. е. удельный поток массы (mуд) равен массе вещества
переносимого в единицу времени через единицу площади поверхности, перпендикулярной направлению переноса:
mуд |
dm |
; |
(2) |
|
|||
|
Sdt |
|
|

4
ρ - плотность газа: D - коэффициент диффузии; dρ - градиент плотности, dx
показывающий изменение плотности на единицу длины в направлении наибольшего возрастания плотности. Знак минус в формуле (1) показывает, что перенос массы при диффузии происходит в направлении убывания плотности газа.
Из уравнения Фика видно, что коэффициент диффузии D равен удельному потоку массы mуд при единичном градиенте плотности. Единица измерения D в СИ - м2/с.
При стационарной диффузии удельные потоки массы, переносимые в прямом и обратном направлениях одинаковы. Для самодиффузии и взаимодиффузии, если размеры и массы молекул газов примерно одинаковы, будут равны и коэффициенты диффузии разных компонентов смеси. Равенство коэффициентов диффузии имеет место и для взаимодиффузии газов, сильно отличающихся размерами и массой молекул, если концентрация компонентов очень мала.
Основной предпосылкой в молекулярно-кинетической теории явлений переноса является равная вероятность всех направлений при тепловом движении молекул. Так как наше пространство трехмерное, то в одном направлении движется в среднем 1/6 часть всех молекул.
Рассмотрим смесь двух газов, общее давление которой везде одинаково, то есть полное число молекул в единице объема n остается постоянным, так что результирующее перемещение молекул вещества отсутствует. Пусть n(1) - число молекул газа 1 смеси в единице объема. В состоянии равновесия n(1) не зависит от координат. Если же распределение не является однородным, то n(1) зависит от координаты, при этом возникает перемещение молекул газа 1 (диффузия) таким образом, чтобы достичь равномерного распределения по всему объему.
X |
|
n(1)1 |
|
|
|
|
Пусть |
n(1) |
зависит |
только |
||||
|
|
|
|
|
|
от координаты х. Рассмотрим |
||||||||
|
|
|
|
|
|
|
||||||||
|
поток частиц |
|
|
|
|
|||||||||
|
|
|
|
|
в |
газе |
некоторую |
плоскость |
||||||
|
|
S |
с |
неизменной |
координатой |
|||||||||
|
|
|
|
|
x |
= const |
(рис. |
1). |
Тогда |
|||||
|
|
|
|
|
dn(1) |
|
||||||||
|
0 |
|
|
|
концентрация |
молекул |
на |
|||||||
|
|
|
|
|
d x |
расстоянии |
|
|
|
длины |
||||
|
|
|
|
свободного |
пробега |
λ |
от |
|||||||
|
|
градиент |
||||||||||||
Y |
поток частиц |
|
концентрации |
площадки S с одной стороны |
||||||||||
|
|
|
|
|
будет |
n(1)1, |
а с |
другой |
- |
|||||
|
|
|
|
|
|
|
||||||||
|
|
n(1)2 |
|
|
|
|
n(1)2. |
Так |
как |
n(1) |
зависит |
|||
|
|
|
|
|
|
только от координаты x то |
||||||||
|
|
|
|
|
|
|
||||||||
|
Рис. 1 |
|
|
|
|
среднее число молекул газа 1, |
||||||||
|
|
|
|
|
|
|
пересекающих |
|
единицу |
|||||
|
|
|
|
|
|
|
площади в единицу времени в |
|||||||

|
|
5 |
направлении оси Х, равно |
1 |
V n(1) и в противоположном направлении равно |
|
||
|
6 |
1 |
|
|
1  V
V n(1)2 , где
n(1)2 , где 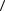 V
V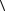 средняя скорость молекул.
средняя скорость молекул.
6
Концентрация молекул по оси X на расстоянии длины свободного пробега λ от рассматриваемой площадки S равна:
|
|
n(1) n(1) |
dn(1) |
λ, |
n(1) |
2 |
n(1) |
dn(1) |
λ, |
|
1 |
dx |
|
|
|
dx |
|
||||
|
dn(1) |
|
|
|
|
|
|
|||
где |
- градиент концентрации, |
то есть изменение концентрации n(1) на |
||||||||
|
||||||||||
|
dx |
|
|
|
|
|
|
|
||
единицу длины в направлении оси X.
Поэтому результирующее число молекул, проходящих в единицу времени через единичную площадь, равно:
1 |
V n(1) |
n(1) |
2 |
|
1 |
|
V λ |
dn(1) |
, |
|
|
|
|||||||
6 |
1 |
|
3 |
|
dx |
||||
|
|
|
|
||||||
а удельный поток массы равен произведению этого числа молекул на массу одной молекулы:
mуд |
|
1 |
|
V λm0 |
dn(1) |
|
1 |
|
V λ |
dρ |
, |
|
|
|
|
||||||||
|
3 |
|
dx 3 |
|
dx |
||||||
где m0 - масса одной молекулы газа 1; ρ – плотность газа.
Сравнение этого уравнения с законом Фика (1) дает выражение для коэффициента диффузии:
D |
1 |
V λ . |
(3) |
|
3
Таким образом, молекулярно-кинетическое рассмотрение диффузии позволяет связать макроскопический параметр D с микроскопическими параметрами 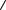 V
V 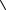 , λ , характеризующими тепловое движение молекул.
, λ , характеризующими тепловое движение молекул.
Учитывая, что средняя арифметическая |
скорость равна V |
8RT |
, |
||||
|
|||||||
|
|
|
|
|
|
||
средняя длина свободного пробега λ |
|
1 |
, среднее эффективное сечение |
||||
|
|
|
|||||
2πd2n |
|||||||
|
|
|
|
|
|||
молекулы σ πd2 , давление p nkT , значение коэффициента диффузии можно рассчитать по формуле:
D |
1 |
|
|
8RT |
|
|
1 |
|
|
или |
|||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
2 d 2 n |
||||||||||
3 |
|
|
|
||||||||||
D |
2 kT |
|
|
|
. |
|
|||||||
|
|
RT |
(4) |
||||||||||
|
|
|
3 Pd 2 |
|
|
|
|
|
|
||||
Коэффициент диффузии обратно пропорционален давлению газа D 1/P. В случае смеси разных газов состоящих из молекул примерно одинакового размера,

6
Р означает суммарное давление. При Т = const с увеличением давления D уменьшается, так как увеличивается частота столкновений молекул газа из-за увеличения плотности (или концентрации n).
От температуры коэффициент диффузии зависит более сложным образом. Если считать эффективное сечение σ const постоянным, то
3
D ~ T 2 . P
Следовательно соотношение D и T зависят от характера процесса, при котором изменяется температура газа. Приведем в качестве примера некоторые процессы:
1. При изохорическом изменении температуры (V = const): n P/kT const, D ~ 
 T , увеличение D с ростом температуры связано исключительно с увеличением скорости теплового движения (
T , увеличение D с ростом температуры связано исключительно с увеличением скорости теплового движения (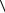 V
V ~
~ 
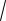 T ).
T ).
2. При изобарическом нагревании (P = const): увеличение D с ростом
температуры (расширении) обусловлено не только увеличением 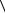 V
V ~
~ 
 T , но и
T , но и
увеличением λ за счет уменьшения концентрации молекул (или при уменьшении частоты столкновений молекул газа).
3. При адиабатном сжатии коэффициент диффузии уменьшается из-за увеличения частоты столкновения молекул как за счет увеличения скорости, так и за счет увеличения концентрации молекул газа.
1
Зависимость D от массы молекулы имеет вид D ~ 1 . Cледовательно, чем m 2
больше масса молекулы, тем меньше при прочих одинаковых условиях коэффициент диффузии данного газа.
РАСЧЕТНЫЕ ФОРМУЛЫ Скорость испарения жидкости при постоянной температуре не зависит от
диффузии паров жидкости в воздухе. Идея опыта состоит в определении времени τ, за которое испарится из трубки с жидкостью определенная масса жидкости m через площадку S. В трубке над поверхностью жидкости - насыщенный пар с плотностью ρ1. В комнате находится пар с абсолютной влажностью ρ2. При диффузии пара из трубки с жидкостью в комнату его плотность меняется на величину Δρ = ρ1 – ρ2 на расстоянии L.
По закону диффузии (1) можно определить коэффициент диффузии паров жидкости в воздухе. Масса m испарившейся за время τ жидкости равна произведению плотности жидкости на объем (рис.2):
m ρжS L.

7
|
ρж |
|
|
ρ1 |
|
ρ2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ΔL |
|
L |
|
Рис.2. ρж - плотность |
|
|
при комнатной температуре; L - |
|||
жидкости (воды) |
||||||
расстояние, на которое перемещается уровень жидкости вследствие испарения и диффузии за время t ; L - расстояние от открытого конца стеклянной трубки до уровня жидкости в начале опыта (т.е. перед включением секундомера); ρ1 - плотность насыщенного пара при комнатной температуре; ρ2 - абсолютная влажность воздуха в комнате, она равна плотности насыщенного пара при точке росы.
Закон диффузии Фика принимает вид:
|
|
|
ρжSR |
|
D |
Δρ |
, |
|
|
|
|
|
|
|
|
|||||
|
|
|
S |
|
|
|
||||||||||||||
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
|
|
|
||||
откудаэкспериментальнокоэффициентдиффузии можноопределитьпоформуле:: |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
ρжL L |
|
|
|
|
|
|||||||||
|
|
Dэксп |
|
|
|
|
|
|
|
. |
|
|
|
(5) |
||||||
|
|
ρ ρ |
2 |
|
||||||||||||||||
Для теоретического |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
можно применить |
||||
расчета значения |
D |
|||||||||||||||||||
|
|
|
|
|
|
2 kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
выражение (4): |
D теор |
|
|
|
|
|
|
|
|
RT |
. |
|
(6) |
|||||||
3 Pат d |
2 |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Здесь в трубке со стороны открытого конца находится смесь пара и воздуха. Размеры молекул газов примерно равны: dH2O 3 10 10м, dвоздух 3 10 10м, поэтому Р = Рат (Рат – атмосферное давление).
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1.Заполнить трубку жидкостью (водой), опустив один конец в сосуд с жидкостью. Когда трубка заполнится до уровня, расположенного от другого конца трубки на расстояния L = 1 - 1,5 см (рис.2), вынуть ее из сосуда, зажав конец пальцем. Другой конец изолировать пластилином.
2.Установить заполненную трубку на столе микроскопа горизонтально, с помощью шкалы микроскопа измерить расстояние от поверхности жидкости до открытого конца трубки L . Включить секундомер и измерить смещение уровня жидкости
L за время τ = 20 мин. Цена деления микроскопа равна 1/80 мм.
3.Определить по табл. 3 плотность насыщенного пара ρ1 при комнатной температуре Т.
8
4. Определить с помощью гигрометра или психрометра абсолютной влажности воздуха ρ2. Психрометр состоит из двух термометров - сухого и смоченного. Сухой показывает температуру воздуха в комнате Т, а смоченный, теплоприемник которого обвязан влажной тканью, собственную температуру Т1, зависящую от испарения, происходящего с поверхности резервуара. Вследствие расхода тепла на испарение показания смоченного термометра тем ниже, чем суше_воздух, в котором измеряется влажность. Психрометрическая табл. 2 позволяет, зная разность показаний сухого и влажного термометров (Т – Т1) и - температуру влажного термометра Т1, найти относительную влажность воздуха в процентах φ. Тогда абсолютная влажность воздуха ρ2, кг/м3 (то есть количество паров воды в 1м3),
2 1 10 2.
5.Определить плотность воды ρж при комнатной температуре Т по таблице в лаборатории.
6.Вычислить по формуле (5) экспериментальное значение коэффициента диффузии
Dэксп.
7.Рассчитать погрешность экспериментального значения коэффициента
диффузии (ΔDэксп).
8. Используя значения атмосферного давления в комнате Рат (Рат определяется по барометру, находящемуся в лаборатории), комнатной температуры Т, молярной массы воды ? = 0,018 кг/моль, эффективного диаметра молекулы воды
d = 3·10-10 м, вычислить значение Dтеор поформуле(6).
9.Значения всех измеренных и расчитанных величин внести в табл. 1.
10. Сравнить экспериментальное и теоретическое значения коэффициента диффузии (Dэксп иDтеор). Сделать вывод.
Таблица 1. Экспериментальные и справочные данные для вычисления Dэксп и Dтеор.
Физическая величина |
Численное значение |
L, м |
|
, с |
|
ΔL, м |
|
ρ1, кг/м3 |
|
ρ2, кг/м3 |
|
ρж, кг/м3 |
|
Рат, Па |
|
Т, К |
|
Т1, К |
|
?, кг/моль |
|
D, м |
|
Dэксп , м2/с |
|
Dтеор , м2/с |
|
Dэксп , м2/с |
|
9
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Объяснитьмеханизм возникновенияявлениядиффузиивгазах.
2.Чтоназываетсяудельнымпотокоммассы?
3.Физическийсмыслкоэффициентадиффузии.
4. Какой смысл имеет градиент какой-либо физической величины, например,плотности?
5.Как зависит коэффициент диффузии газов от массы молекул, внешнего давленияи температуры?
6.Вывести формулу экспериментального определения коэффициента диффузии. Объяснить идею опыта по определению коэффициента диффузии паров воды в воздухеметодом горизонтальнойтрубки.
Таблица 2.
Психрометрическая таблица. Относительная влажность воздуха (φ, %).
Показания |
|
|
|
|
Разность показаний |
|
|
|
|
||||
влажного |
|
|
сухого и влажного термометров, |
|
|
||||||||
термометра, |
|
|
|
|
|
|
0С |
|
|
|
|
||
0С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0,5 |
|
1,0 |
|
1,5 |
|
2,0 |
|
2,5 |
|
3,0 |
3,5 |
0 |
100 |
90 |
|
81 |
|
73 |
|
64 |
|
57 |
|
50 |
43 |
1 |
100 |
90 |
|
82 |
|
74 |
|
66 |
|
59 |
|
52 |
45 |
2 |
100 |
90 |
|
83 |
|
75 |
|
67 |
|
61 |
|
54 |
47 |
3 |
100 |
90 |
|
83 |
|
76 |
|
69 |
|
63 |
|
56 |
49 |
4 |
100 |
91 |
|
84 |
|
77 |
|
70 |
|
64 |
|
57 |
51 |
5 |
100 |
91 |
|
85 |
|
78 |
|
71 |
|
65 |
|
59 |
54 |
6 |
100 |
92 |
|
85 |
|
78 |
|
72 |
|
66 |
|
61 |
56 |
7 |
100 |
92 |
|
86 |
|
79 |
|
73 |
|
67 |
|
62 |
57 |
8 |
100 |
92 |
|
86 |
|
80 |
|
74 |
|
68 |
|
63 |
58 |
9 |
100 |
93 |
|
86 |
|
81 |
|
75 |
|
70 |
|
65 |
60 |
10 |
100 |
94 |
|
87 |
|
82 |
|
76 |
|
71 |
|
66 |
61 |
11 |
100 |
94 |
|
88 |
|
82 |
|
77 |
|
72 |
|
67 |
62 |
12 |
100 |
94 |
|
88 |
|
82 |
|
78 |
|
73 |
|
68 |
63 |
13 |
100 |
94 |
|
88 |
|
83 |
|
78 |
|
73 |
|
69 |
64 |
14 |
100 |
94 |
|
89 |
|
83 |
|
79 |
|
74 |
|
70 |
66 |
15 |
100 |
94 |
|
89 |
|
84 |
|
80 |
|
75 |
|
71 |
67 |
16 |
100 |
95 |
|
90 |
|
84 |
|
80 |
|
75 |
|
72 |
67 |
17 |
100 |
95 |
|
90 |
|
84 |
|
81 |
|
76 |
|
73 |
68 |
18 |
100 |
95 |
|
90 |
|
85 |
|
81 |
|
76 |
|
74 |
69 |
19 |
100 |
95 |
|
91 |
|
85 |
|
82 |
|
77 |
|
74 |
70 |
20 |
100 |
95 |
|
91 |
|
86 |
|
82 |
|
78 |
|
75 |
71 |
10
21 |
100 |
95 |
91 |
86 |
83 |
79 |
75 |
71 |
22 |
100 |
95 |
91 |
87 |
83 |
79 |
76 |
72 |
23 |
100 |
96 |
91 |
87 |
83 |
80 |
76 |
72 |
24 |
100 |
96 |
92 |
88 |
84 |
80 |
77 |
73 |
25 |
100 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
26 |
100 |
96 |
92 |
88 |
85 |
81 |
78 |
74 |
27 |
100 |
96 |
92 |
88 |
85 |
81 |
78 |
75 |
28 |
100 |
96 |
92 |
89 |
85 |
82 |
79 |
75 |
29 |
100 |
96 |
92 |
89 |
85 |
82 |
79 |
75 |
30 |
100 |
96 |
92 |
89 |
85 |
82 |
79 |
77 |
|
|
|
Психрометрическая таблица. |
Продолжение таблицы 2. |
||||||||
|
|
|
|
|
|
|
|
|||||
|
|
Относительная влажность воздуха (φ, %). |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Показания |
|
|
|
|
Разность показаний |
|
|
|
||||
влажного |
|
|
|
сухого и влажного термометров, |
|
|
|
|||||
термометра, |
|
|
|
|
|
0С |
|
|
|
|
|
|
0С |
|
|
|
|
|
|
|
|
|
|
|
|
|
4,0 |
|
4,5 |
5,0 |
5,5 |
6,0 |
6,5 |
|
7,0 |
7,5 |
8,0 |
|
0 |
36 |
|
31 |
26 |
20 |
16 |
11 |
|
7 |
3 |
- |
|
1 |
39 |
|
33 |
29 |
23 |
19 |
16 |
|
11 |
7 |
- |
|
2 |
42 |
|
35 |
31 |
26 |
23 |
18 |
|
14 |
10 |
- |
|
3 |
44 |
|
39 |
34 |
29 |
26 |
21 |
|
17 |
13 |
10 |
|
4 |
46 |
|
41 |
36 |
32 |
28 |
24 |
|
20 |
16 |
14 |
|
5 |
48 |
|
43 |
39 |
34 |
27 |
23 |
|
23 |
19 |
17 |
|
6 |
50 |
|
45 |
41 |
35 |
33 |
29 |
|
26 |
22 |
19 |
|
7 |
52 |
|
47 |
43 |
39 |
35 |
31 |
|
28 |
26 |
22 |
|
8 |
54 |
|
49 |
45 |
41 |
37 |
33 |
|
30 |
27 |
25 |
|
9 |
55 |
|
51 |
47 |
43 |
39 |
35 |
|
32 |
29 |
27 |
|
10 |
57 |
|
53 |
48 |
45 |
41 |
38 |
|
34 |
31 |
28 |
|
11 |
58 |
|
55 |
50 |
47 |
43 |
40 |
|
36 |
33 |
30 |
|
12 |
59 |
|
56 |
52 |
48 |
44 |
42 |
|
38 |
35 |
32 |
|
13 |
61 |
|
57 |
53 |
50 |
46 |
43 |
|
40 |
37 |
34 |
|
14 |
62 |
|
58 |
54 |
51 |
47 |
45 |
|
41 |
30 |
36 |
|
15 |
63 |
|
59 |
55 |
52 |
49 |
46 |
|
43 |
41 |
37 |
|
16 |
64 |
|
60 |
57 |
53 |
50 |
48 |
|
44 |
42 |
39 |
|
17 |
65 |
|
61 |
58 |
54 |
52 |
49 |
|
46 |
44 |
40 |
|
18 |
66 |
|
62 |
59 |
56 |
53 |
50 |
|
47 |
45 |
42 |
|
19 |
66 |
|
63 |
60 |
57 |
54 |
51 |
|
48 |
46 |
43 |
|
20 |
67 |
|
64 |
61 |
58 |
55 |
53 |
|
49 |
47 |
44 |
|
21 |
68 |
|
65 |
62 |
59 |
56 |
54 |
|
51 |
49 |
46 |
|
