
Хладотранспорт / 02-Студентам Хладотранспорт и доставка-2013-2 / 01-Учебник / 2-Главы 4-6-У
.pdfГ л а в а 4
Основы теплоэнергетики
4.1Основы термодинамики
4.1.1Термодинамическая система
Объекты хладотранспорта (холодильные машины, грузовые камеры, теплообменные аппараты, рефрижераторный подвижной состав и т. д.) могут быть при самом общем подходе представлены макроскопическими системами, состоящими из большого числа элементарных частиц: молекул и атомов. В таких системах происходят превращения вещества и энергии, сопровождающиеся тепловыми эффектами. Закономерности последних изучают термодинамика и теория теплопереноса, составляющие научный фундамент теплоэнергетики. Термодинамика и теплоперенос относятся к феноменологическим наукам, поскольку они изучают явления опытным путём, рассматривают их в целом, не вникая в молекулярную природу своих объектов – термодинамических систем.
Термодинамической системой можно считать любую совокупность материальных тел, взаимодействующих потоками энергии и вещества друг с другом и с телами внешней среды. Выделение термодинамической системы из некоторой области материального мира вполне произвольно и подчиняется решению конкретной задачи. Границей такой системы служат реальные или воображаемые поверхности, через которые осуществляется обмен потоками энергии и вещества. Присутствие обеих субстанций во внешних взаимодействиях характеризует систему как открытую. Если через границу проникает лишь энергия, то система считается изолированной. Идеальная теплоизолированная система носит название адиабатной. Отсутствие какого-либо граничного взаимодействия свойственно закрытой системе. Различные объекты хладотранспорта с определённым приближением могут быть отнесены к тем или другим из перечисленных систем: открытой, закрытой или изолированной.
Рассмотрим простейшую термодинамическую систему: рабочее тело холодильной машины (хладагент), осуществляющее в ней взаимные превращения теплоты и работы. В качестве хладагента может выступать, например, хладон в парообразном или жидком состоянии либо в виде парожидкостной смеси. Хладагент обменивается теплотой с холодоносителем – воздухом помещения рефрижераторного вагона. Ещё один пример про-
53
стейшей системы: топливовоздушная смесь в цилиндре двигателя внутреннего сгорания.
Каждая система, в том числе и простейшая, обладает большим (бесконечным!) набором свойств, которые характеризуют различные стороны её сущности, а в совокупности – состояние рассматриваемой системы. Свойствами являются, например, давление, температура, удельный объём, плотность и др.
Давление р – макроскопическая характеристика, отражающая молеку-
лярную природу жидкости или газа. Давление численно равно силе воздействия молекул на некоторую поверхность, отнесённую к величине этой поверхности. Значение давления пропорционально числу молекул, их массе и скорости перемещения. Единица измерения давления – паскаль (Па),
1 Па = 1 н/м2, где н (ньютон) – единица силы.
Температура t – физическая величина, характеризующая степень нагретости тела, °С. Она, как и давление, проявляет микроскопическую природу вещества, выводя её на наглядный макроскопический уровень. Температура выступает как мера интенсивности теплового движения молекул.
Термодинамическая (абсолютная) температура Т, К, отсчитывается по шкале Кельвина:
Т = t + 273,15.
Удельный объём v – это объём единицы массы вещества, м3/кг. Обрат-
ную удельному объёму величину называют плотностью: , кг/м3.
Удельный объём, давление и температуру называют термическими свойствами вещества.
Между основными параметрами состояния рассматриваемой термоди-
намической системы (р, v, T) существует вполне определённая связь, на-
зываемая уравнением состояния:
f(р, v, T) = 0. |
(4.1) |
В случае идеального газа это уравнение имеет вид
pv = R T,
54

называемый уравнением Клапейрона. В нём R – газовая постоянная, R = = 8134/М кДж/(кг К); М – киломоль вещества, т. е. молекулярная масса в килограммах.
Уравнение состояния в неопределённой форме (4.1) может быть раз-
решено относительно любого из параметров состояния, например:
T = f1(p, v).
Из этого примера видно, что состояние простейшей термодинамической системы может быть определено всего двумя параметрами, т. е. задано точкой на плоскости. Такую двухкоординатную плоскость называют диаграммой состояний.
Уравнение состояния реальных газов, учитывающее силы межмолеку-
лярного взаимодействия, носит название уравнения Ван-дер-Ваальса:
a
(p v2)(v б) R T ,
где а и б – численные коэффициенты, отражающие природу конкретного вещества.
Наряду с элементарными термодинамическими параметрами могут быть установлены сложные (комплексные) параметры, называемые функциями состояния; они также выступают характеристиками состояния термодинамической системы. Важнейшей из функций состояния является внутренняя энергия U, определяемая как сумма кинетической, потенциальной и внутриядерной энергий частиц, а также энергии электронных оболочек атома. В задачах хладотранспорта оказывается достаточным учесть изменение лишь первых двух составляющих и принять U = K + П.
Здесь кинетическая энергия частиц К является функцией температуры Т, а
потенциальная П – занимаемого газом объёма V.
Величину u U , Дж/кг, называют удельной внутренней энергией. Как
M
функция состояния, величина u может быть выражена через любую пару простейших (основных, независимых) термодинамических параметров:
u f1(p,v); |
u f2(p,T); |
u f3(v,T). |
55
Если термодинамические параметры одинаковы во всех точках системы и неизменны во времени, то такое её состояние называется равновесным. Реальная система обычно неравновесная, т. е. в ней всегда существу-
ют градиенты (пространственные или временные) величин p, v, T и других. Их наличие является следствием взаимодействия системы с объектами внешней среды.
Изменение состояния (хотя бы одного из параметров) термодинамической системы во времени называется термодинамическим процессом. Система, выведенная из состояния равновесия, может под действием градиентов параметров самопроизвольно вернуться к равновесию. Такой процесс получил название релаксация. Его продолжительность характеризуют временем релаксации. По сравнению со временем релаксации термодинамический процесс может быть медленным (и тогда он рассматривается как практически равновесный) или быстрым (неравновесным).
Равновесный процесс обычно представляется как непрерывный ряд последовательно проходимых состояний равновесия; в каждом из них справедливо уравнение состояния системы. В неравновесном процессе соотношения классической термодинамики несправедливы; здесь необходи-
мо применять закономерности неравновесной термодинамики.
4.1.2 Механические и тепловые взаимодействия
Типичный термодинамический процесс – расширение (сжатие) рабочего тела, например газа в цилиндре поршневого компрессора. Такой процесс характеризуется работой, т. е. затратой или выделением механической энергии. Работа, как известно, определяется произведением приложенной к рабочему телу силы на путь её действия. В рассматриваемом случае можно написать для бесконечно малого перемещения на единицу массы (кг) рабочего тела
dl pdv. |
(4.2) |
Здесь l – удельная работа. Работа расширения на всём пути действия переменной силы (давления) есть интеграл
2 |
|
l pdv. |
(4.3) |
1 |
|
56

Процесс расширения может быть изображён в декартовых координатах (на p, v- диаграмме) как траектория всех проходимых состояний рабочего тела, как показано на рисунке 4.1. Если на этой диаграмме вычислить площадь полоски бесконечно малой ширины dv, имеющей ординату p, то получим выражение (4.2) для элементарной работы dl. Следовательно, вся площадь под кривой 1-2 определяет работу расширения (изменения объёма). Для другой траектории процесса работа будет иной, т. е. она является функцией процесса. Численное значение работы тем больше, чем сильнее изменяется в процессе объём. Это определяет выбор в качестве рабочих тел хорошо сжимаемых сред: газов и жидкостей, претерпевающих в процессе фазовые превращения – кипение или конденсацию.
Рисунок 4.1 – Процесс расширения рабочего тела
Работа всегда связана с организованным перемещением макроскопических тел в пространстве, поэтому она характеризует упорядоченную (макрофизическую) форму передачи энергии.
Помимо работы существует и другая, микрофизическая форма передачи энергии, осуществляемая на молекулярном (неупорядоченном) уровне взаимодействия системы и окружающей среды. Здесь обмен энергией происходит вследствие неодинаковой интенсивности хаотического движения молекул тел, находящихся в контакте (посредством механизмов теплопроводности или теплообмена) или даже бесконтактно, т. е. на большом уда-
57
лении друг от друга (излучением). Единственное условие такого протекания процесса является различие в температурах взаимодействующих тел. Мерой количества энергии, переданной без совершения работы, служит теплота (Q, Дж или q, Дж/кг).
Теплота, работа и внутренняя энергия – энергетические характеристики, однако между этими понятиями существует большое различие. Внутренняя энергия – это свойство самой системы, одна из характеристик её состояния. Теплота и работа – это характеристики процессов теплового и механического взаимодействий системы с окружающей средой.
4.1.3 Первый закон термодинамики
Как известно, в процессах и явлениях природы энергия не исчезает и не возникает, она лишь переходит из одной формы в другую в эквивалент-
ных количествах. Это – всеобщий закон сохранения и превращения энергии.
Его частным случаем применительно к тепловым явлениям выступает первый закон термодинамики. Он характеризует баланс энергии в процессе, т. е. количественную сторону превращения энергии.
Пусть к некоторому рабочему телу (в расчёте на 1 кг) подводится бес-
конечно малое количество теплоты dq, вследствие чего прирастает его температура dT и удельный объём dv, т. е. возрастает на величину du внутренняя энергия тела. Но при расширении рабочего тела совершается меха-
ническая работа dl против сил внешнего сопротивления (давления). Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
dq du dl. |
(4.4) |
Это уравнение является математическим выражением Первого закона термодинамики. Рассмотрим некоторые частные случаи.
Первый случай Процесс в отсутствие теплообмена (адиабатный), dq = 0. Формально из уравнения (4.4) имеем dl = – du, т. е. работа расширения в адиабатном процессе может совершаться только за счёт уменьшения внутренней энергии; и наоборот, адиабатное сжатие рабочего тела извне приводит к возрастанию внутренней энергии, т. е. к его разогреву, как видно из рисунка 4.2.
58
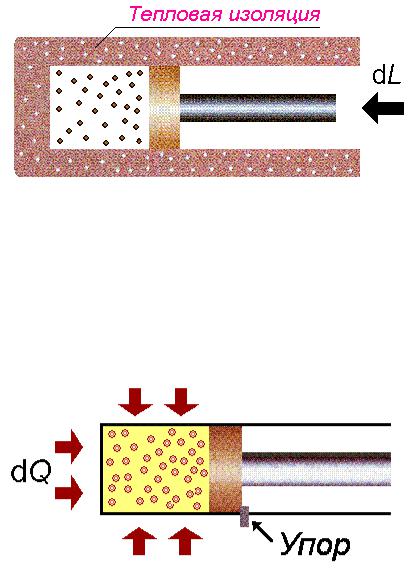
Рисунок 4.2 – Разогрев системы в адиабатном процессе
Второй случай. Процесс при постоянном объёме рабочего тела (изо-
хорный), dl = 0. Для него по рисунку 4.3 имеем dq = du, т. е. подведённая извне теплота целиком расходуется на повышение внутренней энергии данной системы.
Рисунок 4.3 – Разогрев системы в изохорном процессе
Третий случай. Процесс при постоянном значении внутренней энер-
гии, du = 0. В этом случае dq = dl, т. е. вся подведённая извне теплота превращается в эквивалентное ей количество механической работы расширения против внешних сил (рисунок 4.4).
Теплоёмкость
Величина отношения количества теплоты dQ, полученного телом при бесконечно малом изменении его состояния, к вызванному изменению температуры dt называется теплоёмкостью тела (С) в данном процессе или на 1 кг рабочего тела
59

c |
dq |
, |
(4.5) |
|
dt
где с – удельная теплоёмкость, кДж/(кг °С).
Рисунок 4.4 – Работа системы при подводе теплоты
В разных процессах нагрев тела на 1°С требует разного количества теплоты:
– теплоёмкость в изобарном процессе (при постоянном давлении рабочего тела) cp = (dq/dt)p=const;
– теплоёмкость в изохорном процессе (при постоянном объёме рабоче-
го тела) cv = (dq/dt)v=const.
Между теплоёмкостями cp и cv существует вполне определённая связь:
–идеальный газ (формула Майера) – cp = cv + R;
–реальный газ – cp – cv > R;
–жидкость – cp cv.
Обычно значения теплоёмкостей определяются экспериментально и задаются таблично.
Энтальпия (I)
Это ещё одна функция состояния, определяемая как сумма внутренней энергии U и произведения (p V), Дж, или удельная энтальпия, Дж/кг,
i = u + p v.
60

Физический смысл энтальпии – это общее количество энергии (теплоты и работы), которое должно быть подведено к телу, чтобы перевести его из начального состояния в заданное. Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями и не зависит от характера процесса.
Энтальпия, внутренняя энергия и теплоёмкость, относятся к калорическим свойствам вещества.
В изобарном процессе, характерном для теплоэнергетики и холодильной техники, подведённая (или отведённая) теплота расходуется только на повышение (понижение) энтальпии, q = i2 – i1. Поэтому для практических расчётов удобны таблицы (или построенные на их основе диаграммы) энтальпии. Малые изменения энтальпии и температуры связаны соотношением di cpdt.
Реально же конечное приращение энтальпии i определяется зависи-
мостью
t2
i cpdt.
t1
Энтропия (S)
Это функция состояния термодинамической системы. Удельная эн-
тропия s (на 1 кг рабочего тела), кДж/(кг К) определяется из дифференци-
ального уравнения как отношение бесконечно малого приращения теплоты dq к абсолютной температуре T:
ds |
dq |
. |
(4.6) |
|
|||
|
T |
|
|
Сама удельная энтропия находится интегрированием:
dq
s T so.
Постоянная интегрирования so = 0 при Т = 0 К.
61
Энтропия в тепловых явлениях играет такую же роль, как заряд в электрических явлениях. В представлении энтропии своеобразным термическим зарядом и состоит её физический смысл.
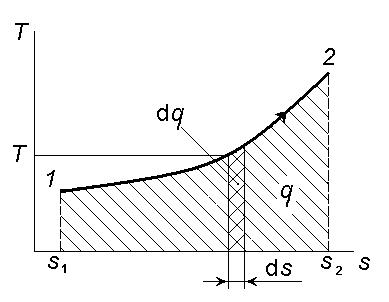
Состояние термодинамической системы может быть изображено точкой на весьма удобной в расчётах T, s -диаграмме. Процесс, как и в случае p,v- диаграммы, определяется траекторией этой точки от начального состояния к конечному состоянию (рисунок 4.5).
Рисунок 4.5 – Изменение состояний системы на T, s-диаграмме
Размер элементарной площадки под кривой процесса, в соответствии с определением (3.6), есть элементарная теплота dq = Tds.
Тогда вся площадь под кривой Т оказывается равной q:
2
q Tds. |
(4.7) |
1 |
|
Здесь теплота процесса выражается через энтропию.
Аналогия структур выражений (4.3) и (4.7) показывает, что изменение энтропии также характеризует теплоту процесса, как изменение объёма – работу расширения.
Поскольку всегда Т > 0, то из определения (4.6) следует, что приращения энтропии и теплоты имеют одинаковый знак, т. е. по характеру из-
62
