
Метода термодинамика(лекции)
.pdf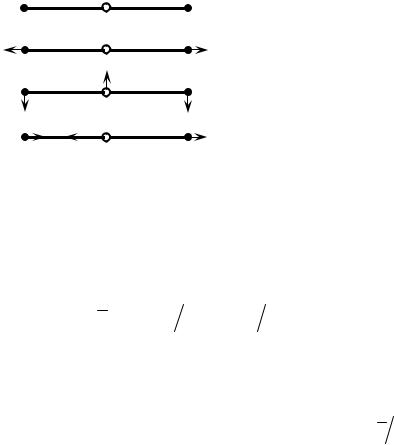
|
|
|
|
свободы); |
колебательное |
движение |
|||||
CO2 |
|
|
(четыре степени свободы). Возможные |
||||||||
|
ν1 |
|
|
типы колебаний изображены на рис. |
|||||||
|
|
|
|
2.7, |
стрелками показаны направления |
||||||
|
ν2 |
|
|
движения в одной фазе колебаний, ν1 , |
|||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ν3 |
|
|
ν |
2 |
и ν |
3 |
– |
означают |
их |
частоты. |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Колебаний |
с |
частотой |
ν2 |
– два, |
|||
|
|
|
Рис. 2.7. |
происходят независимо друг от друга в |
|||||||
|
|
|
|
||||||||
двух перпендикулярных плоскостях. Средняя энергия линейной трехатомной молекулы слагается из средней энергии указанных видов движения:
ε = 3 kT 2 +2 kT 2 + 4kT = 6, 5kT .
В газе из N молекул его внутренняя энергия и теплоемкость при постоянном объеме имеют значения:
E = Nε , CV = (∂E ∂T )V = N ∂ε ∂T .
∂T )V = N ∂ε ∂T .
Вчастности, теплоемкости двухатомного и трехатомного газов,
соответственно, равны CV (2) = 3, 5Nk и CV (3) = 6, 5Nk . Таким образом,
теплоемкость идеальных газов оказывается не зависящей от температуры и определяется исключительно структурой молекулы.
Приведенные расчеты CV хорошо совпадают с экспериментальными данными только для одноатомных молекул. У газа многоатомных молекул наблюдается резкое расхождение измеренных и теоретических данных. Кроме того, теплоемкость этих газов зависит от температуры. Общий характер такой зависимости для газа двухатомных молекул иллюстрирует рис. 2.8.
При очень высоких температурах теплоемкость близка к теоретическому значению CV = 3, 5Nk . С понижением температуры теплоемкость сначала падает до величины CV = 2, 5Nk , т.е. до значения, которое имела бы молекула с абсолютно жесткими связями между атомами (отсутствует
92
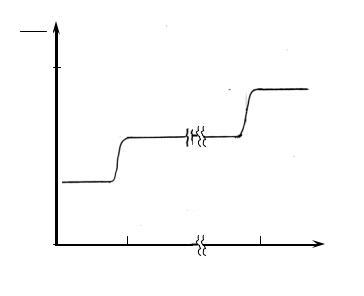
CV
Nk
3,0 

2,0 

1,0 

T в |
T к |
T |
c |
c |
|
Рис. 2.8.
колебательное движение). Дальнейшее понижение температуры приводит к уменьшению теплоемкости до 1, 5Nk , характерного для одноатомного газа,
молекулы которого совершают лишь поступательное движение. Таким образом, в процессе уменьшения температуры происходит ”вымораживание” степеней свободы молекулы. Исчезновение колебательного и вращательного движений находится в резком противоречии с положением классической механики о равноправности степеней свободы.
2.10. Квантовая теория теплоемкости газа двухатомных молекул
2.10.1. Базовые положения . Энергия молекулы слагается из энергии поступательного движения в пространстве ее центра тяжести, движения электронов, колебания и вращения атомов
εвнутр = εэл + εколеб + εвр .
Внутреннее движение является квантованным: квантуются не только движение электронов, но и движение атомов внутри молекулы, т.е. колебательное и вращательное движения. Их энергия принимает дискретный
93

ряд значений. При этом оказывается, что расстояние между соседними уровнями энергии электронов в молекуле ∆εэл гораздо больше расстояния между соседними уровнями энергии колебательного движения ∆εколеб , а
последние намного больше, чем расстояния между соседними уровнями энергии вращения ∆εвр : ∆εэл >> ∆εколеб >> ∆εвр . В первом приближении все три вида движения считаются независимыми друг от друга.
Соседние уровни энергии электронного движения, как и уровни их энергии в атомах, лежат на расстоянии нескольких электрон-вольт, это соответствует температуре в несколько тысяч градусов, Для перевода молекулы с одного уровня электронного движения на другой требуется весьма высокая энергия, как-то: тепловая энергия, соответствующая температуре порядка 104 К, освещение светом, удар быстрых электронов и т.п. Как правило, считают, что источники возбуждения электронного движения отсутствуют и молекулы находятся на самом низком энергетическом уровне электронного движения.
Все виды движения являются независимыми, поэтому общее число состояний молекулы с энергией ε = εпост + εколеб + εвр равно произведению чисел состояний соответствующих видов движения
Ω(ε) = Ω(εпост)Ω(εколеб)Ω(εвр) .
Функцию состояний молекулы также можно представить произведением функциисостоянийпоступательного, колебательногоивращательногодвижений
|
ε |
εпост |
εколеб |
|
εвр |
|||
z = ∑e− |
|
Ω(ε) = ∑e− |
|
Ω(εпост) ∑e− |
|
Ω(εколеб) ∑e− |
|
Ω(εвр) = (2.43) |
kT |
kT |
kT |
kT |
|||||
= zпост zколеб zвр. |
|
|
|
|
|
|
||
Поскольку молекулы являются независимыми и тождественными частицами, функция состояний всего газа, содержащего N молекул, может быть записана в виде
Z = N1 ! zN = N1 ! (zпост)N (zколеб)N (zвр)N .
94
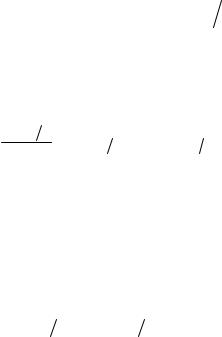
Отсюда находятся выражения для термодинамических потенциалов и теплоемкости. В частности, для свободной (F ), внутренней (E ) энергии и теплоемкости (CV ) имеем (см. раздел 3.7)
|
zN |
|
|
|
|
|
|
|
|
|
F = −kT ln Z = −kT ln |
пост |
−kT ln zN |
|
−kT ln zN |
= |
(2.44а) |
||||
|
|
|||||||||
|
N ! |
|
колеб |
|
|
вр |
|
|||
|
|
|
|
|
|
|
|
|||
= Fпост +Fколеб +Fвр; |
|
|
|
|
|
|
|
|
|
|
E = kT 2 ∂ln Z = NkT 2 ∂ln z |
= E |
|
+E |
|
+E ; |
(2.44б) |
||||
∂T |
∂T |
|
пост |
|
|
колеб |
вр |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
пост |
|
|
колеб |
|
вр |
|
|
C |
|
∂E |
=C |
+C |
+C |
. |
(2.45) |
||||
= |
|
|
|
|
|||||||
V |
|
|
V |
|
V |
V |
|
|
|||
|
|
∂T V |
|
|
|
|
|
|
|
|
|
Таким образом, термодинамические |
потенциалы |
и параметры газа |
|||||||||
многоатомных молекул представляются суммой слагаемых, отвечающих одному из независимых видов движения.
2.10.2. Функция состояний и энергия колебаний . Двухатомную молекулу можно рассматривать как квантовый линейный
гармонический осциллятор с энергией εколеб |
= hν(n +1 2). Все его уровни |
||||||
энергии невырожденные, т.е. |
|
Ω(εколеб)= 1. |
Суммируя |
бесконечно |
|||
убывающую геометрическую прогрессию (2.43), находим |
|
||||||
|
hν n +1 2 |
|
|
|
|
− hν kT −1 |
|
∞ |
− (kT |
) |
= e |
− hν 2kT |
(2.46а) |
||
zколеб = ∑e |
|
|
|
1 −e |
. |
||
n=0 |
|
|
|
|
|
|
|
Колебательная функция состояний зависит от отношения hν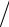 kT . Если
kT . Если
выразить |
hν |
в |
энергетических |
|
единицах |
hν = kT к |
через |
|
|
|
|
|
|
|
|
c |
|
характеристическую температуру колебательного движения, то |
|
|||||||
|
|
|
zколеб =e |
−Tcк 2T |
−e |
−Tcк T −1 |
|
(2.46б) |
|
|
|
1 |
. |
|
|||
|
|
|
|
|
|
|
|
|
Вычисления средней энергии колебаний двухатомной молекулы дают
95
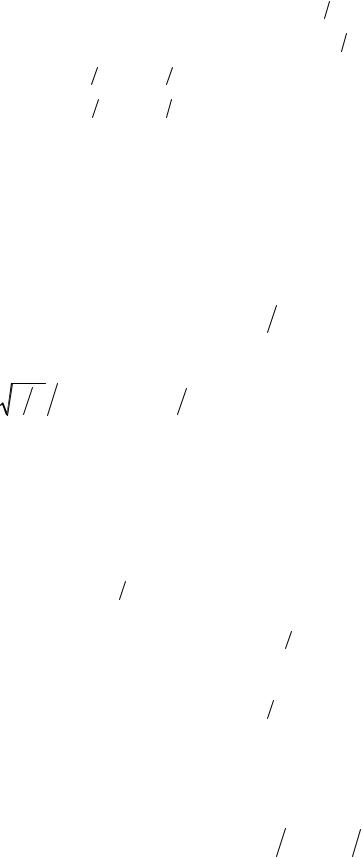
ε |
= kT |
2 |
|
∂ln z |
колеб |
= kT |
2 |
|
∂ |
|
ln |
e−Tcк 2T |
|
= |
|||||||
|
|
|
|
|
|
|
|
|
|
|
к |
|
|||||||||
колеб |
|
|
|
|
∂T |
|
|
|
|
∂T |
|
|
|
T |
|||||||
|
|
|
|
|
|
|
|
|
|
|
1 −e |
−Tc |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.47) |
|||
|
kTcк |
|
eTcк |
2T +e−Tcк 2T |
|
kTcк |
|
|
|
Tcк |
|
|
|||||||||
= |
|
= |
|
cth |
. |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
2 |
eTcк 2T −e−Tcк 2T |
|
|
|
2 |
|
|
|
2T |
|
|
|
||||||||
Отсюда находим внутреннюю энергию и теплоемкость всего газа, связанную с колебательным движением его N молекул (2.44), (2.45):
E |
|
|
= N ε |
= |
NkT |
к |
T |
к |
|
|
(2.48) |
|||||||
колеб |
|
|
c |
|
cth |
c |
|
|
|
; |
||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
колеб |
|
|
2 |
|
|
|
2T |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
колеб |
|
|
к 2 |
|
|
|
1 |
|
|
|
|
|
|
||||
|
|
Nk Tc |
|
|
|
|
|
|
|
|
|
|||||||
CV |
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
. |
(2.49) |
||
|
|
|
|
|
|
|
к |
|
|
|
||||||||
|
|
|
|
2 |
|
|
|
|
|
|||||||||
|
|
|
|
4 T |
|
sh |
(Tc 2T ) |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
Они оказываются сложными |
функциями |
температуры T и |
собственной |
|||||||||||||||
частоты (ν = χ µ 2π, |
µ = m1m2 |
(m1 +m2 )). |
Рассмотрим |
асимптотику |
||||||||||||||
этих функций при высоких (T >>Tcк ) и низких (T <<Tcк ) температурах. В
первом случае экспоненциальную функцию можно разложить в ряд и ограничиться первыми членами разложения
E |
колеб |
|
NkT; |
|
|
|
C колеб |
|
Nk. |
||||||||||
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|||
|
|
T |
к 2T |
>>1): |
|
|
|
|
|
|
|
|
|
||||||
При низких температурах (e c |
|
|
|
|
|
|
|
|
|
|
|||||||||
E |
|
|
|
|
|
NkT к |
|
+NkT кe |
−T |
к |
T |
; |
|||||||
колеб |
|
c |
|
|
|
c |
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
2 |
|
|
|
|
|
c |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
колеб |
|
|
|
к 2 |
|
к |
T |
|
|
|
||||||
|
|
|
|
|
Tc |
−Tc |
|
|
|
|
|||||||||
|
|
C |
|
|
|
Nk |
|
|
|
e |
|
|
|
|
. |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
(2.50)
(2.51)
(2.52)
Формулы (2.50) дают классические значения энергии и теплоемкости (раздел 2.9.1). При понижении температуры энергия колебаний стремится к
постоянному пределу |
lim E(T ) = E |
0 |
= NkT к |
2 = Nhν 2, получившему |
|
T →0°K |
c |
|
|
|
|
|
|
название нулевая энергия (энергия нулевых колебаний). Существование нулевой энергии – характерная особенность квантового движения, где
понятие полного покоя частицы лишено физического смысла. 96
При высоких температурах размер квантовых ступенек ∆ε = hν = kTcк
оказывается малым по сравнению с тепловой энергией, так что энергию осциллятора можно считать изменяющейся непрерывно, как у классического
|
|
|
|
|
|
|
|
|
|
|
|
|
|
осциллятора. При низких температурах |
||
|
ε |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
осциллятор находиться в нормальном |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
состоянии |
и теплового |
возбуждения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
недостаточно для перевода его в |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
верхние возбужденные состояния. Из |
||
|
ε |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
температурной зависимости энергии |
||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
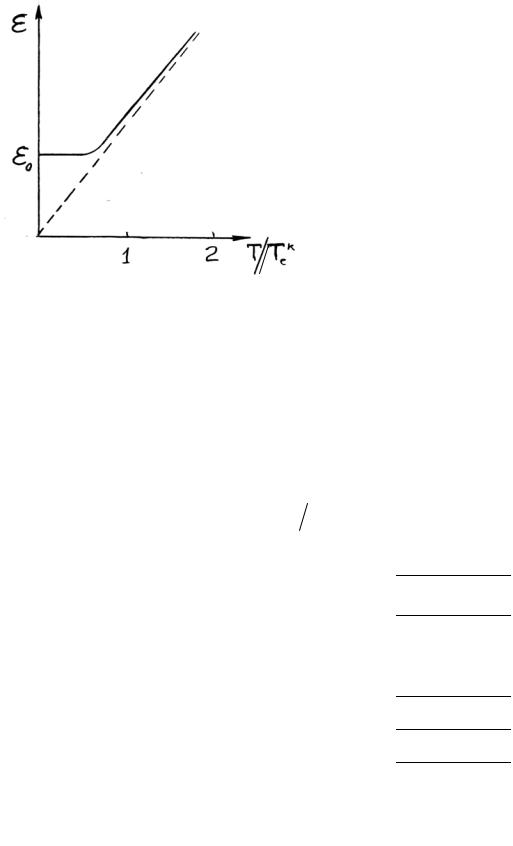
осциллятора (2.47) (рис. 2.9) видно, что |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в областиT T к происходит плавный |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
1 |
|
|
2 |
|
|
|
|
к |
||||
|
|
|
|
T Tc |
|
c |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
переход |
между |
предельными |
|||
|
|
|
|
Рис. 2.9 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
значениями |
Eколеб , определяемыми |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
формулами(2.50) и(2.51). |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
Теплоемкость также |
плавно |
убывает с падением температуры от ее |
|||||||||||
классического значения (2.50) до нуля. В квантовой модели исчезновение колебательной теплоемкости, «замораживание» колебаний происходит самым непосредственным и естественным образом. При низких температурах частота
ν оказывается по |
сравнению с |
kT h очень |
Таблица А |
|
||
|
|
|
||||
большой. Ей соответствует большая жесткость |
Молекула |
Tcк , 1000°К |
||||
связи обоих атомов. С понижением температуры |
|
|
||||
H2 |
6,0 |
|||||
рост относительной жесткости приводит к тому, |
|
|
||||
N2 |
3,34 |
|||||
чтоколебанияпостепеннопрекращаются. |
||||||
|
|
|||||
O2 |
2,32 |
|||||
В таблице |
А |
приведены значения |
||||
|
|
|||||
характеристических |
|
температур |
колебаний |
CO |
3,07 |
|
|
|
|
||||
различных молекул. Все они значительно выше |
HCl |
4,14 |
||||
|
|
|||||
|
|
|
|
|
|
|
комнатной температуры, которая соответствует |
HBr |
3,7 |
||||
|
|
|||||
|
|
|
|
|
||
предельному случаю |
T <<Tcк . |
Поэтому |
HJ |
3,2 |
||
|
|
|
|
|
|
|
97

колебательная теплоемкость большинства молекул при комнатной температуре весьма мала; колебательное движение заморожено.
2.10.3. Функция состояний и энергия вращений . Если пренебречь изменением момента инерции молекулы из-за колебаний, то ее можно рассматривать как твердый ротатор, вращающийся вокруг центра
тяжести, с моментом инерции I = µa2 и энергией,
ε |
= |
h2 |
j(j +1); j = 0,1,2,... |
(2.53) |
|
8π2I |
|||||
вр |
|
|
|
Каждое состояние с энергией εвр(j), отвечающее значению вращательного квантового числа j , оказывается (2j +1)–кратно вырожденным. Поэтому функция состояний вращательного движения имеет вид
|
|
∞ |
|
|
|
|
|
zвр = ∑(2j +1)e−Tcвj(j +1) |
T , |
(2.54) |
|
|
|
j =0 |
|
|
|
где T в = |
h2 |
– характеристическая температура вращательного движения. |
|||
8π2Ik |
|||||
c |
|
|
|
||
Их значения для некоторых двухатомных молекул приведены в таблице В. В
отличие от |
характеристической |
|
температуры |
|
Таблица В |
|
||||||||||||
|
|
T к |
|
|
|
|
|
|
|
|
||||||||
колебательного |
движения |
|
температура |
для |
|
Молекула |
T в , °К |
|||||||||||
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
c |
вращения чрезвычайно мала (Tcв <<Tcк ) и лежит |
|
|
|
|||||||||||||||
|
H2 |
85,4 |
||||||||||||||||
значительно ниже точки конденсации газа при |
|
|
|
|||||||||||||||
|
D2 |
43 |
||||||||||||||||
нормальном давлении. Исключения |
составляют |
|
|
|
||||||||||||||
|
N2 |
2,85 |
||||||||||||||||
молекулы водорода H2 |
и дейтрона D2 , |
у которых |
|
|||||||||||||||
|
|
|
||||||||||||||||
|
O2 |
2,07 |
||||||||||||||||
T в |
выше, |
чем |
температура |
|
конденсации |
|
||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|||||||||||||||
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15,1 |
соответствующего газа. Это обусловлено малостью |
|
HCl |
||||||||||||||||
|
|
|
||||||||||||||||
|
|
|
|
|
|
m |
|
a2 |
|
|
|
m a2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
их моментов инерции (IH |
|
= |
|
H |
|
|
и |
ID |
= |
D |
|
), |
где mH и mD |
– массы |
||||
|
|
|
|
|
|
|||||||||||||
|
|
2 |
|
2 |
|
|||||||||||||
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
протона и дейтрона, а a – расстояние между ними в молекуле.
98

Поэтому для всех молекул, кроме H2 и D2 можно считать, что расстояния между соседними уровнями энергии вращения малы по сравнению с тепловой энергией. Иначе говоря, для тяжелых молекул температура выше 30°К является высокой, Tcв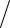 T <<1, и суммирование по отдельным уровням энергии (2.54) можно заменить интегрированием:
T <<1, и суммирование по отдельным уровням энергии (2.54) можно заменить интегрированием:
∞ |
− Tcвj(j +1) T |
|
∞ |
|
−Tcвj(j +1) T |
|
|
|
T |
|
8π2IkT |
|
||
|
|
e |
= |
= |
. (2.55). |
|||||||||
zвр = ∑(2j +1)e |
|
∫ |
|
d j(j +1) |
T |
в |
h |
2 |
||||||
j =0 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
0 |
|
|
|
|
|
c |
|
|
|
|
|
В следующем приближении функцию состояний можно вычислить по известной формуле суммирования Эйлера [см. А. Гельфонд, Исчисление конечных разностей, Гостехиздат.,1952, стр. 343]:
∞ |
∞ |
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
∑f (j) ∫ f (x)dx + |
f (0) − |
|
′ |
+ |
|
|
f |
′′′ |
||||||||||||
|
|
|
|
|
|
|
||||||||||||||
2 |
12 |
f (0) |
720 |
(0). |
||||||||||||||||
j =0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
′ |
= 2 |
|
в |
T , |
f |
′′′ |
|
|
|
|
|
|
в |
T , то |
|||||
Поскольку f (0) = 1 , f (0) |
−Tc |
(0) |
= −12Tc |
|
||||||||||||||||
|
|
|
8π2IkT |
|
|
1 |
|
|
|
|
|
h2 |
|
|
|
|
|
|
||
|
zвр |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|||||
|
|
|
+ |
3 |
|
|
|
|
|
|
. |
|
|
|||||||
|
|
|
|
h |
|
|
|
15 |
8π IkT |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Выражение в скобках представляет квантовую поправку к классическому значению zвр . Видно, что эта поправка мала при T >Tcв и быстро убывает с ростом T . Поэтому в области температур T > 20 К квантовые поправки к zвр
у всех молекул, кроме самых легких, играют весьма незначительную роль.
При низких температурах (T <<Tcв ) в сумме (2.54) следует оставить лишь первые, самые большие слагаемые:
(2.56)
Определим теперь термодинамические потенциалы, связанные с вращательным движением. Для внутренней и свободной энергий газа двухатомных молекул при высоких (T >>Tcв ) температурах находим
99

|
∂ |
|
∂ |
|
Eвр = NkT 2 |
∂T ln zвр |
NkT 2 |
∂T ln(T Tcв)= NkT; |
(2.57) |
Fвр = −NkT ln zвр ≈ NkT ln(Tcв T ).
T ).
Соответственно, вращательные теплоемкость и энтропия имеют классические значения
CVвр ∂Eвр 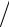 ∂T Nk; S вр = −∂Fвр ∂T Nk −NkT ln(Tcв T). (2.58)
∂T Nk; S вр = −∂Fвр ∂T Nk −NkT ln(Tcв T). (2.58)
В области низких температур (T <<Tcв ):
Eвр = NkT 2 ∂∂T ln(1 + 3e− 2Tcв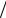 T ) 6NkTcвe− 2Tcв T ;
T ) 6NkTcвe− 2Tcв T ;
(2.59)
Fвр = −NkT ln(1 + 3e− 2Tcв T ) −3NkTe− 2Tcв T ;
T ;
CVвр = 12Nk (Tcв T )2 e− 2Tcв T ;
T ;
(2.60)
S вр = 3Nk (1 +2Tcв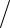 T )e− 2Tcв
T )e− 2Tcв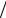 T .
T .
Для практических вычисления термодинамических величин нужно знать только одну молекулярную постоянную – момент инерции молекулы I . Значение ее для большинства двухатомных молекул известно из спектроскопических данных, в частности, из вращательных инфракрасных спектров.
Вращательная энергия, теплоемкость и энтропия при очень низких температурах экспоненциально убывают. Температурные зависимости теплоемкостей вращательного и колебательного движений имеют одинаковый характер: при высоких температурах они стремятся к классическому значению, а при низких стремятся к нулю в полном соответствии с требованием третьего начала термодинамики. Однако, понятие высокой и низкой температуры для вращения и колебания оказываются в высокой степени различными – для колебаний комнатная температура, как правило, должна считаться низкой, для вращения – высокой.
100
При высоких температурах (T >Tcк ) двухатомная молекула совершает все виды движения, их энергия определяет суммарную теплоемкость газа. В
процессе понижения температуры вблизи характеристических значений Tcк и
Tcв энергия и теплоемкость сначала колебательного, а затем вращательного движения стремится к нулю, происходит вымораживание таких движений.
При очень низких температурах (T <Tcв ) двухатомная молекула ведет себя как одноатомная с тремя ступенями свободы поступательного движения. Здесь теплоемкости газов из двухатомных и одноатомных молекул совпадают. Вымораживание колебательного и вращательного видов движения и объясняет ступенчатый характер температурной зависимости суммарной теплоемкости (рис. 2.8).
Алгоритмы анализа многоатомных и двухатомных молекул подобны, Функция состояний в обоих случаях представляется произведением трех сомножителей, ответственных за поступательное, вращательное и колебательное движения. Такой подход оправдан, когда можно пренебречь влиянием колебаний на вращение молекулы. Функция состояния поступательного движения ничем не отличается от вычисляемой ранее. Определенные трудности возникают при вычислении функции состояний внутреннего движения у многоатомных молекул. Это обусловлено, в частности, их сложной структурой, наличием в общем случае трех моментов инерции, увеличением числа колебательных степеней свободы.
2.11. Распределения в квантовых системах
2.11.1. Метод ячеек в фазовом пространстве . Классические представления, как отмечалось ранее, оказались недостаточными для изучения движения атомных систем и должны быть заменены представлениями квантовой теории. Для статистической физики
основное значение имеют два положения квантовой механики: 101
