- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 15. Пространственная упорядоченность клеток: роль клеточной поверхности
- •Введение
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дифференциальное сродство клеток Стационарные культуры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Ротационные культуры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменение специфического сродства клеток и их миграция у зародышей морского ежа
- •Способы клеточной миграции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Хемотаксис
- •Гаптотаксис
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гальванотаксис
- •Контактное ориентирование
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контактное ингибирование движения
- •Термодинамическая модель клеточных взаимодействий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Данные в пользу термодинамической модели полученные in vivo
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменения в строении клеточной поверхности Строение клеточной мембраны
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменения клеточной мембраны в процессе развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: От белка к гену
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулы клеточной адгезии Идентификация молекул клеточной адгезии
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Кадгерины
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Иммуноглобулиновое сверхсемейство мка
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Распределение молекул клеточной адгезии
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Клеточная адгезия, обусловленная сахаридами
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Морфогенез путем взаимодействия между клеткой и субстратом Внеклеточный матрикс
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Внеклеточные гликопротеины
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Интегрины – рецепторы клеток к фибронектину и ламинину
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дифференциальная адгезия как результат действия множественных адгезионных систем
- •Значение внеклеточного матрикса для дифференцировки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контактные модификации и морфогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Введение
- •Инструктивные и разрешающие взаимодействия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компетенция
- •Каскады межклеточных взаимодействий. Индукция хрусталика
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компетенция и предрасположенность эктодермы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Окончательная детерминация хрусталика
- •Образование роговицы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Эпителио-мезенхимные взаимодействия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Региональная специфичность индукции
- •Генетическая специфичность индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Развитие и макроэволюция
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование паренхиматозных органов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм органогенеза почки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Координированная дифференцировка и морфогенез поджелудочной железы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Природа ближнего взаимодействия при эпителио-мезенхимной индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм ветвления при формировании паренхиматозных органов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция плазматических клеток Макрофаги и хелперные т-клетки (т-хелперы)
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Неспецифическая адгезия лимфоцитов
- •Дополнительные сведения и гипотезы: Поперечные связи и индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция на уровне одной клетки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция конечности у куриного зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Введение
- •Градиентная модель позиционной информации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель французского флага
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Градиенты у гидры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регенерация конечности: модель полярных координат позиционной информации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регенерация конечностей у саламандры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель полярных координат
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование пространственной организации в ходе развития конечностей: спецификация осей
- •Поле конечности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Поляризация вдоль оси конечности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Ретиноевая кислота и формирование пространственной организации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Спецификация скелета конечности реакционно-диффузионными процессами
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование пространственной организации в нервной системе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм направленного роста аксонов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизмы симпатической специфичности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие поведения
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Морфогенез путем специфической гибели клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Краткий обзор развития дрозофилы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Возникновение переднезадней полярности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гены с материнским эффектом Эмбриологические данные, касающиеся регуляции становления полярности цитоплазмой яйца
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Передний организующий центр: градиент белкаbicoid
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Задний организующий центр: активация и транспорт продукта генаnanos
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Группа генов, контролирующих формирование терминальных структур
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компартментализация в процессе развития насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Мутации, нарушающие число сегментов Три типа генов сегментации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Парасегменты и пространственная регуляция экспрессии генов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Последовательность экспрессии генов сегментации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Установление последовательности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Установление специфичности сегмента: гомеозисные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регуляция регуляторов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулярная биология генов, контролирующих пространственную организацию зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гомеобокс
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование специфического фенотипа клеток: позиционная информация
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Метаморфоз. Гормональная реактивация развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Метаморфоз у амфибий Феномен метаморфоза у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гормональный контроль метаморфоза у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулярный механизм ответа на тиреоидные гормоны при метаморфозе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Гетерохрония
- •Неотения
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прямое развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Метаморфоз у насекомых Выворачивание и дифференцировка имагинальных дисков
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Перестройка нервной системы
- •Гормональный контроль метаморфоза у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Конец детства; сигнал к началу метаморфоза
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Вещества, вызывающие преждевременное развитие
- •Множественные гормональные взаимодействия при развитии молочной железы
- •Эмбриональная стадия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Пубертатная стадия
- •Беременность
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Половое созревание как вариация на тему метаморфоза
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Математическое описание роста Проблемы роста: физические пределы роста
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изометрический рост. Закон линейного роста Брукса
- •Логарифмическая спираль
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Аллометрический рост
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Эволюция и аллометрия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Физиология роста органов Гормоны роста и митоз
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Факторы, ингибирующие рост
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогены и клеточный рост Вирусные онкогены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогены и клеточный рост
- •Варианты фактора роста
- •Варианты рецепторов фактора роста
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Как клеточные онкогены вступают на неверный путь
- •Онкогенез путем мутаций
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем амплификации генов
- •Онкогенез путем инсерции промотора
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем перестройки хромосом
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем утраты генов подавления опухолевого роста (генов супрессоров)
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Старение
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Механизмы старения
- •Литература
- •Хромосомная детерминация пола у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие гонад
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контроль детерминации пола у млекопитающих: гены y хромосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контроль детерминации пола у млекопитающих: аутосомные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель первичной детерминации пола у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Вторичная детерминация пола Гормональная регуляция полового фенотипа
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Центральная нервная система
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Развитие полового поведения
- •Хромосомная детерминация пола у Drosophila
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Кульминационная роль гена Sex lethal в детерминации пола
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Геныtransformer
- •Doublesex– ген-переключатель детерминации пола
- •Гены-мишени каскада детерминации пола
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гермафродитизм
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Почему существуют самцы?
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Детерминация пола, зависящая от условий обитания Зависящая от температуры детерминация пола у рептилий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Детерминация пола, зависящая от местоположении животного уBonellia vividisиCrepidula fornicata
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Образование половых клеток Миграция половых клеток у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Миграция половых клеток у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Миграция первичных половых клеток у птиц и рептилий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Важные решения: митоз –мейоз и спермий – яйцо
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Сперматогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Спермиогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Экспрессия генов при сперматогенезе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Оогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Созревание ооцитов у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Блокирование мейоза и выход из блока
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Транскрипция генов в ооцитах
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Мероистический оогенез у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Оогенез у человека
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Поддержание блока мейоза в ооцитах млекопитающих и выход из блока
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Синтез, произведенный Чарлзом Дарвином
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Э. Б. Вильсон и ф .Р. Лилли
- •Эволюция раннего развития: е pluribus unum 1 Возникновение зародышей
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование типов. Модификация путей развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Морфогенетические механизмы эволюционных изменений Изоляция
- •Гомеозис
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие и эволюция в пределах сложившихся планов строения Ограничения, налагаемые развитием
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индуктивные взаимодействия и генерация новых структур
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Эрнст Геккель и биогенетический закон
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прогрессивное развитие корреляции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Данные, свидетельствующие о прогрессивном развитии корреляции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гетерохрония и аллометрия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Передача компетенции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Задержка имплантации
- •Дополнительные сведения и гипотезы: Передача компетенции путем переноса рецепторов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Новый эволюционный синтез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Часть I
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Часть II
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Молекулярная биология и эмбриология
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Часть III
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 16. Ближние тканевые взаимодействия. Вторичная индукция. Перевод
- •Глава 17. Формирование пространственной организации. Перевод д.Г. Полтевой 88
- •Глава 18. Генетика формирования пространственной организации у дрозофилы. Перевод а.И. Иванова 130
- •Глава 19. Клеточные взаимодействия на расстоянии. Гормоны как медиаторы развития. Перевод д. Г. Полтевой 161
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 20. Рост и онкогенез. Перевод д. Г. Полтевой................................................................ ....... 192
- •Глава 21. Детерминация пола. Перевод д. Г. Полтевой................................................................ ...... 233
- •Глава 22. Сага о зародышевом пути. Перевод д. Г. Полтевой........................................... 259
- •Глава 23. Эмбриологические механизмы эволюционных изменений. Перевод н.О. Фоминой............. 294
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 16. Ближние тканевые взаимодействия. Вторичная индукция 51
- •Глава 17. Формирование пространственной организации 88
- •Глава 18. Генетика формирования пространственной организации у дрозофилы 130
- •Глава 19. Клеточные взаимодействия на расстоянии. Гормоны как медиаторы развития 161
- •Глава 20. Рост и онкогенез 193
- •Глава 21. Детерминация пола 234
- •Глава 22. Сага о зародышевом пути 260
- •Глава 23. Эмбриологические механизмы эволюционных изменений 295
- •Часть I 326
- •Часть II 327
- •Часть III 329
Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
8 ГЛАВА 15
|
|
|
Рис. 15.3. Реконструкция кожи из суспензии клеток кожи 15-дневного зародыша мыши А. Срез кожи зародыша. На срезе видны эпидермис, дерма и первичный волосяной фолликул. Б. Суспензия единичных клеток кожи, полученная из дермы и эпидермиса. В. Агрегаты спустя 24 ч. Г. Срез через агрегат, на котором видна миграция эпидермальных клеток на периферию. Д. Дальнейшее развитие агрегата (72 ч), показывающее восстановленный эпидермис и дерму с волосяными фолликулами и кератинизированным слоем. (Из Monroy, Moscona, 1979; фотографии с любезного разрешения A. Moscona.) |
популяции с клетками другой. Это явление убедительно подтвердил Тринкаус (Trinkaus, 1963), показавший четкую корреляцию между изменением способности клеток прилипать друг к другу (т.е. их адгезией) и изменениями в их поведении. У костистых рыб в начале гаструляции пограничные клетки дискоидальных зародышей уплощаются и плотно прикрепляются к цитоплазматической поверхности яйца, сокращение которой обусловливает перемещение бластодермы к вегетативному полюсу яйца. Тринкаус обнаружил, что клетки, изолированные со стадии бластулы, не прилипают к искусственному субстрату, тогда как те же клетки гаструлирующего зародыша прикрепляются к поверхности. Более того, если клетки бластулы культивировать в течение времени, необходимого для начала гаструляции. то они начинают уплощаться и прилипают к искусственному субстрату, т.е. ведут себя так, как если бы они были в составе интактного зародыша.
Ротационные культуры
Агрегаты клеток зародышей птиц и млекопитающих более поздних стадий развития впервые получил Москона, воспользовавшись двумя методическими приемами. Во-первых, для диссоциации клеток он применил трипсин (Moscona, 1952). Расщепляя белки клеточной поверхности и белки межклеточного матрикса, этот фермент разрушает многочисленные связи, соединяющие клетки друг с другом. Во-вторых, он использовал методику ротационной агрегации (Moscona, 1961). Эта методика не позволяла клеткам оседать на дно культурального сосуда (к которому они имеют малое сродство или не имеют его вовсе), поскольку содержимое сосуда с культивируемыми в нем клетками осторожно перемешивали. В таких условиях клетки агрегировали, если силы адгезии, удерживающие их вместе, были выше, чем гидростатические силы, стремящиеся их разъединить. В первоначальном агрегате клетки располагались случайным образом, однако затем в результате миграции происходила их рассортировка в соответствии с принадлежностью к тому или иному клеточному типу. Иными словами, строение агрегатов уподоблялось строе-
Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
ПРОСТРАНСТВЕННАЯ УПОРЯДОЧЕННОСТЬ КЛЕТОК 9
нию исходной ткани. На рис. 15.3 представлена «реконструкция» ткани кожи 15-дневного зародыша мыши. Клетки кожи разделяли протеолитическими ферментами и помещали в ротационную культуру для образования агрегатов. В образовавшихся агрегатах эпидермальные клетки мигрировали к периферии, а клетки дермы – к центру. Через 72 ч происходила реконституция эпидермиса, формировался кератиновый слой, в области дермы были видны волосяные фолликулы. Таким образом, процедура агрегации позволяет индивидуальным клеткам восстановить ткань. В аналогичных экспериментах одиночные клетки в суспензии из зародышевой почки реагрегировали с образованием канальцев, а клетки сетчатки, объединяясь, формировали нейральную сетчатку. Такое восстановление сложных тканей из единичных клеток называют гистотипической агрегацией. Следовательно, клетки зародышевых органов сохраняют морфогенетическую информацию, что дает им возможность вновь формировать ткане- и органоспецифические структуры.
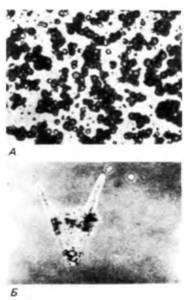
У некоторых видов из суспензии единичных клеток может вновь возникнуть целый организм. Диссоциированные бластомеры морского ежа могут реагрегировать с образованием бластулоподобных структур, которые затем способны развиваться в нормальных личинок - плутеусов (рис. 15.4) (Giudice, 1962; Spiegel, Spiegel, 1975). Для этого необходимо
|
|
Рис. 15.4. Агрегация бластомеров диссоциированного 16-клеточного зародыша морского ежа Arbacia punctulata. А. Диссоциированные клетки. Б. Реконструированная личинка плутеус через 25 ч после начала агрегации. (Из Spiegel, Spiegel, 1975; фотографии с любезного разрешения авторов.) |
присутствие всех трех типов клеток (микромеров, макромеров и мезомеров), что свидетельствует о невозможности возврата клеток к дедифференцированному состоянию и последующей редифференцировке в соответствии с их новым положением (Spiegel, Spiegel, 1975).
Если основной парадигмой генетики развития является дифференциальная экспрессия генов, то в случае морфогенеза парадигма основана на дифференциальном сродстве клеток.