- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 15. Пространственная упорядоченность клеток: роль клеточной поверхности
- •Введение
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дифференциальное сродство клеток Стационарные культуры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Ротационные культуры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменение специфического сродства клеток и их миграция у зародышей морского ежа
- •Способы клеточной миграции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Хемотаксис
- •Гаптотаксис
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гальванотаксис
- •Контактное ориентирование
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контактное ингибирование движения
- •Термодинамическая модель клеточных взаимодействий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Данные в пользу термодинамической модели полученные in vivo
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменения в строении клеточной поверхности Строение клеточной мембраны
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменения клеточной мембраны в процессе развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: От белка к гену
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулы клеточной адгезии Идентификация молекул клеточной адгезии
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Кадгерины
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Иммуноглобулиновое сверхсемейство мка
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Распределение молекул клеточной адгезии
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Клеточная адгезия, обусловленная сахаридами
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Морфогенез путем взаимодействия между клеткой и субстратом Внеклеточный матрикс
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Внеклеточные гликопротеины
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Интегрины – рецепторы клеток к фибронектину и ламинину
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дифференциальная адгезия как результат действия множественных адгезионных систем
- •Значение внеклеточного матрикса для дифференцировки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контактные модификации и морфогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Введение
- •Инструктивные и разрешающие взаимодействия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компетенция
- •Каскады межклеточных взаимодействий. Индукция хрусталика
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компетенция и предрасположенность эктодермы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Окончательная детерминация хрусталика
- •Образование роговицы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Эпителио-мезенхимные взаимодействия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Региональная специфичность индукции
- •Генетическая специфичность индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Развитие и макроэволюция
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование паренхиматозных органов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм органогенеза почки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Координированная дифференцировка и морфогенез поджелудочной железы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Природа ближнего взаимодействия при эпителио-мезенхимной индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм ветвления при формировании паренхиматозных органов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция плазматических клеток Макрофаги и хелперные т-клетки (т-хелперы)
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Неспецифическая адгезия лимфоцитов
- •Дополнительные сведения и гипотезы: Поперечные связи и индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция на уровне одной клетки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция конечности у куриного зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Введение
- •Градиентная модель позиционной информации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель французского флага
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Градиенты у гидры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регенерация конечности: модель полярных координат позиционной информации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регенерация конечностей у саламандры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель полярных координат
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование пространственной организации в ходе развития конечностей: спецификация осей
- •Поле конечности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Поляризация вдоль оси конечности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Ретиноевая кислота и формирование пространственной организации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Спецификация скелета конечности реакционно-диффузионными процессами
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование пространственной организации в нервной системе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм направленного роста аксонов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизмы симпатической специфичности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие поведения
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Морфогенез путем специфической гибели клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Краткий обзор развития дрозофилы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Возникновение переднезадней полярности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гены с материнским эффектом Эмбриологические данные, касающиеся регуляции становления полярности цитоплазмой яйца
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Передний организующий центр: градиент белкаbicoid
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Задний организующий центр: активация и транспорт продукта генаnanos
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Группа генов, контролирующих формирование терминальных структур
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компартментализация в процессе развития насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Мутации, нарушающие число сегментов Три типа генов сегментации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Парасегменты и пространственная регуляция экспрессии генов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Последовательность экспрессии генов сегментации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Установление последовательности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Установление специфичности сегмента: гомеозисные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регуляция регуляторов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулярная биология генов, контролирующих пространственную организацию зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гомеобокс
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование специфического фенотипа клеток: позиционная информация
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Метаморфоз. Гормональная реактивация развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Метаморфоз у амфибий Феномен метаморфоза у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гормональный контроль метаморфоза у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулярный механизм ответа на тиреоидные гормоны при метаморфозе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Гетерохрония
- •Неотения
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прямое развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Метаморфоз у насекомых Выворачивание и дифференцировка имагинальных дисков
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Перестройка нервной системы
- •Гормональный контроль метаморфоза у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Конец детства; сигнал к началу метаморфоза
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Вещества, вызывающие преждевременное развитие
- •Множественные гормональные взаимодействия при развитии молочной железы
- •Эмбриональная стадия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Пубертатная стадия
- •Беременность
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Половое созревание как вариация на тему метаморфоза
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Математическое описание роста Проблемы роста: физические пределы роста
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изометрический рост. Закон линейного роста Брукса
- •Логарифмическая спираль
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Аллометрический рост
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Эволюция и аллометрия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Физиология роста органов Гормоны роста и митоз
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Факторы, ингибирующие рост
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогены и клеточный рост Вирусные онкогены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогены и клеточный рост
- •Варианты фактора роста
- •Варианты рецепторов фактора роста
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Как клеточные онкогены вступают на неверный путь
- •Онкогенез путем мутаций
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем амплификации генов
- •Онкогенез путем инсерции промотора
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем перестройки хромосом
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем утраты генов подавления опухолевого роста (генов супрессоров)
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Старение
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Механизмы старения
- •Литература
- •Хромосомная детерминация пола у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие гонад
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контроль детерминации пола у млекопитающих: гены y хромосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контроль детерминации пола у млекопитающих: аутосомные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель первичной детерминации пола у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Вторичная детерминация пола Гормональная регуляция полового фенотипа
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Центральная нервная система
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Развитие полового поведения
- •Хромосомная детерминация пола у Drosophila
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Кульминационная роль гена Sex lethal в детерминации пола
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Геныtransformer
- •Doublesex– ген-переключатель детерминации пола
- •Гены-мишени каскада детерминации пола
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гермафродитизм
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Почему существуют самцы?
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Детерминация пола, зависящая от условий обитания Зависящая от температуры детерминация пола у рептилий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Детерминация пола, зависящая от местоположении животного уBonellia vividisиCrepidula fornicata
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Образование половых клеток Миграция половых клеток у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Миграция половых клеток у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Миграция первичных половых клеток у птиц и рептилий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Важные решения: митоз –мейоз и спермий – яйцо
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Сперматогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Спермиогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Экспрессия генов при сперматогенезе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Оогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Созревание ооцитов у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Блокирование мейоза и выход из блока
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Транскрипция генов в ооцитах
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Мероистический оогенез у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Оогенез у человека
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Поддержание блока мейоза в ооцитах млекопитающих и выход из блока
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Синтез, произведенный Чарлзом Дарвином
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Э. Б. Вильсон и ф .Р. Лилли
- •Эволюция раннего развития: е pluribus unum 1 Возникновение зародышей
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование типов. Модификация путей развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Морфогенетические механизмы эволюционных изменений Изоляция
- •Гомеозис
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие и эволюция в пределах сложившихся планов строения Ограничения, налагаемые развитием
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индуктивные взаимодействия и генерация новых структур
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Эрнст Геккель и биогенетический закон
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прогрессивное развитие корреляции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Данные, свидетельствующие о прогрессивном развитии корреляции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гетерохрония и аллометрия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Передача компетенции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Задержка имплантации
- •Дополнительные сведения и гипотезы: Передача компетенции путем переноса рецепторов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Новый эволюционный синтез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Часть I
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Часть II
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Молекулярная биология и эмбриология
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Часть III
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 16. Ближние тканевые взаимодействия. Вторичная индукция. Перевод
- •Глава 17. Формирование пространственной организации. Перевод д.Г. Полтевой 88
- •Глава 18. Генетика формирования пространственной организации у дрозофилы. Перевод а.И. Иванова 130
- •Глава 19. Клеточные взаимодействия на расстоянии. Гормоны как медиаторы развития. Перевод д. Г. Полтевой 161
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 20. Рост и онкогенез. Перевод д. Г. Полтевой................................................................ ....... 192
- •Глава 21. Детерминация пола. Перевод д. Г. Полтевой................................................................ ...... 233
- •Глава 22. Сага о зародышевом пути. Перевод д. Г. Полтевой........................................... 259
- •Глава 23. Эмбриологические механизмы эволюционных изменений. Перевод н.О. Фоминой............. 294
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 16. Ближние тканевые взаимодействия. Вторичная индукция 51
- •Глава 17. Формирование пространственной организации 88
- •Глава 18. Генетика формирования пространственной организации у дрозофилы 130
- •Глава 19. Клеточные взаимодействия на расстоянии. Гормоны как медиаторы развития 161
- •Глава 20. Рост и онкогенез 193
- •Глава 21. Детерминация пола 234
- •Глава 22. Сага о зародышевом пути 260
- •Глава 23. Эмбриологические механизмы эволюционных изменений 295
- •Часть I 326
- •Часть II 327
- •Часть III 329
Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
РОСТ И ОНКОГЕНЕЗ 219
Как клеточные онкогены вступают на неверный путь
Формирование большей части человеческих опухолей обусловлено все же не вирусами. Существуют другие механизмы, посредством которых протоонкогены приобретают способность трансформировать клетку. Эти механизмы включают мутации, амплификацию генов и перестройку хромосом.
Онкогенез путем мутаций
Еще в начале шестидесятых годов было известно, что мутагены (агенты, вызывающие мутации) в то же время служат канцерогенами (агентами, вызывающими образование злокачественных опухолей). Брюс Эймс (Ames, 1979) показал, что митогенная способность данного вещества прямо пропорциональна его способности вызывать опухоли. Каким-то образом молекулы, повреждающие ДНК (судя по их способности индуцировать мутации у бактерий), приводят к формированию опухолей у мышей.
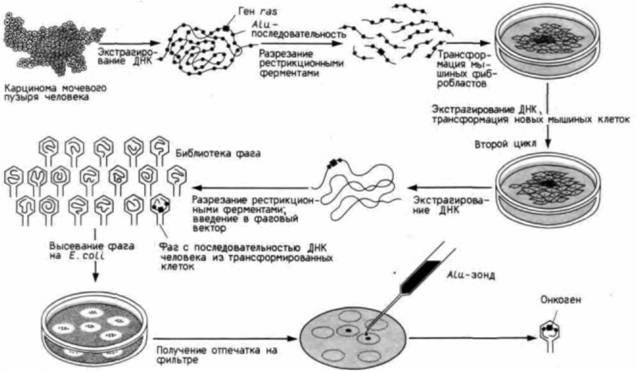
В 1982 г. Ших и Вейнберг (Shih, Weinberg, 1982) трансфицировали клетки NIH3T3, введя в них ДНК из опухолевых клеток мочевого пузыря человека (рис. 20.33). Некоторые из мышиных фибробластов захватывают человеческую ДНК, в составе которой может оказаться человеческий ген, трансформировавший клетки мочевого пузыря. Клетки N1H3T3, содержащие этот ген, начинали быстро расти и формировать очаги трансформированных клеток, которые затем были изолированы. ДНК этих клеток была выделена, фракционирована и использована для трансфекции другой группы клеток NIH3T3. Снова некоторые из клеток получили человеческий
|
|
|
Рис. 20.33. Выделение мутантного гена ras из карциномы мочевого пузыря человека. Человеческая ДНК характеризуется наличием коротких повторяющихся сегментов ДНК – Alu-последовательностей, располагающихся по всему геному, ДНК из клеток карциномы мочевого пузыря человека экстрагировали, разрезали рестрикционными ферментами и вносили в культуру мышиных фибробластов. Мышиные клетки, включившие онкоген, становились злокачественными и образовывали скопления – клеточные островки. ДНК из этих островков также экстрагировали, расщепляли и вносили в другую чашку с мышиными фибробластами. Когда появились островки, ДНК из их клеток вновь разрезали рестрикционными ферментами и включали в фаговые векторы. Фаги размножались в культивируемых клетках E. coli. Когда бактериальные клетки разрушились, ДНК помещали на нитроцеллюлозный фильтр и гибридизовали с радиоактивной Alu-последовательностью ДНК. Клоны, содержащие Alu-последовательность. выявляли с помощью радиоавтография. Эта последовательность указывает на человеческое (а не мышиное) происхождение содержащей ее ДНК. Поскольку при этом велась селекция на злокачественность, можно полагать, что эти клоны сдержат и онкоген, ответственный за злокачественную трансформацию клеток. Затем было произведено секвенирование человеческой ДНК. |
Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
220 ГЛАВА 20
ген, а вместе с ним и трансформированный фенотип. ДНК этих клеток была клонирована, и клоны, содержащие человеческую ДНК, были выявлены путем гибридизации ДНК. Таким образом был изолирован человеческий ген, обусловливающий способность к злокачественному росту. Оказалось, что этот ген является человеческим гомологом онкогена ras вируса крысиной саркомы Гарвея и Кирстена. Более того, он отличался от нормального человеческого гена только по одному нуклеотиду (Tabin et al., 1982; Capon et al., 1983). Кодон двенадцатой аминокислоты вместо ГГГ (глицинового) становился ГТГ (валиновым). Результаты экспериментов, в которых использовались другие линии опухолевых клеток человека, показали, что замены аминокислот в положениях 12, 13, 59, 61 или 63 белка, состоящего из 189 аминокислот, могут активировать его трансформирующую способность (Der et al., 1986; Levinson et al., 1986). В сходных экспериментах (Zarbi et al., 1985) крысам с пищей вводили такие хорошо известные мутагены, как нитрозометилмочевина (которая вызывает точковые мутации с заменой гуанина на аденин). Вызванные ими опухоли изолировали, а затем из их клеток выделяли ДНК. В случае опухоли молочной железы, индуцированной нитрозометилмочевиной, в двенадцатом кодоне гена c-ras в результате мутации происходила замена Г на А. Было обнаружено, что трансформирующая способность других протоонкогенов также активируется мутациями в кодирующем белок участке этих генов 1.
Мутации, делающие белок ras онкогенным, участвуют в ингибировании ГТФазной активности. В норме белок ras связывает ГТФ, катализируя его превращение в ГДФ, который остается с ним связанным. Эта реакция в значительной степени стимулируется образованием комплекса белка ras с белком, активирующим ГТФазу (БАГ). Этот белок (молекулярная масса его составляет 120 000 дальтон) повышает свою гидролизную активность более чем в 100 раз (Trahey, McCormick, 1987; Gibbs et al., 1988). Таким образом, в течение большей части времени с белком ras оказывается связанным не ГТФ, а ГДФ. ГДФ-связанная форма белка ras неактивна, а его ГТФ-связанная форма активирует другие белки. Все мутации гена ras, делающие его онкогенным, ингибируют ГТФазную активность БАГ. В этом случае БАГ сохраняет связь с белком ras, который благодаря своему ГТФ продолжает активно переносить митогенный сигнал к ядру (рис. 20.30; Caks et al., 1988; McCormick, 1989).