- •Содержание
- •Введение
- •Обеспечение качества продовольственного сырья и пищевых продуктов
- •1.1. Качество продовольственных товаров и система анализа опасностей по критическим контрольным точкам
- •1.2 Потребительские свойства продовольственных товаров
- •1.2.1. Химический состав пищевых продуктов
- •1.3. Безопасность пищевых продуктов
- •1.3.1 Классификация видов опасностей по степени риска
- •1.4. Потребительная стоимость продовольственных товаров
- •1.5. Физические свойства пищевых продуктов
- •1.6. Качество продовольственных товаров
- •1.7. Хранение продовольственных товаров
- •1.8. Консервирование пищевых продуктов
- •1.9. Потери продовольственных товаров
- •1.10. Классификация продовольственных товаров
- •1.11. Пищевые добавки как посторонний компонент пищевых продуктов
- •1.12. Безопасность трансгенных пищевых продуктов
- •Получение целевых генов
- •1.13. Фальсификация пищевых продуктов
- •1.14. Повышение иммунитета и детоксикация организма
- •Модуль 2 безопасность продуктов питания
- •Классификация загрязняющих веществ пищевых продуктов. В литературе встречаются различные виды классификаций загрязняющих веществ пищевых продуктов. Рассмотрим некоторые из них.
- •2.1. Биологические ксенобиотики
- •1. Санитарно-показательные:
- •2.1.1. Санитарно-показательные микроорганизмы
- •2.1.2. Условно-патогенные микроорганизмы
- •2.1.3. Патогенные микроорганизмы
- •2.1.4. Микотоксины Микотоксины (от греч. Mukes – гриб и toxicon – яд) – токсичные продукты жизнедеятельности микроскопических плесневых грибов, обладающие выраженными токсическими свойствами.
- •2.2. Химические ксеннобиотики
- •2.2.1. Меры токсичности веществ
- •2.2.2. Токсичные элементы
- •2.2.3. Санитарно-эпидемиологический контроль за содержанием токсичных элементов в продуктах питания
- •2.3. Радионуклиды
- •2.3.1. Основные представления о радиоактивности и ионизирующих излучениях
- •2.3.2. Биологическое действие ионизирующих излучений на организм человека
- •2.3.3. Естественные источники радиации
- •2.3.4. Техногенные источники радиации
- •2.3.5. Пути поступления радиоактивных веществ в организм человека.
- •2.3.6. Технологические способы снижения содержания радионуклидов в пищевой продукции
- •2.4. Пестициды
- •2.4.1. Классификация и токсиколого-гигиеническая характеристика пестицидов
- •2.4.2. Пути контаминации пищевых продуктов пестицидными препаратами
- •2.4.3. Основные группы пестицидов
- •§ 2.7. Минеральные вещества
- •2.7.1. Макроэлементы
- •2.7.2. Микроэлементы
§ 2.7. Минеральные вещества
Минеральные вещества в большинстве случаев составляют 0,7–1,5% (в среднем 1%) съедобной части пищевых продуктов. Исключение составляют те продукты, в которые добавляют пищевую соль (чаще 1,5–3%). Содержание минеральных веществ в пище (как макро-, так и микроэлементов) небольшое, но их биологическая активность в организме весьма высока. Минеральные вещества не обладают энергетической ценностью, однако без них жизнь человека невозможна.
Многие элементы в виде минеральных солей, комплексных соединений и органических веществ входят в состав живой материи и являются незаменимыми нутриентами, которые должны ежедневно потребляться с пищей. Содержание минеральных веществ в основных продуктах питания приведено в таблице 2.4.
Таблица 2.4. – Минеральный состав основных продуктов питания
(по данным И.М.Скурихина, М.Н.Волгарева «Химический состав пищевых продуктов», 1987)
|
Пищевые продукты |
Макроэлементы, мг/100 г |
Микроэлементы, мкг/100 г | ||||||||||
|
K |
Ca |
Mg |
Na |
S |
P |
Cl |
Fe |
I |
Cu |
F |
Zn | |
|
Хлеб ржаной |
245 |
35 |
47 |
610 |
52 |
158 |
980 |
3900 |
5,6 |
220 |
35 |
1210 |
|
Хлеб пшеничный |
129 |
23 |
33 |
506 |
59 |
84 |
837 |
1860 |
– |
134 |
– |
735 |
|
Молоко коровье |
146 |
120 |
14 |
50 |
29 |
90 |
110 |
67 |
9 |
12 |
20 |
400 |
|
Творог жирный |
112 |
150 |
23 |
41 |
– |
216 |
– |
461 |
– |
74 |
– |
394 |
|
Сыр российский |
116 |
1000 |
50 |
820 |
– |
540 |
– |
1100 |
– |
50 |
– |
3500 |
|
Мясо: свинина говядина |
316 |
8 |
27 |
64,8 |
220 |
170 |
48 |
1940 |
6,6 |
96 |
69 |
2070 |
|
355 |
10,2 |
22 |
73 |
230 |
188 |
59 |
2900 |
7,2 |
182 |
63 |
3240 | |
|
Рыба: речной карп морская треска |
265 |
35 |
25 |
55 |
180 |
210 |
55 |
800 |
5 |
130 |
25 |
2080 |
|
340 |
25 |
30 |
100 |
200 |
210 |
165 |
650 |
135 |
150 |
700 |
1020 | |
|
Овощи: капуста белокач. картофель морковь |
185 |
48 |
16 |
13 |
37 |
31 |
37 |
600 |
3 |
75 |
10 |
400 |
|
568 |
10 |
23 |
28 |
32 |
58 |
58 |
900 |
5 |
140 |
30 |
360 | |
|
200 |
51 |
38 |
21 |
6 |
55 |
53 |
700 |
5 |
80 |
55 |
400 | |
|
Фрукты: слива яблоко |
214 |
20 |
9 |
18 |
6 |
20 |
1 |
500 |
4 |
87 |
2 |
100 |
|
278 |
16 |
9 |
26 |
5 |
11 |
2 |
2200 |
2 |
110 |
8 |
150 | |
Ежедневное поступление химических элементов с пищей должно находиться на определенном уровне и столько же химических элементов должно ежесуточно выводиться из организма, поскольку их содержание в нем находится в относительном постоянстве.
Минеральные вещества выполняют пластическую функцию в процессах жизнедеятельности человека, участвуя в обмене веществ практически любой ткани человека. Особенно велика их роль в построении костной и зубной ткани, где преобладают такие элементы, как фосфор и кальций. Минеральные вещества участвуют в важнейших обменных процессах организма: водно-солевом, кислотно-щелочном, содержатся в цитоплазме и биологических жидкостях, играют основную роль в обеспечении постоянства осмотического давления, что является необходимым условием для нормальной жизнедеятельности клеток и тканей. Минеральные вещества входят в состав сложных органических соединений (гемоглобина, гормонов, ферментов). В виде ионов минеральные вещества участвуют в передаче нервных импульсов, обеспечивают свертывание крови. Многие ферментативные процессы в организме невозможны без участия тех или иных минеральных веществ.
Как уже говорилось, в зависимости от количества минеральных веществ в организме человека и пищевых продуктах, минеральные вещества разделяются на две группы: макроэлементы (десятки, сотни мг/кг в продуктах питания, а в организме массовая доля превышает 0,01%; Ca, P, Mg, K, Na, Cl, S) и микроэлементы (в организме ниже 10–5%; в продуктах единицы и менее мг на 100 г продукта Fe, Zn, I, F).
Микроэлементы условно делят на две группы: абсолютно или жизненно необходимые (кобальт, железо, медь, цинк, марганец, йод, бром, фтор) и так называемые вероятно необходимые (алюминий, стронций, молибден, селен, никель, ванадий и некоторые другие).
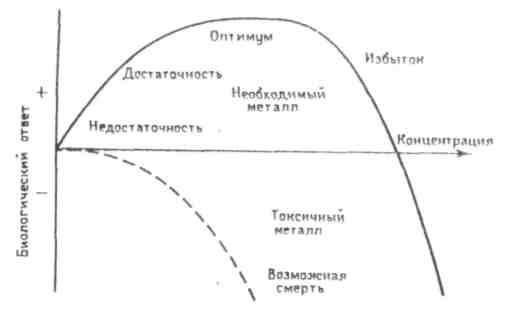
Характерным признаком необходимого элемента является колокообразный вид кривой зависимости ответной реакции организма от дозы элемента (рис. 2.1).
|
|
Рис. 2.1. – Биологический ответ в зависимости от концентрации необходимого (сплошная кривая) и опасного (штриховая кривая) вещества (взаимное расположение двух кривых относительно шкалы концентрации условно) |
При малом поступлении данного элемента организму наносится существенный ущерб (сплошная кривая). Он функционирует на грани выживания. В основном это объясняется снижением активности ферментов, в состав которых входит данный элемент. Сплошная кривая указывает на немедленный положительный ответ с увеличением концентрации, начиная с нулевой отметки (предполагается, что поступающее необходимое вещество насыщает места своего связывания и не вступает ни в какие иные взаимодействия, которые на самом-то деле вполне возможны). Эта сплошная кривая описывает оптимальный уровень, охватывающий широкий интервал концентраций для многих ионов металлов. Кривая проходит через максимум и начинает падать до отрицательных величин: биологический ответ организма становится негативным, а металл переходит в разряд токсичных веществ, т.е. при дальнейшем увеличении дозы проявляется токсическое действие избытка данного элемента, в результате чего не исключается и летальный исход.
Штриховая кривая на рисунке 2.1 демонстрирует биологический ответ организма на совершенно вредное вещество, не проявляющее эффектов необходимого или стимулирующего вещества. Эта кривая идет с некоторым запаздыванием, которое свидетельствует о том, что живой организм способен «мириться» с небольшими количествами токсичного вещества (пороговая концентрация) до тех пор, пока не станет преобладать его токсическое действие. На рисунке 2.1 представлена, конечно, некая обобщающая картина; каждое вещество имеет свою собственную специфическую кривую в координатах биологический ответ – концентрация.
Из рисунка 2.1 следует также, что необходимые вещества могут стать даже токсичными при избытке их потребления. Почти любое вещество в избытке неизбежно становится опасным (даже если это действие непрямое), например, по причине ограничения усвояемости других необходимых веществ.
К наиболее дефицитным минеральным веществам в питании современного человека относятся кальций и железо, к избыточным – натрий и фосфор.
Биологическая активность и токсичность s-элементов. Среди s-элементов наиболее важные биохимические функции выполняют катионы металлов 3-го и 4-го периодов. По содержанию в живых организмах, в т.ч. и в организме человека, элементы IA группы натрий и калий принадлежат к олигобиогенным элементам в отличие от лития, рубидия и цезия, которые относятся к ультрамикробиогенным элементам. Соединения щелочных металлов входят в состав тканей и жидкостей организмов человека, животных и растений. Натрий и калий относятся к жизненно необходимым элементам. Физиологическая и биохимическая роль лития, рубидия и цезия выяснена недостаточно, и они могут быть отнесены к примесным элементам.
Катионы s-элементов 3-го и 4-го периодов, а также некоторые неорганические анионы являются основными компонентами, определяющими физико-химические свойства биологических жидкостей. Электролитный состав жидкостей организма характеризуется главным образом содержанием Na, К, Mg, Ca, S, С, Р, С1 и некоторых других элементов в виде соответствующих ионов и различается для внутриклеточной и внеклеточной жидкостей.
Состав внеклеточной жидкости близок к составу морской воды в предкембрийскую эпоху, когда появились животные с замкнутой системой кровообращения. С тех пор соленость моря продолжала возрастать, тогда как состав внеклеточной жидкости остался постоянным. Основным катионом во внеклеточной жидкости является ион Na+, а из анионов преобладают Сl– и HCO3–. Внутри клеток преобладают катион К+ и анион НРО42–. Для соблюдения физико-химического закона электронейтрапьности, которому подчиняется любой живой организм в целом, некоторый недостаток неорганических анионов компенсируется анионами органических кислот (молочной, лимонной и др.) и кислых белков, несущих отрицательный заряд при физиологических значениях рН. Если вне клетки органические анионы компенсируют незначительную нехватку отрицательного заряда, то внутри клетки они должны компенсировать около 25% положительных зарядов, создаваемых неорганическими катионами. Поскольку клеточные мембраны легко проницаемы для воды, то они могут разрушаться при незначительных различиях в давлении жидкости внутри и снаружи клеточной мембраны. Поэтому осмотическое давление внутри клетки должно быть равно таковому во внеклеточной жидкости, т.е. живая клетка подчиняется закону изоосмоляльности. Повышенное содержание катионов по отношению к концентрации анионов во внеклеточных жидкостях в сравнении с внутриклеточными средами приводит к тому, что наружная поверхность мембран клеток оказывается заряжена положительно относительно ее внутренней поверхности, и это имеет огромное биологическое значение. В биологических жидкостях концентрацию осмотически активных частиц (независимо от их заряда, размера и массы) выражают в единицах осмоляльности – миллиосмомолях на 1 кг воды. Так как главные катионы и анионы внутриклеточных жидкостей многозарядные, то (при одинаковых осмоляльностях) концентрация электролитов, выраженная в миллиэквивалентах на 1 л, будет значительно выше внутри клетки, чем во внеклеточных жидкостях, где в основном содержатся однозарядные ионы.
Биологическая активность и токсичность p-элементов. Среди р-элементов в биологических системах наиболее распространены неметаллы водород, углерод, азот, кислород, фосфор, сера и хлор, важные биологические функции выполняют микроэлементы: иод, кремний, бор, селен, фтор, мышьяк и бром.
р-Металлы в большинстве случаев токсичны для организма, что объясняется тем, что, проявляя свойства мягких кислот, их ионы образуют прочные связи с кислород- и серосодержащими группами таких биолигандов, как белки (в т.ч. ферменты), нуклеиновые кислоты и т.д.
Биологическая активность и токсичность d-элементов. d-Блок Периодической системы включает 32 элемента 4–7-го больших периодов, для которых строение внешних электронных оболочек атомов можно выразить общей формулой: (п – 1)dansb,
|
где |
а = |
0–10, |
|
|
b = |
1; 2. |
Для d-металлов наиболее характерно образование координационных соединений с разнообразными, в т.ч. и биогенными, лигандами, что в основном и определяет их биологическую активность. Наличие d-орбиталей, лишь частично заполненных электронами, позволяет катионам этих металлов взаимодействовать с лигандами – анионами или электродонорными молекулами. Геометрия образующихся комплексов зависит от природы иона металла-комплексообразователя. Комплекс может иметь структуру тетраэдра, плоского квадрата, тригональной бипирамиды или октаэдра. При анализе структуры, физико-химических и биохимических свойств этих комплексов особое внимание обращается на природу связи и на геометрию комплекса. В координационных соединениях ионы d-металлов способны образовывать кроме σ-связей прямые и обратные дативные π-связи. Это обусловливает высокую комплексообразующую способность и непостоянство координационных чисел d-металлов. Как правило, в биокомплексах это четные координационные числа от 4 до 8, реже 10 и 12.
Можно утверждать, что в биосистемах свободных ионов d-металлов практически нет, так как они или гидролизуются, или находятся в составе координационных соединений. Чаще всего d-элементы участвуют в биохимических реакциях в составе комплексов с лигандами – аминокислотами, пептидами, белками, гормонами, нуклеиновыми кислотами и т.д. Наиболее распространенные металлоферменты, такие, как карбоангидраза, ксантинооксидаза, цитохромы и др., представляют собой биокомплексы d-металлов. Простетические группы гемоглобина, трансферрина и других сложных белков также представляют собой хелатные комплексы d-металлов.
Жизненно необходимые металлы Zn, Cu, Fe, Mn, Со, Мо («металлы жизни») входят в состав различных металлоферментов, катализирующих кислотно-основные и окислительно-вос- становительные биохимические реакции.
Многие соединения d-элементов, особенно производные Cd, Hg, V, Ag, Ni и Zn, оказывают на живые организмы токсическое действие, механизмы которого будут рассмотрены на конкретных примерах далее.
Большинство методов определения минеральных веществ (микроэлементов) в пищевых продуктах можно разделить на три типа.
Тип I – наиболее точные и сложные, которые могут использоваться только в исследовательских лабораториях) например, нейтронно-активационный анализ);
Тип II – арбитражные, которые требуют весьма сложного оборудования, но могут быть использованы на производстве (например, ААС)
Тип III – альтернативные (для текущих анализов), которые не требуют сложного оборудования, но по точности не уступают методам II типа (колориметрические, полярографические).
Для анализа минеральных веществ в основном используются физико-химические методы – оптические и электрохимические.
Оптические методы. Фотометрический анализ. Фотометрический анализ (молекулярная абсорбционная спектроскопия) основан на поглощении молекулами вещества излучений в ультрафиолетовой, видимой и инфракрасной областях электромагнитного спектра (медь, железо, хром, никель и др.).
Фотоэлектроколориметрия – основана на измерении поглощения окрашенными растворами монохроматического излучения в видимой области спектра. Измерение с помощью фотоэлектроколориметров, снабженных узкополосными светофильтрами.
Спектрофотометрия – измерение поглощения монохроматического излучения в УФ, видимой и ИК областях спектра. Измерения с помощью спектрофотометров, где в качестве монохроматоров – диспергирующие призмы и дифракционные решетки.
Количественный анализ обычно проводят методом градуировочного графика.
Эмиссионный спектральный анализ. Эмиссионный спектральный анализ основан на измерении длины волны, интенсивности и других характеристик света, излучаемого атомами и ионами вещества в газообразном состоянии. Эмиссионный спектральный анализ позволяет определить элементарный состав неорганических и органических веществ.
Интенсивность спектральной линии определяется количеством возбужденных атомов в источнике возбуждения, которое зависит не только от концентрации элемента в пробе, но и от условий возбуждения. При стабильной работе источника (электрическая дуга, искра, пламя) возбуждения связь между интенсивностью спектральной линии и концентрацией – линейна и можно использовать метод градуировочного графика. Методом определяют свыше сорока элементов (щелочные, щелочно-земельные, медь, марганец и др.)
Атомно-абсорбционная спектроскопия. Метод основан на способности свободных атомов элементов в газах пламени поглощать световую энергию при характерных для каждого элемента длинах волн. Практически полностью исключена возможность наложения спектральных линий различных элементов, т.к. их число в спектре значительно меньше, чем в эмиссионной спектроскопии. Уменьшение интенсивности резонансного излучения подчиняется экспоненциальному закону. Аналогичному закону Бугера-Ламберта-Бера. Разработаны методики более чем для 70 элементов. Арбитражный метод для большинства микроэлементов. Иногда необходимо предварительное концентрирование или использование графитовой кюветы, или и то и другое.
Электрохимические методы. Ионометрия. Ионометрия используется для определение ионов K, Na, Ca, Mg, F, I, Cl и т.д. Метод основан на использовании ионселективных электродов, мембрана которых проницаема для определенного типа ионов (отсюда высокая селективность, как правило). Используют либо калибровочный график (Е-рС), либо метод добавок.
Полярография. Переменно-токовую полярографию используют для определения ртути, кадмия, свинца, меди, железа. Метод основан на изучении вольтамперных кривых, полученных при электролизе окисляющегося или восстанавливающегося вещества. Электрод – чаще всего ртутный капельный, иногда – платиновый, графитовый.