
Клин рук-во по ЧМТ том 3 / ГЛАВА 13
.docПосттравматические нарушения движений и мышечного тонуса
1 3
3
ПОСТТРАВМАТИЧЕСКИЕ НАРУШЕНИЯ ДВИЖЕНИЙ И МЫШЕЧНОГО ТОНУСА
В.А.Шабалов
13.1. ПАТОГЕНЕЗ
Среди последствий черепно-мозговой травмы отдельного внимания заслуживают нарушения произвольных движений и мышечного тонуса. Они развиваются чаще в резидуальном периоде. Гиперки-незы преимущественно возникают у пострадавших детского и молодого возраста, как один из вариантов регресса гемипареза или гемиплегии, развившихся в остром периоде. При этом, если у взрослых гемипарез со временем приобретает черты спастического или спастико-ригидного, то у детей более отчетливо проявляются дистонические и ригидные черты мышечного тонуса; на таком фоне развертывается атетоидный, дрожательный или сложный (сочетающий в себе различные виды непроизвольных движений) гиперкинез. Несколько увеличивает вероятность развития гемигиперкине-за интенсивное применение ноотропов.
У больных, длительно находившихся в коматозном состоянии, наряду с традиционными ди-энцефальными синдромами развивается акинети-ко-ригидный или дрожательно-ригидный синдром, который неплохо поддается коррекции противопар-кинсоническими препаратами.
Повторные легкие черепно-мозговые травмы также могут привести к развитию синдрома посттравматического паркинсонизма («паркинсонизм боксеров»).
В основе патогенеза посттравматических гипер-кинезов лежит ишемическое и/или (реже) геморрагическое поражение подкорковых структур вследствие нарушения кровообращения в зонах смешанного кровообращения (критические зоны). В первую очередь — это бассейны передней и задней хо-риоидальных артерий. Очаги ушиба ствола и базаль-ных отделов лобных долей в резидуальном периоде
также могут быть причиной развития непроизвольных движений.
Среди посттравматических гиперкинезов выделяют: тремор, атетоз, баллизм, миоклонии и сложные гиперкинезы, сочетающие в себе разнообразных комбинациях ранее перечисленные видов непроизвольных движений.
Среди посттравматических видов нарушений регуляции мышечного тонуса следует выделять: ригидность, спастичность, спастико-ригидностъ и дистонию (изменяющийся уровень сопротивления мышц их пассивному растяжению).
Работ, посвященных нейрохирургическому лечению посттравматических гиперкинезов крайне мало (2, 3, 5). Это, в первую очередь, связано с относительной редкостью этой патологии и определенной инертностью мышления. (Как известно вторым (неофициальным) названием детского церебрального паралича является «последствия родовой травмы». Здесь фигурирует как сама черепно-мозговая травма, так и вся лавина патологических процессов, включающих ишемию, кровоизлияние, отек, набухание головного мозга и т.д..
Синдром паркинсонизма крайне редко рассматривается как последствие черепно-мозговой травмы. Однако посттравматический паркинсонизм выделяется в отдельную нозологическую форму.
13.2. ЛЕЧЕНИЕ
Акинетико-ригидный синдром и посттравматтичес-киий паркинсонизм достаточно успешно лечатся медикаментозно (I).
В тех случаях, когда больной не переносит про-тивопаркинсонические препараты или их дозы слишком велики и вызывают тяжелые побочные
271
 эффекты,
возникает необходимость применять
методы
функциональной
нейрохирургии.
эффекты,
возникает необходимость применять
методы
функциональной
нейрохирургии.
Консервативное лечение сложных и неритмичных гиперкинезов на фоне дистонических изменений мышечного тонуса, как правило, не эффективно.
Функциональная нейрохирургия относится к минимально инвазивным методам хирургического лечения.
Основные положения функциональной нейрохирургии:
-
Коррекции деятельности поврежденной не рвной системы можно добиться посредством блокирования или стимуляции структур, не связанных напрямую, а лишь являющимися «посредниками» между очагом (или очагами) патологии, и эффекторными органами.
-
Коррекции подлежит лишь «гиперфункция», т.е. избыточная, не соответствующая нормаль ной функция центральной нервной системы (гиперкинез, повышенный мышечный тонус, эпилептический разряд, центральная боль, висцеральные и сосудистые синдромы). Гипер функция является проявлением компенсации нервной системы того дефекта, который воз ник вследствие поражения определенных «тор мозных» структур или систем мозга.
-
Признаки «гипофункции», такие как парез, гипестезия и т.п., не поддаются коррекции методами функциональной нейрохирургии. Однако в последнее десятилетие это положе ние частично пересмотрено вследствие вне дрения в клиническую практику более совер шенных технологий.
-
Одного и того же клинического эффекта мож но достичь вмешательством на различных структурах и уровнях центральной нервной си стемы.
-
Различные методы воздействия на одну и ту же структуру головного и спинного мозга или расширение зоны этого воздействия на сосед ние структуры может привести к различным (иногда противоположным) клиническим эф фектам.
-
Очаг поражения головного мозга не может быть мишенью для функционального нейро хирургического вмешательства.
-
Выбор мишени зависит от характера посттрав матического гиперкинеза.
-
Даже близкое расположение очага поражения к выбранной структуре-мишени не является препятствием для нейрохирургического вме шательства
-
Интраоперационное нарастание выраженно сти симптомов выпадения (гемипарез, геми- гипестезия, дизартрия, афазия) являются аб солютными показаниями для прекращения функционального поиска зон, эффективных для лечения посттравматических гиперкине зов или создания в них очагов деструкции. В этих условиях необходимо расчленить деструк тивную операцию на 2 (или более) этапов, или применить методы хронической электро стимуляции (нейростимуляции).
-
Применение местной анестезии значительно снижает риск нарастания симптомов выпаде ния в послеоперационном периоде.
Показанием к нейрохирургическим вмешательствам на подкорковых структурах головного мозга является наличие непроизвольных движений конечностей и изменений мышечного тонуса в них, не поддающееся медикаментозной коррекции, значительно нарушающих бытовую адаптацию пациентов и препятствующие полноценную их реабилитацию.
Противопоказаниями могут быть текущий воспалительный процесс, прогрессирующая гидроцефалия (5).
В зависимости от вида патологии функциональные нейрохирургические вмешательства осуществляются на корешках, задних рогах и проводниковых путях спинного мозга, ядрах ствола головного мозга, подкорковых и корковых структурах больших полушарий и мозжечка. Функциональные нейрохирургические вмешательства могут осуществляться на нескольких структурах головного мозга, расположенных на большом расстоянии друг от друга или даже в разных полушариях, а также сочетать деструктивные и стимуляционные методы для достижения оптимального клинического эффекта.
Посттравматические гиперкинезы, как правило, успешно поддаются лечению с помощью сте-реотаксических вмешательств на подкорковых структурах головного мозга. В настоящее время в большинстве клиник мира такие вмешательства производят под контролем КТ или МРТ.
Методика проведения стереотаксических вмешательств достаточно подробно описана в многочисленных руководствах по нейрохирургии (2, 5). Вмешательства при посттравматическом паркинсонизме практически ничем не отличается от таковых при лечении болезни Паркинсона или синдрома паркинсонизма другой (не травматической) этиологии. Очаги деструкции располагают в вентро-оральной группе ядер таламуса, в субталамическом ядре или в медиальном членике бледного шара (рис. 13-1 ).
272
Посттравматические нарушения движений и мышечного тонуса

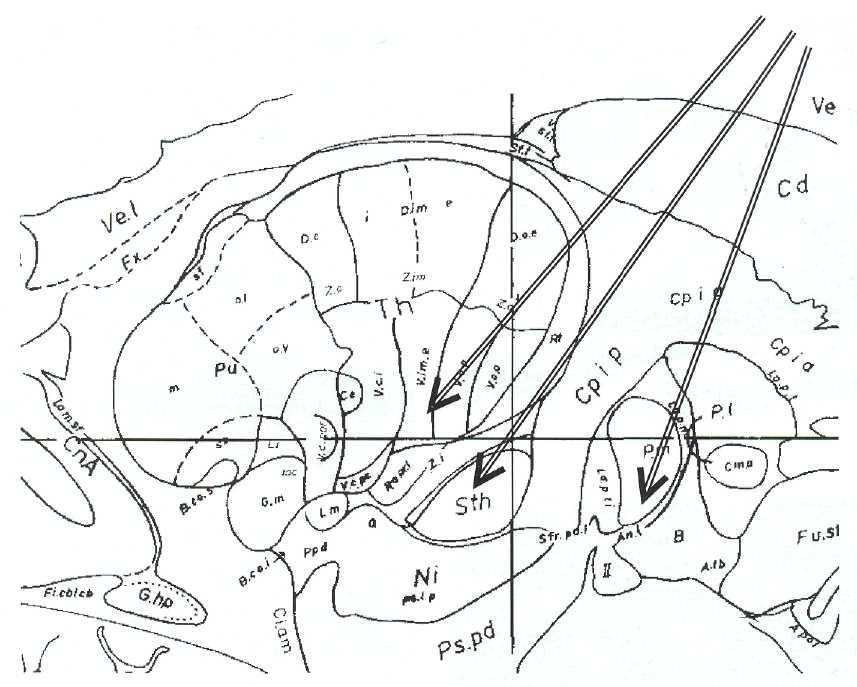
При стереотаксических вмешательствах по поводу посттравматических гиперкинезов необходимо использовать наиболее щадящий метод деструкции. Этим требованиям отвечает метод анодного электролиза и канюля для деструкции с боковым стилетным электродом. Данный метод позволяет сформировать очаг сухого некроза произвольной формы диаметром от 2мм. Инерционность этого метода минимальна: процесс деструкции прекращается практически мгновенно после выключения тока. Таким образом, при первых же признаках нарастания существующих посттравматических симптомов выпадения деструкция может быть приостановлена. Это практически невозможно при использовании криодеструкции или радиочастотной термокоагуляции.
В последнее десятилетие 20 века весьма широко стали применять хроническую электростимуляцию (нейростимуляцию) вышеуказанных структур. Помимо них производят нейростимуляцию субтала-мического ядра (см. рис. 13-1) преимущественно у больных с акинетико-ригидной или акинетической формами посттравматического паркинсонизма. Сти-муляционные воздействия значительно менее трав-
матичны и реже сопровождаются серьезными осложнениями, чем деструкции .
В настоящее время наиболее широко в мире применяют системы для хронической электростимуляции производства фирмы MEDTRONIC (США). Это системы ITREL2, SOLETRA, KINETRA (Рис. 13-2, 13-5, 13-6). Б России производятся отечественные системы НЕИРОЭЛЕКТ, предназначенные также для хронической нейростимуляции глубоких структур головного мозга (рис. 13-3, 13-4).
При спастических гемипарезах в последние десятилетия успешно применяют системы для суба-рахноидалъного (интратекального) введения Бак-лофена (Леурезала). Баклофен является агонистом тормозного медиатора (-аминомасляной кислоты (ГАМК). Он воздействует на бицикулиночувстви-тельные рецепторы нейронов, широко представленные в центральной нервной системе, в частности во II и III пластинах спинного мозга (по Рексе-ду). Вследствие этого происходит уменьшения выброса активирующих медиаторов (глютамат и аспар-тат). Клинически это проявляется снижением уровня спастичности как церебрального, так и спиналь-ного генеза. Пероральное применение Баклофена
273
Клиническое руководство по черепно-мозговой травме

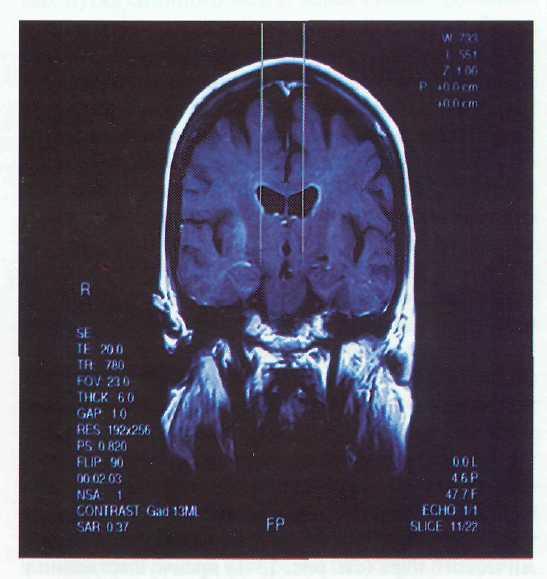

Рис. 13-2. Имплантируема система для хронической электростимуляции подкорковых структур головного мозга ITREL3 производства фирмы MEDTRONIC (США).
Видны: внутримозговой электрод (слева) и подкожный генератор (справа)
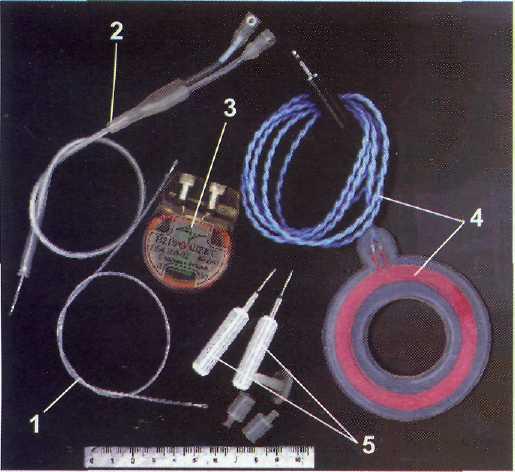
Рис. 13-3. Имплантируемая система для хронической электростимуляции подкорковых структур головного мозга НЕЙРО-ЭЛЕКТ производства ВНИИОФИ (Россия). Пояснения: 1 — внутримозговой электрод; 2 — коннектор, соединяющий внутримозговые электроды с подкожным приемником; 3 — подкожный приемник; 4 — накожная антенна для наружного генератора импульсов; 5 — отвертки.
имеет длительную историю. Однако было доказано плохое его проникновение через гематоэнцефали-ческий барьер, что требовало применения больших суммарных доз препарата.
Первые сообщения о влиянии интратекально-го введения Баклофена на спастичность спиналь-ного и церебрального происхождения появились в 1984 году. Было доказано, что такой способ введения Баклофена приводит к стойкому и длительному снижению спастичности при минимальной

Рис. 13-4. Контрольная КТ больного с посттравматическим паркинсонизмом после имплантации хронических электродов вен-тро-оральную группу ядер левого таламуса. Видны контактные поверхности электродов.
Рис. 13-5. Контрольная MPT больного с посттравматическим паркинсонизмом после имплантации хронических электродов в медиальный членик бледного шара справа и в субталамичес-кое ядро слева.
274
Посттравматические нарушения движений и мышечного тонуса

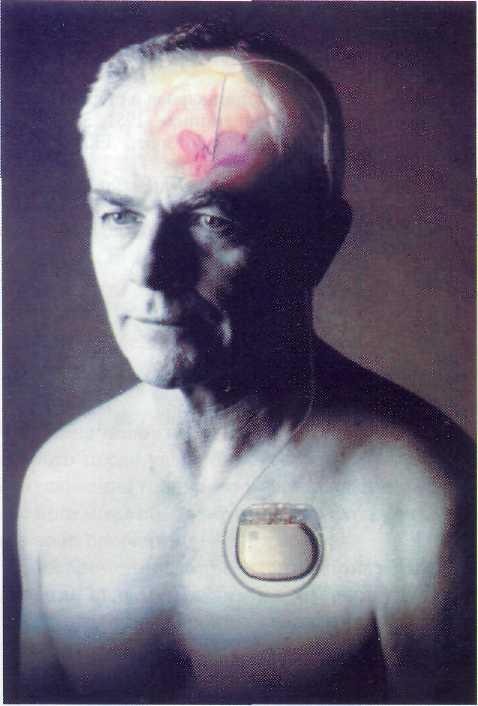
Рис. 13-6. Схематическое изображение всей имплантируемой системы ITREL3.
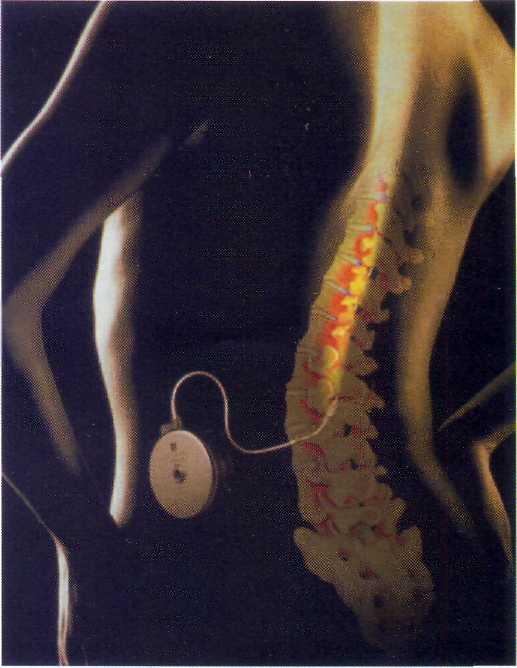
Рис. 13-7. Схематическое изображение имплантированной системы SYNCHROMED производства фирмы MEDTRONIC (США) для хронического введения баклофена в субарахнои-дальное пространство.
суточной дозе. Совершенствование систем для непрерывной подачи препарата способствовало широкому распространению этого метода во всем мире.
В настоящее время применяют программируемые помпы SYNCHROMED (Медтроник, США) объемом резервуара 18 и 10 мл (рис. 13-7).
Показанием к имплантации системы является выраженное снижение спастичности в ответ на болюсное введение 50, 75 или 100 микрограмм баклофена эндолюмбально. Оценка эффекта проводится по стандартным шкалам (Asworth и др.) в течение 12 часов после введения.
Противопоказанием к данному виду лечения является повышенная чувствительность к Баклофе-ну или тонкий слой подкожной клетчатки (менее 2,5 см).
Процедура имплантации заключается во введении катетера в субарахноидалъное пространство (L2—L3) по игле до уровня Thll—ТЫ2 (при спи-нальной спастичности) или до Th8—ThlO (при церебральной спастичности). Обязателен рентгеновский контроль. Катетер фиксируется к межостис-
той связке или апоневрозу и далее под кожей проводится в карман, сформированный в подкожной клетчатке передней брюшной стенки, где и соединяется с уже заряженной помпой.
Суточная доза баклофена подбирается индивидуально. Она варьирует от 27 до 1000 микрограмм в сутки. Режим подачи Баклофена (доза, прерывистая или постоянная подача препарата, смена концентрации препарата) программируется чрескож-но с помощью специального программатора. Помпа снабжена зуммером, который включается при уменьшении объема препарата в резервуаре ниже критического уровня. Это является сигналом к введению новой дозы. Обычно такая подзарядка требуется с интервалом от 1,5 до 3 месяцев. Введение новой дозы препарата осуществляется пункцион-но в амбулаторных условиях.
При тщательной селекции пациентов и подборе оптимальных доз возможно добиться выраженного и стабильного снижения уровня спастичности (церебральной и спинальной) в 90—95 % случаев. Побочные эффекты (частота не более 20 %) связаны с передозировкой препарата. Они вклю-
275
Клиническое руководство по черепно-мозговой травме
 чают
тошноту, рвоту, гипотонию, сомноленцию,
депрессию
дыхания. Поэтому наращивание суточной
дозы производят очень плавно, увеличивая
ее каждый раз не более чем на 20 % от общей
дозы.
чают
тошноту, рвоту, гипотонию, сомноленцию,
депрессию
дыхания. Поэтому наращивание суточной
дозы производят очень плавно, увеличивая
ее каждый раз не более чем на 20 % от общей
дозы.
Таким образом, применение методов функциональной нейрохирургии существенно расширяет возможности полноценной реабилитации больных после тяжелой черепно-мозговой травмы и улучшает клинический прогноз.
Литература
-
Каменецкий В.К. - Паркинсонизм. Санкт-Петербург: «Питер», 2001, 414 с.
-
Кандель Э.И. - Функциональная и стереотаксичес- кая нейрохирургия. М.: «Медицина», 1981, 368 с.
-
P.Decg, У. Keravel. Neurochirurgie., Ellipses, Paris, 1995, 704 p.p.
-
Schaltenbrant G., Wahren W. Atlas for stereotaxy of the human brain.// Stuttgart,1977, 500 p.p.
-
Schalt G, Walker A.E. Stereotaxy of the human brain/ /1982, 700 p.p.
276
