
Глава 2
Взаимодействие трифторуксусной кислоты с лимоненом,
Α-терпиненом и γ-терпиненом
(Обсуждение результатов)
В дипломной работе исследовано взаимодействие лимонена, α-терпинена, γ-терпинена с трифторуксусной кислотой в различных условиях для определения зависимости направления реакций от положения двух двойных связей в п-ментановом скелете молекул терпеновых углеводородов.
Нами найдено, что взаимодействие лимонена с трифторуксусной кислотой в мягких условиях, аналогичных тем, которые были использованы в работах японских [8] и бразильских [7] ученых, протекает с высокой степенью конверсии лимонена и хемоселективно. В реакции участвует экзоциклическая связь С=С, что приводит к образованию исключительно α-терпинилтрифторацетата.
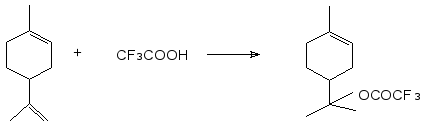
Реакцию проводили в толуоле, при соотношении лимонена и трифторуксусной кислоты 1:1,2, температуре реакционной массы 300С, при перемешивании, в течение 40 минут. По окончании реакции удаляли избыток трифторуксусной кислоты и отгоняли растворитель. Получили продукт, представляющий собой прозрачную маслянистую жидкость с желтовато-оранжевым оттенком. Его анализировали с помощью методов ЯМР 1Н и 19F спектроскопии.
В спектре ЯМР 1Н (рис.2.2) положение сигнала метильных протонов при С9 вследствие изменения экранирования приняло другие значения по сравнению с лимоненом (рис.2.1.), а именно: оно сместилось в более сильное поле (δ 1.53 м.д., вместо δ 1,72 м.д.), сигнал δ 4.69 м.д., который в лимонене характеризовал положение этиленовых протонов атома С10 практически исчез. Вместо него появился сигнал метильных протонов С10 с δ 1,54 м.д. Метильные протоны у атома С7 представлены таким же сигналом, как и в исходном лимонене (δ 1.644 м.д.) и олефиновый протон у атома С2 при двойной связи внутри цикла сохранил значение химического сдвига (δ 5,39 м.д.) На основании соотношений интенсивности этиленовых протонов при С2 и С10 можно утверждать, что экзоциклическая двойная связь прореагировала на 93-97%.
В спектре ЯМР 19F реакционной смеси (рис.2.3) присутствует единственный сигнал с δF -75.21 м.д., который характерен для терпинилтрифторацетата [7].
Таким образом, в данных условиях реакция лимонена с трифторуксусной кислотой является хемоселективной.
Полученный α-терпинилтрифторацетат, который в работе [7] ошибочно характеризовался как термически неустойчивый, нами выделен в чистом виде путем перегонки в вакууме. Он представляет собой подвижную бесцветную жидкость с т.кип. 65-67°С (2мм рт.ст.), nD22 1.4210. В спектрах ЯМР 1Н (рис. 2.2.1.) и 19F (рис. 2.2.2.) присутствуют сигналы соответствующих группировок с химическими сдвигами, которые идентичны по своим значениям сигналам в неперегнанном продукте (рис.2.2. и рис.2.3.).
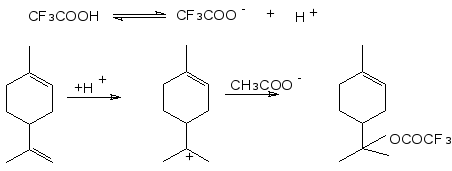
Вероятно, взаимодействие лимонена с трифторуксусной кислотой в мягких условиях протекает через промежуточное образование карбкатиона с С8-карбениевым атомом, который быстро присоединяет трифторацетат-ион, не претерпевая изомеризационных превращений.
С целью дополнительного подтверждения строения полученного α-терпинилтрифторацетата это соединение синтезировано нами встречным синтезом из α-терпинеола взаимодействием с трифторуксусным ангидридом при мольном соотношении 1:3. Реакцию проводили в четыреххлористом углероде при перемешивании и охлаждении, добавляя по каплям трифторуксусный ангидрид так, чтобы температура реакционной смеси не превышала 00С. Остаток после отгонки четыреххлористого углерода, избытка трифторуксусного ангидрида и образующейся в ходе реакции трифторуксусной кислоты представляет собой жидкость темно-коричневого цвета.
Спектр ЯМР 1Н (рис.2.5) и ЯМР 19F (рис.2.6.) идентичны спектрам α-терпинилтрифторацетата, полученного из лимонена.
Можно было полагать, что ужесточение условий взаимодействия лимонена с трифторуксусной кислотой повлечет за собой участие в реакции и эндоциклической связи С=С, что приведет к получению бис-трифторацетата терпина. Действительно, нами найдено, что при температуре 110°С и соотношении лимонен : трифторуксусная кислота 1:2,5 взаимодействие этих веществ происходит с участием обеих двойных связей. Однако доминирующим процессом является диспропорционирование лимонена. Реакцию проводили в кипящем толуоле в течение двух часов. Остаток после удаления избытка трифторуксусной кислоты и растворителя представляет собой прозрачную маслянистую жидкость с желтовато-оранжевым оттенком.
Спектр ЯМР 1Н (рис.2.7) указывает на то, что реакция прошла с участием двух двойных связей, так как отсутствуют сигналы этиленовых протонов как в области δ 4.69 м.д.(экзоциклическая связь С=С), так и δ 5.39 м.д. (эндоциклическая связь С=С). Сигналы с химическим сдвигом δ 2.32 и δ 7.12 м.д. указывают на присутствие в реакционной смеси n-цимола. Группа сигналов в районе δ 0.881 м.д. свидетельствует о наличии n-ментана.
В спектре ЯМР 19F (рис.2.8) наряду с наиболее интенсивным сигналом δF-75.031 м.д., присутствует малоинтенсивные сигналы δF-75.14; -75.83 и -75.617 м.д., которые относятся к различным вариантам трифторацетоксильных групп.
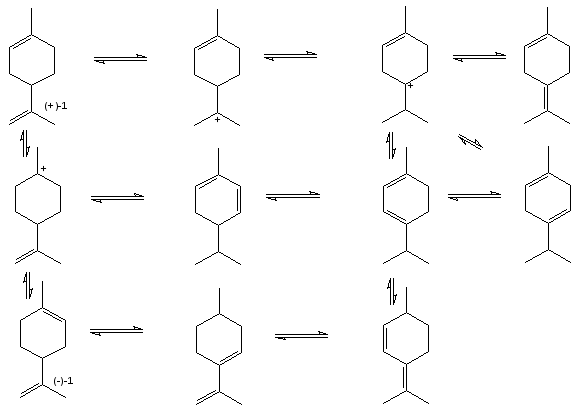
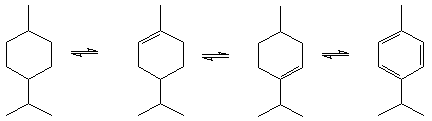
Таким образом, по результатам ЯМР спектроскопии можно сделать вывод о том, что нагревание реакционной смеси приводит к резкому снижению хемоселективности реакции и образованию продуктов различного строения, в том числе не содержащих эфирных группировок. Действительно, ранее было показано [], что в присутствии кислых катализаторов, например, кислот Льюиса, происходят процессы c возникновением карбкатионов различного строения, сопровождающиеся диспропорционированием лимонена с образованием п-ментенов (3,4), п-ментана (2), п-цимола (5). Указывается [], что при повышение температуры процессы диспропорционирования начинают преобладать (схема 2.1.).
2 3 4 5
Схема 2.1. Диспропорционирование лимонена.
Для подавления процессов диспропорционирования, вероятно, необходимо существенное понижение температуры взаимодействия лимонена с трифторуксусной кислотой. При этом, однако, требуется использование более эффективных протонодоноров в качестве катализатора, чем трифторуксусная кислота.
Нам удалось осуществить реакцию лимонена с трифторуксусной кислотой при 0°С в присутствии серной кислоты с участием обеих связей С=С и получением продукта присоединения двух молекул трифторуксусной кислоты – бис-трифторацетата терпина.
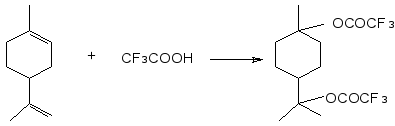
Взаимодействие лимонена с трифторуксусной кислотой осуществляли при мольном соотношении 1:2,5 в толуоле при температуре 00С при перемешивании смеси в течение 40 минут. После удаления избытка трифторуксусной кислоты и серной кислоты промыванием и отгонки растворителя получили продукт, представляющий собой прозрачную маслянистую жидкость с желтовато – оранжевым оттенком. Его анализировали с помощью методов ЯМР 1Н и 19F спектроскопии.
В спектре ЯМР 1Н (рис.2.9) протоны метильной группы атома С7 представлены химическим сдвигом δ 1.584 м.д. (в исходном лимонене – δ 1.645 м.д.), метильные протоны в изопропильном радикале – δ 1.536 м.д. (в лимонене – δ 1.725 м.д.). Сигналы этиленовых протонов обеих С=С связей (δ 5.393 и 4.694 м. д.) отсутствуют.
В спектре ЯМР 19F (рис.2.10) присутствуют два сигнала близкой интенсивности с химическими сдвигами δF-75.34 и -75,38 м.д., которые относятся к трифторацетоксильным группам.
Полученный продукт очищен перегонкой в вакууме и идентифицирован как бистрифторацетат терпина. Он представляет собой подвижную бесцветную жидкость, т.кип. 85-86°С (2 мм рт.ст.), nD22 1.3967. При хранении постепенно приобретает сиреневую окраску. Строение бистрифторацетата терпина подтверждено данными ЯМР 1H и 19F спектроскопии (рис.2.9.1. и рис.2.9.2.). Так, в спектре ЯМР 1H сигналы δ 1,57 и 1,52 м.д. относятся к метильным протонам при С7 и С9, С10 соответственно. Их положение отличается от химических сдвигов таких же протонов в трифторацетате α-терпинеола(рис.2.2.1.). В спектре ЯМР 19F имеются два сигнала с δF -75,20 и -75,26 м.д.
Следует отметить, что эти спектры совпадают со спектрами бис-трифторацетата терпина, полученного М.Михальченко из терпингидрата [15].
