
терпены / Дипломы других / Присоединение трифторуксусной кислоты к терпеновым углеводородам
.docx-
Присоединение трифторуксусной кислоты к терпеновым углеводородам
Получение трифторацетатов путем присоединения трифторуксусной кислоты по двойным связям представляет несомненный практический интерес, так как в ряде случаев алкены, например терпеновые углеводороды, являются более доступными, чем соответствующие спирты.
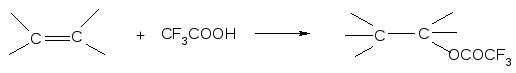
Особый интерес представляет взаимодействие α-пинена и камфена с трифторуксусной кислотой, в результате чего возможно образование изоборнилтрифторацетата, который можно рассматривать как потенциальное физиологически активное вещество.
Было установлено, что после смешения α-пинена(1.1) с трифторуксусной кислотой при последующем нагревании образуется сложная смесь веществ, в которой с помощью ГЖХ обнаружены β-пинен(2), камфен(3), дипентен(4), терпинолен(5), трициклен, α- и γ-терпинены(6,7), α- и β-фелландрены(8,9), фенхены, эфиры борнеола(10), фенхола(12), изоборнеола(11) и изофенхола(13). Однако, если приготовление реакционной смеси осуществлялось таким образом, чтобы при смешивании компонентов температура не поднималась выше 0°С, то после нагревания в продуктах реакции оказывалось только шесть соединений. Сначала появлялись камфен, дипентен, терпинолен, β-пинен, борниловый эфир трифторуксусной кислоты, а спустя некоторое время - изоборниловый эфир, содержание которого в конечном продукте реакции было незначительным. Основные направления превращений α-пинена показаны на схеме 1.1.
Основные маршруты превращений α-пинена
в ходе реакции с трифторуксусной кислотой.
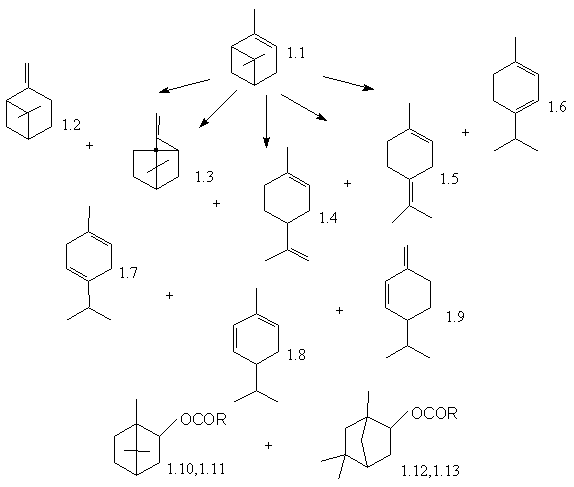
Схема 1.1
1.1 α-Пинен; 1.2. β-Пинен; 1.3. Камфен; 1.4. Дипентен; 1.5. Терпинолен; 1.6. α-Терпинен; 1.7. γ-Терпинен; 1.8. α-Фелландрен; 1.9. β-Феландрен; 1.10,1.11. Эфиры борнеола и изоборнеола; 1.12,1.13. Эфиры эфиры фенхола и изофенхола.
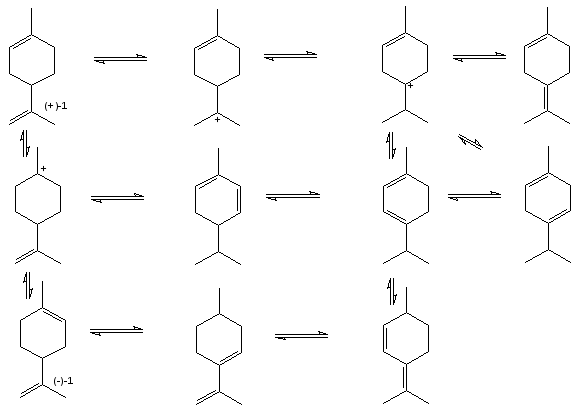
Многообразие конечных продуктов объясняется образованием неустойчивого пинанильного катиона (схема 1.2).
Взаимные переходы между мостиковыми карбкатионами (R =CF3)
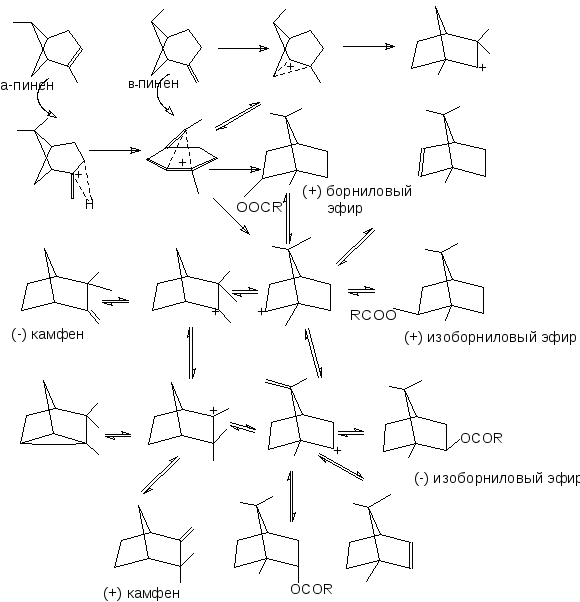
Схема 1.2
Маркевич Р.Н., Ламоткин А.И. и Резников В.Н. [10] предположили, что при гомогенном кислотном катализе промежуточным продуктом в изомеризационных превращениях α-пинена является борниловый эфир.
Таким образом, на основании литературных данных можно сделать вывод, что реакции терпенов с карбоновыми кислотами характеризуются многообразием направлений и в результате приводят к получению сложной смеси важных в практическом отношении веществ.
Недавно было установлено, что присоединение трифторуксусной кислоты к камфену является в высокой степени хемо- и стереоселективным процессом. Практически единственным продуктом при соотношении реагентов 1:1 является изоборнилтрифторацетат, который выделен с выходом 90%.

М. де Маттос и сотрудники взаимодействием лимонена с трифторуксусной кислотой в циклогексане получили терпинилтрифторацетат, который охарактеризован с помощью ЯМР спектроскопии.
В работе {} взаимодействие лимонена с трифторуксусной кислотой использовано для синтеза α-терпинеола из d-лимонена через терпинилтрифторацетат.
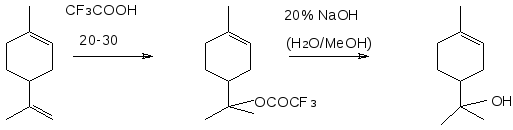
Однако терпинилтрифторацетат не был выделен из реакционной смеси, а его физико-химические свойства не исследовались.
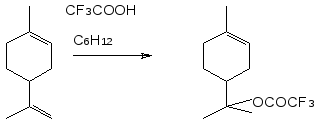
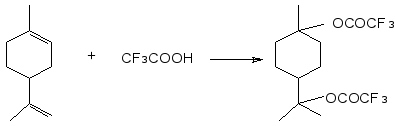
Детальное изучение реакции трифторуксусной кислоты с лимоненом, осуществленное в последнее время в СПбГТУРП, позволило установить, что в мягких условиях, аналогичных тем, которые были использованы в работах [12,13], взаимодействие протекает с высокой степенью конверсии лимонена и хемоселективно. В реакции участвует экзоциклическая связь С=С, что приводит к образованию исключительно α-терпинилтрифтор-ацетата, который впервые был выделен в чистом виде и охарактеризован физико-химическими константами и данными ЯМР 1Н и 19F спектроскопии.
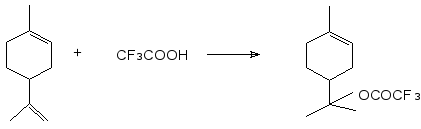
Предположено, что взаимодействие лимонена с трифторуксусной кислотой в мягких условиях (растворитель - толуол, температура 30°С, соотношение реагентов 1:1,2) протекает через промежуточное образование карбкатиона с С8-карбениевым атомом, который быстро присоединяет трифторацетат-ион, не претерпевая изомеризационных превращений.

В более жестких условиях (температура 110°С, соотношение лимонен: трифторуксусная кислота 1:2,5) взаимодействие лимонена с трифторуксусной кислотой происходит с участием обеих двойных связей, при этом доминирующим процессом является диспропорционирование лимонена с образованием п-ментенов (1.15,1.16), п-ментана (1.14), п-цимола (1.17) (схема 1.3).
Диспропорционирование лимонена
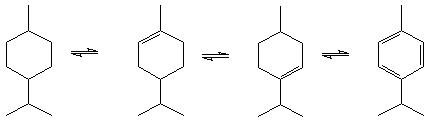
1.14 1.15 1.16 1.17
Схема 1.3
Для подавления процессов диспропорционирования, вероятно, необходимо существенное понижение температуры взаимодействия лимонена с трифторуксусной кислотой. При этом, однако, требуется использование более эффективных протонодоноров в качестве катализатора, чем трифторуксусная кислота.
Реакция лимонена с трифторуксусной кислотой в присутствие серной кислоты в качестве катализатора при температуре 0°С также протекает с участием обеих двойных связей, но приводит к получению продукта присоединения двух молекул трифторуксусной кислоты – бистрифторацетата терпина, который был получен и выделен в чистом виде впервые.
Таким образом, на примере камфена и лимонена показано, что присоединение трифторуксусной кислоты к экзоциклическим двойным связям протекает хемоселективно. Присоединение трифторуксусной кислоты к эндоциклической двойной связи, например, α- и β-пинена сопровождается образованием широкой гаммы продуктов реакции вследствие образования на промежуточной стадии склонного к изомеризации пинанильного катиона.
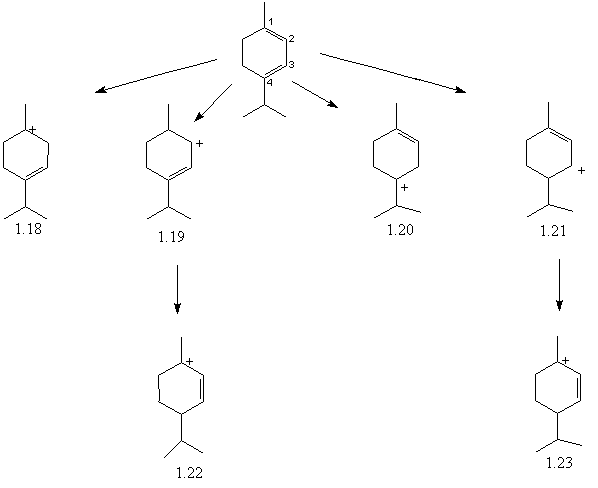
На кафедре органической химии СПбГТУРП исследовано также [14] взаимодействие α- и γ-терпинена с трифторуксусной кислотой в различных условиях для определения зависимости направления реакций от положения двух двойных связей в п-ментановом скелете молекул терпеновых углеводородов.
В отличие от лимонена α-терпинен содержит две эндоциклические сопряженные связи. В некоторых известных реакциях с электрофильными реагентами α-терпинен реагирует по типу 1,2; 3,4 и 1,4-присоединения, характерного для сопряженных диеновых углеводородов. Он вступает также в классическую реакцию циклоприсоединения – реакцию Дильса-Альдера. Во многих случаях реакции сопровождаются процессами изомеризации и диспропорционирования.
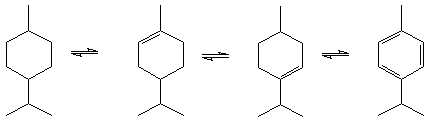
В реакциях с протонными электрофильными реагентами, в том числе с трифторуксусной кислотой, первоначально могут возникать карбкатионы четырех типов, наиболее устойчивыми из которых являются 1 и 3 (схема 1.4). Присоединение к катионам 1 и 4 трифторацетат-ионов должно приводить к образованию продуктов 1,2- и 3,4-присоединение. Катионы 2 и 4 в качестве резонансных структур образуют катионы 5 и 6, присоединение к которым, трифторацетат-ионов, даст продукты 1,4-присоединения. Кроме того, стабилизация катионов 1 и 6 может осуществляться за счет диспропорционирования путем процессов внутри- и межмолекулярного переноса протонов. Это может привести в итоге к образованию конечных продуктов n-ментана (1.14), n-ментенов (1.15,1.16) и п-цимола (1.17). Преобладание того или иного направления реакции, вероятно, определяется условиями реакции, в первую очередь температурой и концентрацией кислоты.
Образование карбкатионов при действии протонных
электрофильных реагентов к α-терпинену.
1.14 1.15 1.16 1.17
Схема 1.4
Взаимодействие α- и γ-терпиненов с трифторуксусной кислотой как в мягких, так и в жестких условиях не привело к получению трифторацетатов терпеновых спиртов. Основным направлением этих реакций является диспропорционирование исходных терпенов в п-ментан и п-цимол.
Полученные результаты объясняются различной устойчивостью карбкатионов, возникающих в качестве интермедиатов в реакциях терпеновых углеводородов п-ментаного ряда, которые имеют разное взаимное положение двух связей С=С.
