
- •1.Общие сведения о нефтегазовых операциях.
- •2. Способы бурения скважин.
- •3. Классификация скважин
- •1. Назначение и состав бурильной колонны.
- •2. Цели и способы бурения наклонно-направленных и горизонтальных скважин
- •3. Кустовые размещение скважин.
- •4.Многозабойные и многоярусные скважины.
- •1. Горные породы, слагающие разрез нефтяных и газовых месторождений.
- •2.Механические свойства горных пород.
- •3.Классификация породоразрушающих инструментов.
- •1. Долото для бурения сплошным забоем и с отбором керна
- •Породоразрушающий инструмент для отбора керна
- •2. Снаряды для колонкового бурения.
- •3. Буровые долота специального назначения.
- •1. Буровые установки для глубокого бурения на нефть и газ, основные характеристики и классификация.
- •2. Приводы буровых установок.
- •1. Оборудование для вращательного бурения и спускоподъемных операций.
- •Параметры и комплектность циркуляционных систем
- •3. Противовыбросовое оборудование.
- •1. Особенности разработки морских месторождений нефти и газа.
- •2. Инженерно-геологические изыскания.
- •3. Искусственные острова.
- •1. Функций бурового раствора.
- •2. Требования к буровым растворам.
- •3. Типы и рецептуры буровых растворов.
- •1. Функция и режимы промывки скважин.
- •2. Требования к режиму промывки скважин.
- •3. Расчет режимов промывки скважин.
- •1. Система подготовки бурового раствора.
- •2. Регулирование содержания и состава твердой фазы в буровом растворе.
- •3. Средства контроля и управления процессом промывки скважин.
- •1. Понятие о режимах бурения его параметрах и показателях работ долот.
- •2. Влияния параметров режима бурения на механическую скорость проходка нового долота.
- •1. Влияния параметров режима бурения на износ долота и показатели его работы. Х
- •2. Специфические особенности режимов вращательного бурения. Х
- •3. Рациональная отработка долот.
- •1. Воздействие промывочной жидкости на продуктивный пласт.
- •2. Способы первичного вскрытия продуктивных пластов. Х
- •3. Технология опробования перспективных горизонтов.
- •2. Цели и способы крепления скважин.
- •3.Принципы проектирования конструкции скважины.
- •1. Обсадные трубы и их соединения. Условия работы обсадной колонны в скважине.
- •2. Принципы расчета обсадных колонн.
- •3 Задача и способы цементирования скважин.
- •1. Подготовка скважин к освоению.
- •2. Вторичное вскрытие продуктивного пласта перфорацией.
- •3. Виды перфорации и их эффективность.
- •1. Классификация осложнений.
- •2. Поглощение промывочной жидкости и тампонажного раствора.
- •1. Причины, виды аварий и меры по их предупреждению.
- •2 Ловильный инструмент и работа с ним.
- •1. Информационное обеспечение процесса бурения с применением компьютерной техники и спутниковой связи.
- •1.Приборы и аппаратура для контроля параметров режима бурения.
- •1. Телеметрические системы контроля забойных параметров.
- •1. Физические и тепловые свойства горных пород.
- •Тепловые свойства горных пород
- •Коэффициент линейного расширения пород уменьшается с ростом плотности минералов.
- •2. Состав и физические свойства природных газов и нефти.
- •1. Фазовое состояние углеводородных систем. Х
- •Фазовые переходы в нефти, воде и газе
- •2. Пластовые воды и их физические свойства.
- •3. Молекулярно-поверхностные свойства системы «нефть-газ вода порода».
- •Источники пластовой энергии
- •Силы, действующие в залежи
- •Поверхностные явления при фильтрации пластовых жидкостей и причины нарушения закона дарси
- •Общая схема вытеснения из пласта нефти водой и газом
- •Нефтеотдача пластов при различных условиях дренирования залежи
- •Роль капиллярных процессов при вытеснении нефти водой из пористых сред
- •Зависимость нефтеотдачи от скорости вытеснения нефти водой
- •1. Породы коллекторы, их фильтрационные свойства
- •Линейная фильтрация нефти и газа в пористой среде
- •1.. Нефте-, газо-, водонасыщенность коллекторов.
- •2. Пластовые нефти и газы.
- •1. Газоконденсаты и газогидраты.
- •1. Цели искусственного воздействия на пласт.
- •2. Методы воздействия на пласт с целью интенсификации добычи нефти.
- •1. Классификация способов воздействия на призабойную зону скважин.
- •С карбонатом:
- •Физико-химические методы воздействия на призабойную зону пласта
- •Тепловые методы воздействия на пласт
- •Механические методы воздействия на пласт
- •1. Стадии разработки месторождения.
- •2. Способы эксплуатации скважин.
- •1. Фонтанный способ эксплуатации
- •2. Условия фонтанирования и возможные методы его продления.
- •3. Погружные электроцентробежные насосные установки и их классификация
- •1. Фонтанная арматура.
- •2. Запорные устройства фонтанной арматуры.
- •1. Манифольд фонтанных скважин.
- •2. Состав оборудования при газлифтной эксплуатации скважин.
- •2. Станки качалки.
- •2. Учет продукции скважины
- •1. Промысловые трубопроводы.
- •2. Сепарация нефти.
- •1. Подготовка нефти на месторождениях.
- •2. Нефтяные резервуары.
- •1.Исследование скважин и обоснование технологического режима эксплуатации.
- •1. Сбор и подготовка газа на промысле
- •1. Сезонная и суточная неравномерность потребления газа.
- •2. Цели и преимущества подземного хранения газа.
- •2. Хранение газа в истощенных или частично выработанных газовых и газоконденсатных месторождениях.
- •1. Подземное хранение газа в водоносных структурах.
Фазовые переходы в нефти, воде и газе
Фазовые переходы подчиняются определённым закономерностям, в основе которых лежит понятие равновесия фаз. Равновесие фаз характеризуется константой равновесия, которая зависит от температуры и давления.
Константа фазового равновесия i-го компонента характеризуется отношением мольной доли компонента в газовой фазе (yiилиNyi) к мольной доле этого компонента в жидкой фазе (xiилиNxi), находящейся в равновесном состоянии с газовой фазой:
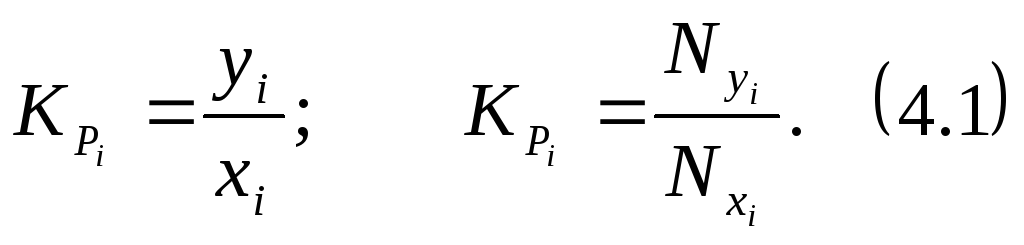
Для определения равновесного состояния газожидкостных смесей используются законы Дальтона и Рауля.
Согласно закону Дальтона каждый компонент, входящий в газовую фазу имеет своё парциальное давление Pi, а общее давление в газовой системе равно сумме парциальных давлений:
![]()
Согласно закону Рауля, парциальное давление компонента над жидкостью (нефтью) равно давлению насыщенного пара (Pнас. пара) или упругости пара (Qi) и этого компонента, умноженному на его мольную долю в нефти:
![]()
где Qi– упругость паров компонента;
Nxi– мольная доля компонента;
piнас. пара – давление насыщенного параi-го компонента.
В момент равновесия парциальное давление i-го компонента в газовой фазе равно парциальному давлению компонента над жидкостью. Отсюда следует закон Дальтона-Рауля для равновесного состояния газовой и нефтяной фазы:
![]()
![]()
где Ki– константа равновесияi-го компонента при данной температуре и давлении смеси.
Уравнение материального баланса для одного моля нефтегазовой смеси:
![]()
где L– мольная доля жидкой фазы;
V– мольная доля паровой фазы;
Nzi– мольные доли компонентов в нефтегазовой смеси.
По условию сумма мольной доли жидкой и паровой фаз равна единице. Отсюда:
![]()
Используя уравнения (4.6) и (4.7) получим выражение для мольной доли компонента жидкой фазы:
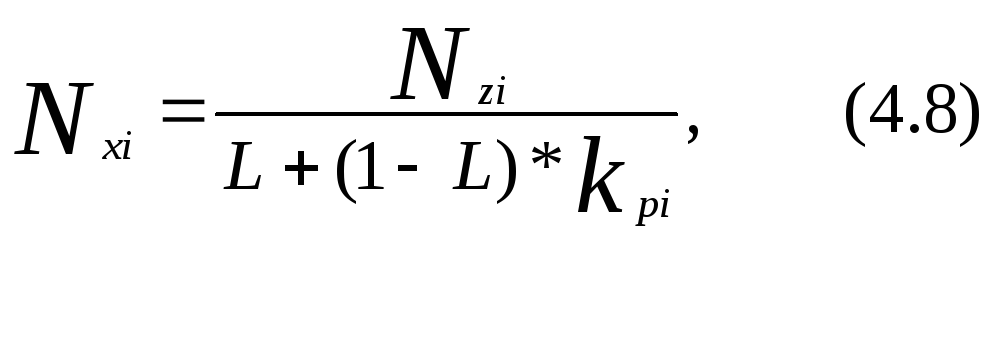
и для мольной доли компонента газовой фазы:
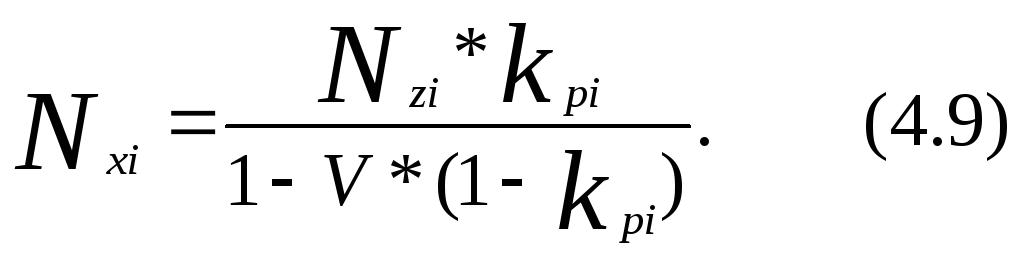
2. Пластовые воды и их физические свойства.
Пластовые воды оказывают весьма существенное влияние на качественные и количественные показатели работ при углублении ствола, креплении и цементировании нефтяных и газовых скважин. Пластовые воды — постоянные спутники нефтегазовых месторождений. Они играют большую роль в поисках, формировании и разработке залежей.
Вода различается по наличию растворенных в ней примесей и солей. По температуре воды делятся на холодные, теплые, горячие и очень горячие. Температура воды существенно влияет на количество содержащихся в ней солей и газов. По положению относительно нефтегазоносных горизонтов пластовую воду относят к краевой, подошвенной воде; она бывает верхней, нижней, погребенной (реликтовой), находящейся непосредственно в нефтяном пласте и остающейся неподвижной при движении нефти. Солевой состав вод в нефтяном пласте неодинаков для всех частей структуры.
При изучении пластовых вод для характеристики их свойств принято определять общую минерализацию воды и ее жесткость, содержание главных шести ионов, рН, плотность, запах, вкус, прозрачность, поверхностное натяжение, а также проводить анализ растворенных газов - бактериологический или микробиологический.
Общая минерализация воды выражается суммой содержащихся в ней химических элементов, их соединений и газов. Она оценивается по сухому (или плотному) остатку, который получается после выпаривания воды при температуре 105-110 °С. По размеру сухого остатка воды разделяются на пресные (содержание солей < 1 г/л), слабосолоноватые (1-5 г/л), солоноватые (5-10 г/л), соленые (10-50 г/л), рассолы (>50 г/л).
Главные химические компоненты в подземных водах: хлор - ион (С1-),
сульфат - ион (SO24- ), гидрокарбонатный и карбонатный ионы (НСО3-) и
(COg ), а также ионы щелочных и щелочноземельных металлов и оксидов:
натрия Na+, кальция Са2+, магния Мд2+, железа и SiO2 (в коллоидном состоянии). В воде растворяются азот, кислород, углекислый газ, сероводород и т.д. В настоящее время принята форма химического анализа воды - ионная. Так как молекулы солей в растворе распадаются на катионы и анионы, те и другие должны находиться в эквивалентных количествах. Для перевода результатов анализа воды, выраженных в ионной форме, в эквивалентную, следует количество каждого найденного элемента (в мг/л) разделить на его эквивалентную массу. Эквиваленты ионов могут быть выражены также в процентах от суммы анионов и катионов, каждая сумма анионов и катионов принимается за 50 или 100 %.
Для подземных вод нефтегазовых месторождений характерно повышенное содержание иода, брома, бора, аммония и вблизи нефтяной залежи — нафтеновых кислот. По химическому составу это обычно хлоридно-кальциево-натриевые рассолы с общей минерализацией 50 г/л и выше. Воды нефтяных месторождений бывают кислые и щелочные гидрокарбонат-но-натриевого и иногда хлоридно-сульфатно-натриевого состава.
При оценке подземных вод (для питания паровых котлов, хозяйственных целей и т.д.) следует обращать внимание на жесткость воды, под которой понимают свойство воды, обусловленное содержанием в ней солей кальция и магния: Ca(HCO3)2r Mg(HCO3)2r CaCO3, CaCl2, MgCl2. Различают жесткость общую, характеризующуюся присутствием солей Са и Мд, постоянную, обусловленную содержанием солей Са и Мд, за исключением бикарбонатов, и временную, определяемую наличием бикарбонатов Са и Мд. Временная жесткость воды может быть найдена по разности общей и постоянной. Кипяченая вода характеризуется только постоянной жесткостью. Природные воды по жесткости разделяются на следующие типы: очень мягкие, умеренно жесткие, жесткие и очень жесткие.
В основу классификации пластовых вод по Пальмеру положено соотношение в воде количеств ионов щелочных металлов К+ и Na+ (а), ионов щелочноземельных металлов Са2+ и Mg2+(fo) и анионов сильных кислот СГ (d).
В зависимости от преобладания тех или иных ионов в воде Пальмер разделяет все воды на пять классов:
I..................................................... d<a
II.................................................... d = a
III................................................... a<d<a ++ b
IV.................................................. d = a + b
V.................................................... d>a + b
Для характеристики качества воды используются шесть показателей: первичная соленость, первичная щелочность, вторичная соленость, вторичная щелочность, третичная соленость, третичная щелочность.
В соответствии с классификацией природных вод по В.А. Сулину, применяемой в нефтегазодобывающей промышленности, последние подразделяются на четыре генетических типа: I - сульфатно-натриевые; II -гидрокарбонатно-натриевые; III - хлормагниевые; IV - хлоркальциевые. Принадлежность воды к определенному генетическому типу устанавливается по отношению эквивалентов отдельных ионов. Каждый тип вод подразделяется на группы: А - гидрокарбонатные, Б - сульфатные, В - хлоридные. Группы, в свою очередь, подразделяются на классы и подгруппы. Воды относятся к определенной группе и подгруппе на основании отношения эквивалентов отдельных ионов.
В большинстве пластовых вод содержатся анионы и мыла нафтеновых и жирных кислот, фенолы и азотсодержащие кислоты.
