

Тема 4: Строение атома. Радиация
Содержание:
1)Опыт Резерфорда; ядерная модель атома;
2)Постулаты Бора;
3)Принцип Паули;
4)Квантово-механическое обоснование Периодического закона;
5)Радиоактивность;

1. Опыт Резерфорда. Ядерная модель атома
Резерфорд в 1911 г. предложил следующую схему строения атома, получившую название ядерной модели атома.
Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая масса атома, и вращающихся вокруг него электронов. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален.
Возникающая вследствие вращения электронов центробежная сила уравновешивается силой электростатического притяжения электронов к противоположно заряженному ядру.
Размеры ядра очень малы по сравнению с размерами атома в целом.
Эрнест
Резерфорд
(1871 - 1937)

2.Постулаты Бора
•Основные положения своей теории Бор сформулировал в виде постулатов в 1913
г.(утверждения, принимаемые без
доказательств):
1.Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам. Эти орбиты получили название стационарных.
2.Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
3.Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается
квант электромагнитного излучения, |
|
|
энергия которого равна разности энергии |
Нильс Бор |
|
атома в конечном и исходной состояниях. |
||
(1885 – 1962) |
||
|

3. Принцип Паули
(1925 г.).
1.В любом атоме не может быть двух одинаковых электронов, определяемых набором четырех квантовых чисел: главного n, орбитального l, магнитного m, магнитного спинового ms.
2.В состояниях с определенным значением могут находиться в атоме не более 2n2 электронов.
Значит на первой оболочке («орбите») могут находиться только 2 электрона, на второй – 8, на третьей -18 и т д.
Благодаря принципу Паули удалось теоретически обосновать периодическую систему элементов Д.И. Менделеева.
Вольфганг Паули (1900 - 1958)

4. Квантово-механическое |
|||
обоснование Периодического |
|||
закона. |
|
|
|
|
|
||
• В 1869 г. Д.И. Менделеев открыл |
|
|
|
периодический закон изменения |
|
|
|
химических и физически свойств |
|
|
|
элементов в зависимости от их атомных |
|
|
|
масс. |
|
|
|
• Он ввел понятие порядкового номера Z- |
|
|
|
элемента и получил полную |
|
|
|
периодичность в изменении химических |
|
|
|
свойств элементов. |
|
|
|
• Физический смысл порядкового номера Z- |
|
|
|
элемента установлен в ядерной модели |
|
|
|
атома Резерфорда: Z совпадает с числом |
|
|
|
положительных элементарных зарядов в |
|
|
|
ядре (протонов) и числом электронов в |
|
|
|
оболочках атомов. |
|
|
|
• Таким образом, периодичность в |
|
Д. И. Менделеев |
|
химических свойствах элементов |
|
||
(1834 - 1907) |
|||
объясняется повторяемостью в структуре |
|||
внешних оболочек у атомов родственных |
|
|
|
элементов. |
|
|
|
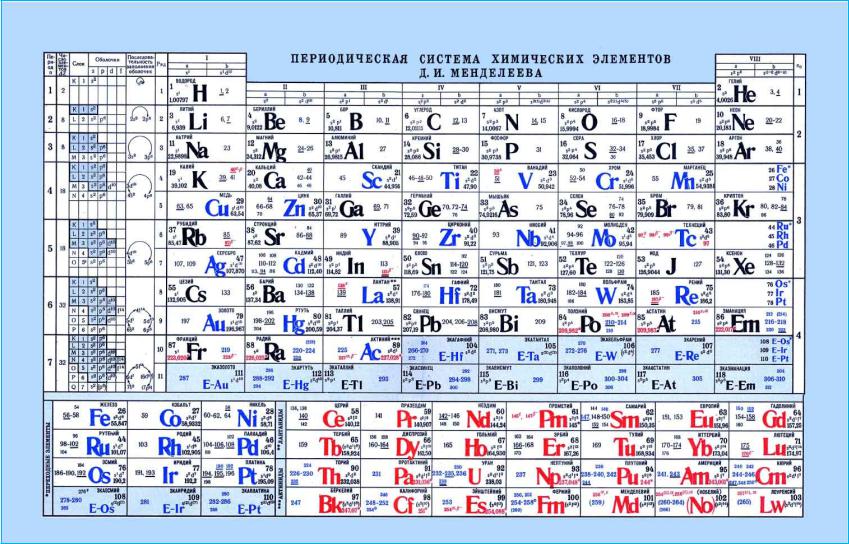
4.1 Периодическая таблица Д.И. Менделеева

5.Радиоактивность
•Радиоактивностью называется самопроизвольное преобразование одних ядер в другие.
•Спонтанный распад изотопов ядер в условиях природной среды называют естественной, а
вусловиях лабораторий в
результате деятельности человека – искусственной радиоактивностью.
• Естественную радиоактивность |
|
|
открыл французский физик Анри |
|
|
|
Анри Беккерель |
|
Беккерель в 1896 г. |
|
|
|
(1852-1908) |
|

5.1Радиоактивность
•Открытие и исследование явления радиоактивности связано с именами Марии и Пьера Кюри (1903г. присуждена Нобелевская премия по физике).
•Искусственная
радиоактивность открыта и исследована супругами Ирен и Фредериком Жолио-Кюри, которые в 1935 г. также получили Нобелевскую премию.
•Необходимо отметить, что принципиального различия между этими двумя типами радиоактивности нет.
