
- •Саратовский государственный технический университет
- •Определение коэффициента вязкости газов капиллярным методом
- •Основные теоретические положения
- •Экспериментальная установка и методика измерений
- •Определение отношения теплоемкостей воздуха при постоянном давлении и объеме резонансным методом
- •Основные теоретические положения
- •Экспериментальная установка и методика измерений
- •Обработка результатов эксперимента и расчет погрешностей
- •Лабораторная работа 3
- •Определение теплоемкости твердых тел
- •Цель работы: определение теплоемкости металлов калориметрическим методом с использованием электрического нагрева, проверка закона Дюлонга и Пти.
- •Основные теоретические положения
- •Экспериментальная установка и методика измерений
- •Обработка результатов эксперимента и расчет погрешностей
- •Лабораторная работа 4
- •Экспериментальная установка и методика измерений
- •Обработка результатов эксперимента и расчет погрешностей
- •Лабораторная работа 5 определение молярной массы и плотности газа методом откачки
- •Основные теоретические положения
- •Экспериментальная установка и методика измерений
- •Обработка результатов эксперимента и расчет погрешностей
- •Литература
- •Основные методики расчета погрешностей
- •1. Вычисление случайной погрешности прямых измерений
- •3. Метод наименьших квадратов
- •4. Вычисление полной погрешности измерений
Экспериментальная установка и методика измерений
Молярную
массу газа можно определить из уравнения
газового состояния (5.5). Однако, если
измерение объема V,
давления
![]() ,
температуры Т газа не вызывает особых
трудностей, то определение массы газа
выполнить практически невозможно, так
как взвешивание на весах газа возможно
только вместе с колбой, в которой он
находится. Поэтому для определения μ
необходимо исключить массу сосуда. Это
можно сделать, рассмотрев уравнение
состояния (5.5) двух масс
,
температуры Т газа не вызывает особых
трудностей, то определение массы газа
выполнить практически невозможно, так
как взвешивание на весах газа возможно
только вместе с колбой, в которой он
находится. Поэтому для определения μ
необходимо исключить массу сосуда. Это
можно сделать, рассмотрев уравнение
состояния (5.5) двух масс![]() и
и![]() одного и того же газа при неизменных
температуре Т и объемеV.
одного и того же газа при неизменных
температуре Т и объемеV.
Пусть
в колбе объемом V
находится газ массой
![]() при давлении
при давлении![]() и температуре Т. Уравнение состояния
для этого газа имеет вид:
и температуре Т. Уравнение состояния
для этого газа имеет вид:
![]() .
(5.9)
.
(5.9)
Откачаем
часть газа из колбы, не изменяя его
температуры. После откачки масса газа,
что оставалась в колбе, и его давление
уменьшились. Обозначим их соответственно
![]() и
и![]() и снова запишем уравнение состояния:
и снова запишем уравнение состояния:
![]() .
(5.10)
.
(5.10)
Вычитая из уравнения (5.9) уравнение (5.10), получим:
![]() .
(5.11)
.
(5.11)
Отсюда для определения молярной массы, получим:
![]() .
(5.12)
.
(5.12)
Формула (5.12) дает возможность определить молярную массу, если известно изменение массы газа (но не сама масса), а также изменение давления, температура и объем газа.
В
данной работе исследуемым газом является
воздух, который представляет собой
смесь азота, кислорода, аргона и других
газов. Формула (5.12) пригодна и для
определения μ смеси газов. Найденное в
этом случае значение μ представляет
собой некоторую среднюю или эффективную
молярную массу смеси газов. Молярная
масса смеси газов может быть рассчитана
и теоретически, если известно процентное
содержание и молярная масса каждого из
газов, входящих в состав смеси, по
формуле:  ,
(5.13)
,
(5.13)
где
![]() – относительное содержание каждого
газа; μ1,
μ2,
… μn
– молярные массы газов.
– относительное содержание каждого
газа; μ1,
μ2,
… μn
– молярные массы газов.
Если
известна молярная масса газа, то можно
легко определить еще одну важную
характеристику газа: его плотность.
Плотность газа
– это масса единицы объема газа:
![]() ,
или
,
или
![]() .
(5.14)
.
(5.14)
Плотность смеси газов можно вычислить по формуле (5.14), подразумевая под μ эффективную молярную массу смеси.
Для определения молекулярной массы воздуха предназначена экспериментальная установка, общий вид которой показан на рис. 5.4.




















0,19645

Рис. 5.4. Установка для определения молярной массы:
1 – весы, 2 – колба, 3 – кран, 4 – вакуумметр, 5 – компрессор
Рабочим
элементом установки является колба 2,
соединенная со стрелочным вакуумметром
4, показания которого
![]() есть разность между атмосферным давлением
в лаборатории и давлением газа в колбе
есть разность между атмосферным давлением
в лаборатории и давлением газа в колбе![]() .
Колба имеет отросток с краном 3, который
с помощью резиновой трубки соединяется
с входным патрубком компрессора 5. Колба
установлена на тарелке электронных
весов 1. Значение объема колбы указано
на рабочем месте.
.
Колба имеет отросток с краном 3, который
с помощью резиновой трубки соединяется
с входным патрубком компрессора 5. Колба
установлена на тарелке электронных
весов 1. Значение объема колбы указано
на рабочем месте.
Эксперимент осуществляется в следующем порядке.
Подайте напряжение питания на электронные весы, включив установку тумблером «Сеть».
С помощью электронных весов определите массу колбы с воздухом
 при атмосферном давлении
при атмосферном давлении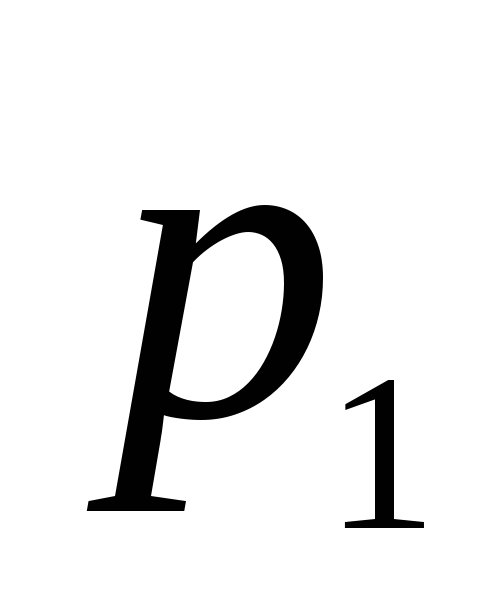 .
.Включив компрессор тумблером «Пуск» и открыв кран, откачайте воздух из колбы до давления
 ,
при этом манометр будет показывать
разность между атмосферным давлением
,
при этом манометр будет показывать
разность между атмосферным давлением и давлением воздуха в колбе:
и давлением воздуха в колбе: .
Запишите показания манометра
.
Запишите показания манометра .
.Закрыв кран и выключив компрессор, определите с помощью весов массу колбы с воздухом
 при давлении
при давлении .
.Повторите измерения пп. 3-4 не менее 5 раз.
Измерьте температуру воздуха в лаборатории.
Выключите установку тумблером «Сеть».
