- •1. Понятие о катаболизме и анаболизме. Общая схема катаболизма углеводов, жиров и белков, общий и специфические пути распада.
- •Общая схема катаболизма углеводов, жиров и белков
- •2. Особенности ферментативного катализа. Зависимость скорости ферментативных реакций от температуры рH среды, количества фермента и концентрации субстрата. Константа Михаэлиса.
- •1) Влияние температуры:
- •2) Влияние pH:
- •3) Зависимость от количества фермента:
- •4) Зависимость от концентрации субстрата:
- •5) Константа Михаэлиса:
- •График соотношения констант
- •3. Активный центр и механизм действия ферментов. Специфичность действия ферментов.
- •4. Классификация ферментов, примеры ферментативных реакций каждого класса.
- •5. Кофакторы ферментов и их роль в катализе. Витамины – как предшественники коферментов.
- •6. Ингибирование ферментов: виды, характеристика, примеры. Использование ингибиторов в качестве лекарственных препаратов.
- •Обратимое ингибирование:
- •Конкурентное ингибирование:
- •Неконкурентное ингибирование:
- •Необратимое ингибирование:
- •Особенности строения и функционирования олигомерных белков. Аллостерические ферменты.
- •Строение гема, входящего в состав миоглобина и гемоглобина
- •Аллостерические ферменты
- •8. Аллостерические регуляция активности. Примеры метаболических путей, регулируемых аллостерическими ферментами.
- •Аллостерическая регуляция метаболизма жирных кислот в печени
- •Основные особенности метаболизма в печени в состоянии приема пищи. Аллостерическая регуляция ферментов
- •9. Регуляция активности ферментов: фосфорилирование – дефосфорилирование, роль протеинкиназ и протеинфосфатаз. Примеры метаболических путей, регулируемых такими способами.
- •Механизм фосфорилирования/дефосфорилирования ферментов
- •Механизм фосфорилирования/дефосфорилирования ферментов
- •10. Регуляция активности ферментов: частичный протеолиз, значение в переваривании белков и свертывании крови.
- •Регуляция путем частичного протеолиза.
- •Изоферменты.
- •Распределение и относительное кол-во изоферментов лдг в различных тканях
- •Энзимопатии.
- •Энзимотерапия.
- •Использование ферментов в медицине
- •Характеристика пируватдегидрогеназного комплекса.
- •13. Цикл трикарбоновых кислот (цитратный цикл): последовательность реакций, связь с цпэ, регуляция, биологическая роль.
- •14. Основные пути фосфорилирования адф и использования атф. Цикл адф-фтф.
- •Образование гтф, утф
- •15. Структурная организация дыхательной цепи переноса электронов (цпэ) в митохондриях: ферментные ансамбли, их последовательность расположения.
- •16. Окислительное фосфорилирование в митохондриях. Теория Митчелла. Условия синтеза атф. Коэффициент фосфорилирования р/о.
- •17. Регуляция тканевого дыхания. Дыхательный контроль. Ингибиторы и разобщители тканевого дыхания, примеры.
- •18. Углеводы пищи: структура, переваривание. Механизм трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •Основные углеводы пищи
- •Общая схема переваривания углеводов в жкт
- •19. Аэробный гликолиз: последовательность реакций, энергетический эффект, физиологическое значение.
- •Аэробный гликолиз
- •Расход атф
- •Регуляция пируваткиназы в печени
- •20. Анаэробный гликолиз последовательность реакций, энергетический эффект, физиологическое значение.
- •Глицерофосфатный челночный механизм
- •21. Глюконеогенез из молочной кислоты (схема процесса). Глюкозолактатный цикл. Биологическое значение.
- •22. Глюкозонеогенез из аминокислот и глицерина (схема процесса). Глюкозолактатный цикл. Биологическое значение.
- •Примеры вовлечения аминокислот в глюконеогенез
- •Реакции синтеза глюкозы из глицерина
- •23. Регуляция гликолиза и глюконеогенеза в печени.
- •Регуляция процессов гликолиза и глюконеогенеза
- •24. Строение, свойства и биологическая роль гликогена. Биосинтез и мобилизация гликогена, зависимость от ритма питания, гормональная регуляция.
- •Образование удф-глюкозы
- •Химизм реакции гликогенсинтазы
- •Реакция, осуществляемая гликогенфосфорилазой
- •Общая схема реакций расщепления гликогена
- •Активность основных ферментов обмена гликогена в зависимости от условий (промежуточные метаболиты и другие ферменты не показаны)
- •Аденилатциклазный механизм активации фосфорилазы
- •25. Пентозофасфатный путь превращения глюкозы: окислительные реакции, представление о неокислительном пути синтеза пентоз, распространение, физиологическое значение.
- •26. Переваривание и всасывание пищевых жиров. Ресинтез жиров в клетках кишечника, транспорт кровью, усвоение тканями. Роль желчи при переваривании и всасывании липидов.
- •Регуляция
- •28. Биосинтез жирных кислот: последовательность реакций, регуляция, зависимость от ритма питания, биологическая роль.
- •Синтез пальмитиновой кислоты
- •Этапы синтеза пальмитиновой кислоты
- •29. Синтез жиров из углеводов в печени и жировой ткани, биологическая роль, гормональная регуляция.
- •30. Мобилизация жиров из жировой ткани, биологическая роль, гормональная регуляция.
- •31. Синтез и использование кетоновых тел: последовательность реакций, биологическое значения, схема обмена. Причины и последствия кетонемии.
- •Строение кетоновых тел
- •Синтез кетоновых тел
- •32. Холестерол: строение, функции, баланс в организме, синтез (последовательность реакций до мевалоновой кислоты), регуляция синтеза.
- •Холестерол
- •Реакции синтеза мевалоновой кислоты
- •33. Гиперхолестеролемия: причины, последствия. Биохимические основы патогенеза атеросклероза и основные подходы к лечению.
- •34. Желчные кислоты: особенности строения, функции, синтез, энтерогепатическая циркуляция. Желчно-каменная болезнь.
- •Синтез первичных желчных кислот
- •Конъюгация желчных кислот с глицином и таурином на примере холевой кислоты
- •Регуляция синтеза желчных кислот в печени
- •Образование вторичных жирных кислот в кишечнике
- •Энтерогепатическая циркуляция желчных кислот
- •35. Хиломикроны (хм): образование, состав, функции, схема обмена. Гиперхиломикронемия.
- •Транспорт экзогенных и эндогенных триацилглицеролов
- •36. Липопротеины очень низкой плотности (лпонп): образование, состав, функции, схема обмена. Гипертриглицеролемии.
- •37. Липопротеины низкой плотности (лпон): образование, состав, функции, схема обмена. Гиперхолестеринемия.
- •Липиды и липидный транспорт
- •Положение рецептора лпнп в норме и при нарушении его структуры
- •38. Липопротеины выской плотности (лпвп): образование, состав, функции, схема обмена. Роль лхат.
- •Образование липопротеинов высокой плотности зрелых (лпвПз)
- •Метаболизм лпвп
- •39. Полноценные и неполноценные белки. Значение полноценного белкового питания для человека. Схема переваривания белков в желудочно-кишечном тракте: ферменты, их активация, биологическое значение.
- •40. Трансаминирование аминокислот: ферменты, роль витамина в6 в реакциях трансаминирования, биологическое значение процесса. Диагностическое значение определения активности трансаминаз.
- •41. Дезаминирование аминокислот: типы, роль глутаматдегидрогеназы в реакциях, дезаминирования. Биологическое значение.
- •42. Пути обмена безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Глюконеогенез из аминокислот, значение процесса.
- •43. Декарбоксилирование аминокислот (глу, три) в тканях. Обезвреживание биогенных аминов в печени с участием ферментов мао и дао.
- •44. Пути образования и обезвреживания аммиака в тканях. Токсичность аммиака. Гипераммониемии: причины и следствия.
- •45. Биосинтез мочевины: схема процесса, биологическое значение.
- •46. Гниение белков в толстом кишечнике и обезвреживание продуктов гниения в печени с участием удфгк и фафс.
- •Реакции превращения ароматических аминокислот в толстом кишечнике
- •Реакции превращения лизина и аргинина в толстом кишечнике
- •Строение активных форм глюкуроновой и серной кислот
- •47. Синтез катехоламинов: роль витамина в6 и метионина. Катаболизм катехоламинов. Роль s-аденозилметионина в реакциях метилирования.
- •Реакции синтеза катехоламинов
- •Синтез и регуляция секреции катехоламинов
- •Катаболизм катехоламинов
- •48. Распад фенилаланина и тирозина в разных тканях: схема процессов. Фенилкетонурия, альбинизм, алкаптонурия.
- •Реакция превращения фенилаланина в тирозин
- •49. Аденилатциклазная система передачи сигналов в клетки, роль g-белков в механизме трансдукции сигнала, вторичные посредники.
- •Упрощенная схема аденилатциклазного механизма действия гормонов
- •Инозитолфосфатная система
- •52. Адреналин: строение, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на метаболизм в тканях-мишенях.
- •Реакции синтеза котехоламинов
- •Регуляция секреции катехоламинов
- •53. Глюкагон: химическая природа, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на метаболизм в тканях-мишенях.
- •54. Инсулин: химическая природа, этапы биосинтеза, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на метаболизм в тканях-мишениях.
- •Структура проинсулина (справа) и инсулина (слева)
- •Активация рецептора инсулина - тирозиновой протеинкиназы
- •Общее представление о двух механизмах действия инсулина
- •Обмен углеводов
- •Обмен липидов
- •Обмен белков
- •55. Кортизол: строение, этапы биосинтеза, регуляция секреции, механизм передачи сигнала, влияние на метаболизм в тканях-мишенях.
- •Внутриклеточная локализация синтеза кортизола.
- •Строение глюкокортикоидов
- •56. Инсулин зависимый и инсулин независимый сахарный диабет: изменения гормонального статуса, метаболизма веществ и лабораторная диагностика.
- •Этиология инсулин-зависимого сд
- •Этиология инсулин-незвависимого сд
- •График изменения концентрации глюкозы
- •Типы гликемических кривых после нагрузки глюкозой
- •Структура тироксина и трийодтиронина
- •Регуляция секреции йодтиронинов
- •58. Вазопрессин: химическая природа, регуляция секреции, механизм передачи сигнала, влияние на метаболизм в клетках-мишенях. Несахарный диабет.
- •Структура вазопрессина
- •59. Альдостерон: химическая природа, синтез, регуляция секреции, механизм передачи сигнала, влияние на метаболизм в клетках-мишенях.
- •Структура альдостерона
- •60. Ренин-ангиотензин-альдостероновая система (раас): схема, биологическое значение. Биохимические основы использования ингибиторов апф при лечении почечной гипертонии.
- •Механизм дейсвтия ренин-ангиотензин-альдостероновой системы
- •61. Паратгормон: химическая природа, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на обмен ионов кальция и фосфатов.
- •62. Кальцитонин: химическая природа, регуляция секреции, ткани-мишени, механизм передачи сигнала, вляиние на обмен ионов кальция и фосфатов.
- •63. Кальцитриол: строение, биосинтез, механизм передачи сигнала, влияние на обмен кальция и фосфатов. Витамин д3 - предшественник кальцитриола, основные источника.
- •Ферменты и очередность синтеза
- •Структуры
- •64. Проявление гиповитаминоза, причины рахита.
- •65. Особенности метаболизма веществ в почках. Механизм образования мочи: клубочковая фильтрация, реабсорбция и секреция.
- •Фильтрационный (гематонефротический) барьер
- •Основные системы транспорта в проксимальном канальце нефрона.
- •66. Общие свойства и химический состав мочи в норме и при патологии. Коэффициент очищения крови (клиренс): понятие, виды.
- •67. Механизмы поддержания кос почками.
- •69. Гемоглобин: строение, виды, функции, регуляция сродства к кислороду (эффект Бора, влияние 2,3-дифосфоглицерата).
- •Структура гемоглобина
- •Структура гемоглобина а
- •70. Биосинтез гемма и гемоглобина: локализация, субстраты, ферменты, этапы, регуляция. Нарушение синтеза гема – порфирии. Анемии.
- •71. Обмен железа: всасывание, транспорт, депонирование, биороль. Нарушения обмена железа в организме человека.
- •Регуляция всасывания железа в кишечнике
- •Участие трансферритинового рецептора в транспорте железа в клетки
- •Причины железодефицитной анемии
- •72. Особенности метаболизма веществ в эритроцитах: механизмы сро и антиоксидантная защита в эритроцитах (аоз).
- •74. Противосвертывающие системы крови: антитромбиновая и фибринолитическая.
- •Регуляция ферментов фибринолиза
- •75. Механизм обезвреживания токсических веществ в печени: микросомальное окисление, реакции конъюгации.
- •76. Распад гема, образование и обезвреживание билирубина. «Прямой» и «Непрямой» билирубин.
- •Распад гемоглобина
- •Строение неконъюгированного билирубина
- •Обезвреживание билирубина в печени
- •Диглюкуронид билирубина
- •Отличия прямого и непрямого билирубина
- •77. Желтуха: классификация, причины, клиническая лабораторная диагностика.
- •78. Структурная организация межклеточного матрикса: состав, особенности строения. Структурные белки (коллаген, эластин, фибронектин, ламинин): особенности строения, функции.
- •Строение молекулы тропоколлагена
- •Строение препро-альфа-цепей коллагена
- •Углеводные компоненты коллагена
- •Дезаминирование остатков лизина в коллагене и образование межмолекулярных сшивок
- •Агрегация фибрилл и образование коллагенового волокна
- •Действие тканевой коллагеназы
- •80. Биохимические механизмы мышечного сокращения и расслабления. Роль градиента одновалентных ионов и ионов кальция в регуляции мышечного сокращения.
- •Цикл работы «головки» миозина
- •81. Особенности сокращения гладких мышц. Биохимическая диагностика инфаркта миокарда.
- •82. Особенности энергетического обмена быстро- и медленно сокращающихся миофибрилл. Особенности метаболизма веществ в скелетных мышцах и миокарде. Судьба лактата в сердечной и скелетной мышцах.
- •84. Витамины: определение, классификация, общая характеристика, роль в организме. Обмен витаминов в организме человека. Возможные пути развития эндогенной витаминной недостаточности.
- •85. Витамин а.
- •Строение ретиноидов (слева) и бета-каротина (справа)
- •Механизм участия ретиноевой кислоты в регуляции роста, деления и дифференцировки клеток
- •Фотохимический акт зрения
- •86. Витамин е.
- •Строение альфа-токоферола
- •87. Витамин в1.
- •Строение тиамина (слева) и тиаминдифосфата (справа)
- •Пример реакции с участием тиаминдифосфата
- •88. Витамин в6.
- •Строение пиридоксина и его коферментных форм
- •Пример реакции с участием пиридоксальфосфата
- •89. Витамин рр.
- •Строение витамина рр и его коферментных форм
- •Механизм участия над и надф в биохимических реакциях
- •Пример реакции с участием над
- •90. Витамин с.
- •Строение витамина с
- •Механизм участия витамина с в биохимических реакциях
- •Пример реакции с участием аскорбиновой кислоты
- •91. Схема переваривания нуклеопротеинов в жкт.
- •Реакции расщепления нуклеиновых кислот в жкт
- •92. Синтез пуриновых нуклеотидов: схема, ферменты, регуляция, запасные пути синтеза.
- •93. Распад пуриновых нуклеотидов: схема, ферменты. Нарушение обмена пуриновых нуклеотидов.
- •94. Биосинтез пиримидиновых нуклеотидов: схема, ферменты, регуляция, нарушения.
- •Синтез пиримидиновых нуклеотидов
- •Восстановление рибонуклеозиддифосфатов в дезоксипроизводные
- •Ферменты синтеза нуклеотидов как мишени действия противовирусных и противоопухолевых препаратов
- •95. Распад пиримидиновых нуклеотидов: схема, ферменты.
- •Распад пиримидиновых нуклеотидов
- •96. Репликация – синтез днк: матрица, затравка, субстраты, кофактор, ферменты и белки репликации.
- •Ферменты репликации эукариот и их функция
- •97. Транскрипция – синтез рнк: субстраты, этапы, факторы транскрипции, ферменты. Транскриптоны.
- •98. Трансляция – биосинтез белков: основные этапы функционирования белоксинтезирующей системы: активация аминокислот – синтез аминоацил-тРнк: инициация, элонгация, терминация.
- •99. Репарация ошибок и повреждений днк: этапы, биологическое значение.
- •100. Атеросклероз: определение, факторы риска, интегральная модель развития атеросклероза, «Порочный круг» в циркуляции хс и липопротеинов, биохимические основы профилактики и лечения.
- •Механизм развития атеросклероза
- •Гиперхолестеролемия
- •101. Биохимические изменения при панкреатитах: причина, механизмы развития, биохимическая диагностика. Биохимические аспекты лечения и профилактики панкреатитов.
- •Патогенез острого панкреатита
- •102. Перекисное окисление липидов (пол): субстраты, продукты пол, стадии, механизмы повреждающего действия (перекисная гипотеза гибели клеток).
- •103. Ферментативная и неферментативная антиоксидантные системы (аос) организма.
- •По природе и действию:
- •104. Молекулярные механизмы клеточной гибели: внешний, внутренний и перфорин-гранзимный пути реализации клеточной гибели. Нарушения апоптоза.
- •Общая схема молекулярных механизмов клеточной гибели
- •1 Стадия инициации: информационные сигналы рецептируются клеткой. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными.
- •Стадии апоптоза
- •Механизм апоптоза
- •Стадии апоптоза
- •Распознавание клеток-мишеней клетками ctl/nk-клетками
- •Локализация действия гранзимов
- •105. Канцерогенез: основные теории канцерогенеза, биохимические изменения в опухолевых клетках, онкомаркеры.
- •Усилением:
- •Ослаблением:
Образование удф-глюкозы
Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4-глюкозы на концевом участке гликогена.
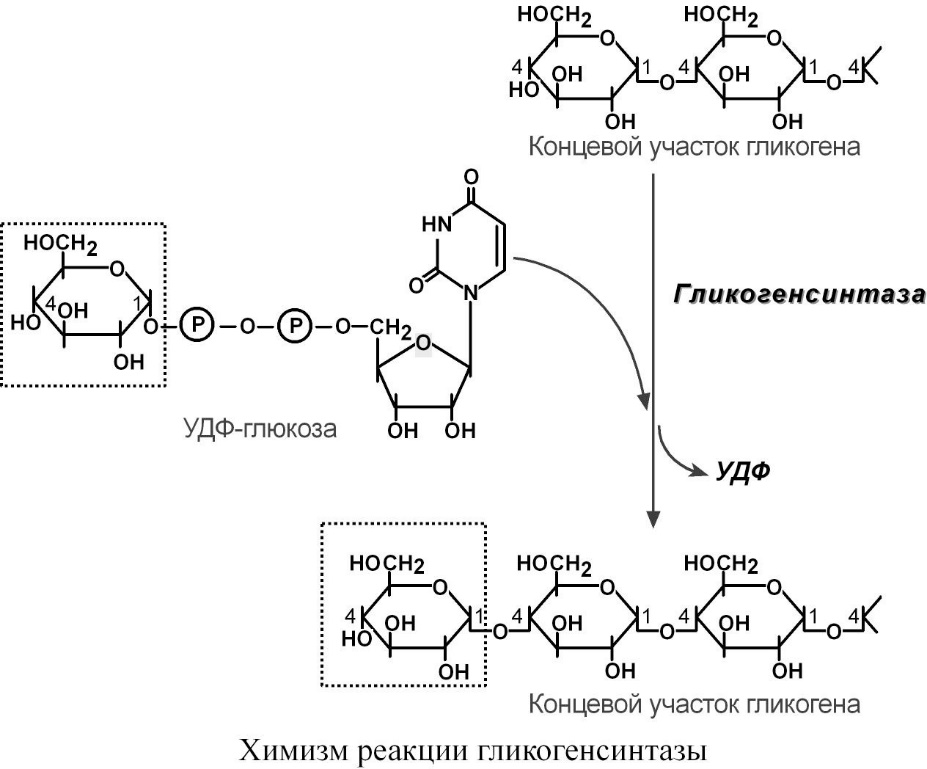
Химизм реакции гликогенсинтазы
Амило-α1,4-α1,6-гликозилтрансфераза, "гликоген-ветвящий" фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи.
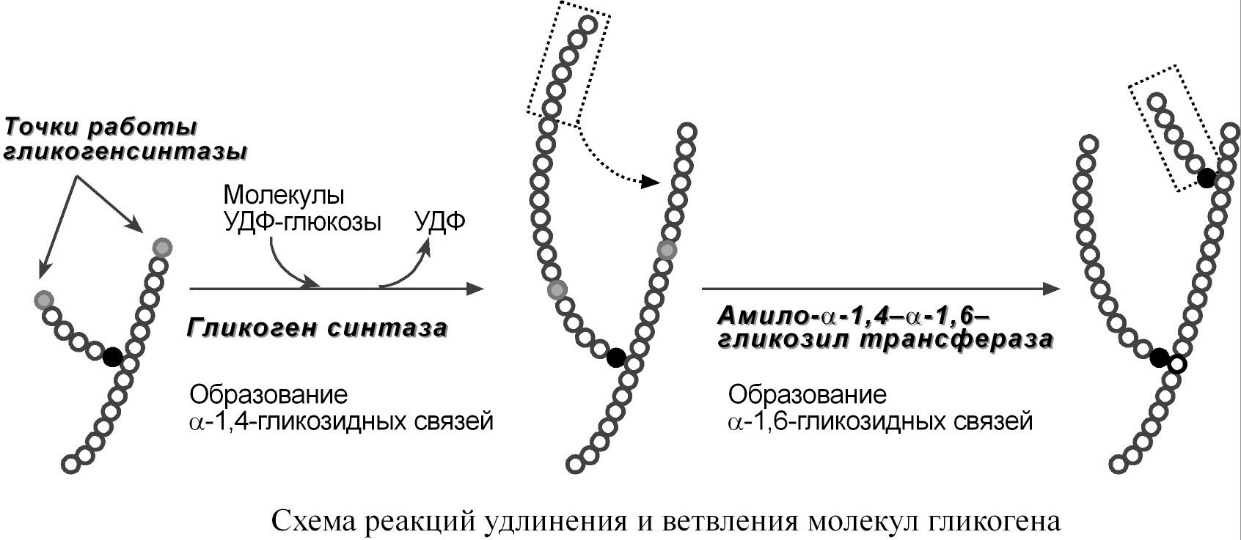
Схема реакций удлинения и ветвления молекул гликогена
МОБИЛИЗАЦИЯ ГЛИКОГЕНА
Мобилизация гликогена (гликогенолиз) в тканях активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови "целенаправленно" поддерживает только печень, в которой имеется глю-козо-6-фосфатаза, гидролизующая фосфатный эфир глюкозы. Образуемая при этом свободная глюкоза выходит через плазматическую мембрану в кровь. Остальные органы используют гликоген только для собственных нужд.
В гликогенолизе непосредственно участвуют три фермента:
Фосфорилаза гликогена (кофермент пиридоксальфосфат) – расщепляет α1,4-гликозидные связи с образованием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления α-(1-6) не останется 4 остатка глюкозы.

Реакция, осуществляемая гликогенфосфорилазой
α(1-4)-α(1-4)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и "открытая" доступная α1,6-гликозидная связь.
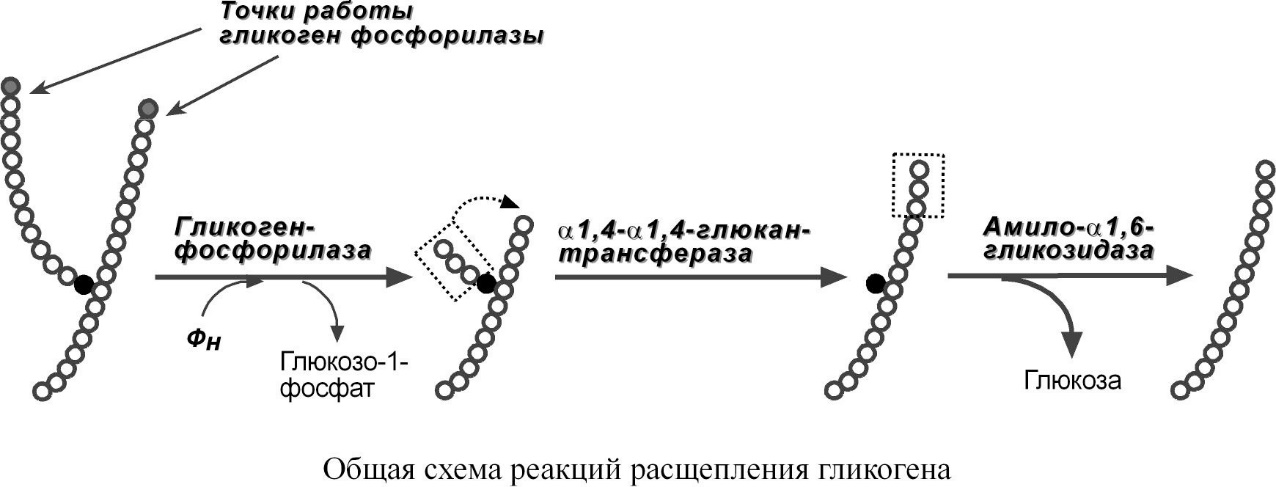
Общая схема реакций расщепления гликогена
Амило-α1,6-глюкозидаза, "деветвящий" фермент – гидролизует α1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, служащая субстратом для фосфорилазы.
РЕГУЛЯЦИЯ ОБМЕНА ГЛИКОГЕНА
Метаболизм гликогена в печени регулируется несколькими гормонами, одни из которых активируют ферменты синтеза гликогена, а другие – ферменты распада гликогена. Основные ферменты метаболизма гликогена активны либо в фосфорилированной, либо в дефосфорилированной форме.
Присоединение фосфатов к ферментам производят протеинкиназы, источником фосфата является АТФ:
фосфорилаза гликогена активируется после присоединения фосфатной группы,
синтаза гликогена после присоединения фосфата инактивируется.
Фосфорилирование указанных ферментов начинается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз, активируя фосфорилазу гликогена.
Дефосфорилирование этих ферментов осуществляют протеинфосфатазы. Активатором протеинфосфатаз, через сложный внутриклеточный механизм передачи сигнала, выступает инсулин. Таким способом инсулин запускает синтез гликогена за счет быстрой активации гликогенсинтазы и инактивации гликогенфосфорилазы.
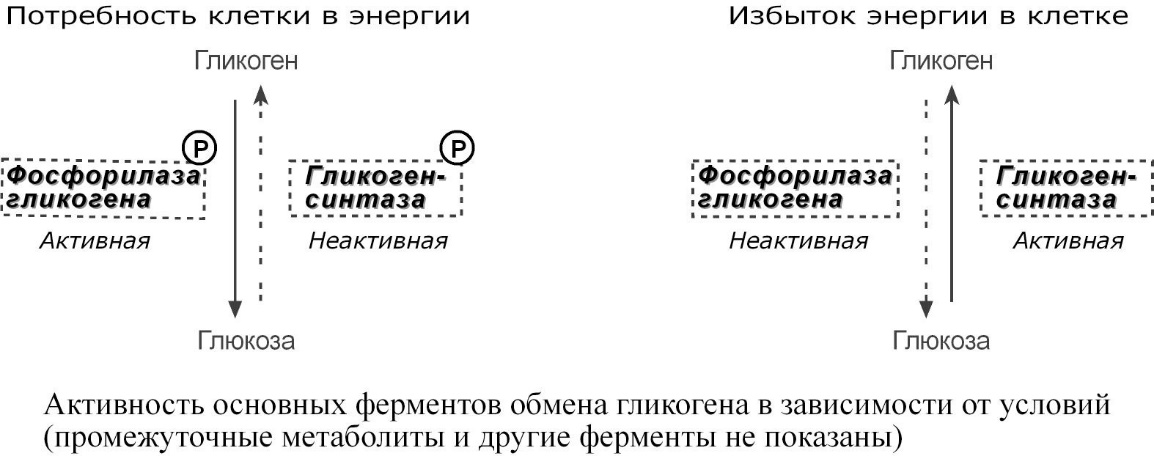
Активность основных ферментов обмена гликогена в зависимости от условий (промежуточные метаболиты и другие ферменты не показаны)
Одновременно инсулин и глюкокортикоиды увеличивают синтез гликогена, увеличи вая количество молекул гликогенсинтазы.
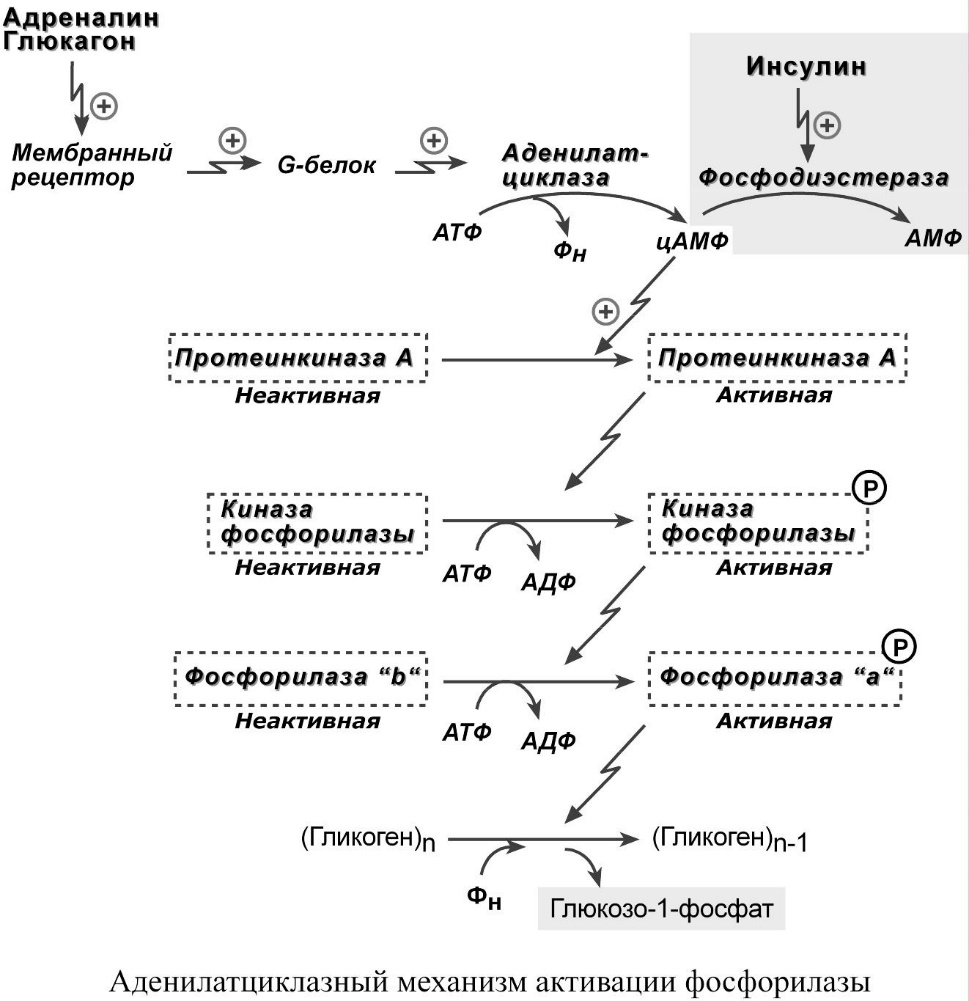
Для регуляции активности фосфорилазы и синтазы гликогена используется особый каскадный аденилатциклазный механизм.
АКТИВАЦИЯ ФОСФОРИЛАЗЫ ГЛИКОГЕНА
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами:
ковалентная модификация,
кальций-зависимая активация,
аллостерическая активация с помощью АМФ.
Ковалентная модификация
При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм, который является так называемым каскадным регулированием. Последовательность событий в данном механизме включает:
Молекула гормона (адреналин, глюкагон) взаимодействует со своим рецептором;
Активный гормон-рецепторный комплекс воздействует на мембранный G-белок;
G-белок активирует фермент аденилатциклазу;
Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный посредник (мессенджер);
цАМФ аллостерически активирует фермент протеинкиназу А;
Протеинкиназа А фосфорилирует различные внутриклеточные белки. Одним из этих белков является синтаза гликогена, ее активность угнетается, другим белком – киназа фосфорилазы, которая при фосфорилировании активируется;
Киназа фосфорилазы фосфорилирует фосфорилазу "b" гликогена, последняя в результате превращается в активную фосфорилазу "а";