
pdf / реплик
.pdf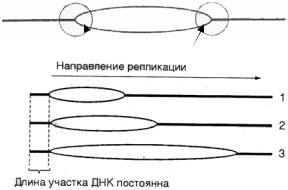
РЕПЛИКАЦИЯ – процесс образования идентичных двух копий ДНК для передачи генетической информации в
поколенияхклетокиорганизмов, осуществляемыйкомплексомферментовибелков. ТримеханизмаудвоенияДНК: полуконсервативный, консервативный, мозаичный.
Принципырепликации
1. Полуконсервативность
В 1958 г. Мэтью Мезельсон и Франклин Сталь с помощью метода равновесной седиментации в градиенте плотности доказали, что репликация в клетке проходит полуконсервативно, т.е. две дочерние молекулы ДНК состоят из одной родительскойиоднойдочернейцепи. ИсследователидолговыращиваликлеткибактерииE. coli впитательнойсреде, содержащей радиоактивный азот (15NH4Cl), следовательно, весь азот в ДНК был «тяжёлый». Далее перенесли клеткибактериивсредусобычным«лёгким» азотомипозволилиодинразреплицироваться. ДНКцентрифугировали в градиенте плотности CsCl2 и под действием центробежной силы молекулы переходят в ту область градиента, в которой плотность раствора равна их плавучей плотности. «Тяжёлая» и «лёгкая» ДНК в градиенте плотности CsCl2 очень хорошо разделяются. Однако в результате одной репликации был получен только один вид ДНК с плотностью, равнойсреднеарифметическомузначениюплотности«тяжёлой» и«лёгкой» ДНК. Послевторогоакта репликации были получены гибридная и «легкая» ДНК, следовательно, дочерние молекулы ДНК содержат одну родительскуюиоднуновуюдочернююцепи.
2.Комплементарность напротив A в одной цепи ДНК всегда стоит T в другой цепи, а напротив Г – Ц. Именно на этом принципе основан процесс репликации, при котором двойная спираль ДНК расплетается, а далее для каждой цеписпомощьюрепликативноймашинысинтезируетсяноваяпарнаядочерняяцепь.
3.Антипараллельность. ЭтидвапринципавытекаютизстроениямолекулыДНК.
4.Униполярность. Синтез, ростновойцепиДНКвсегдапротекаетвнаправлении5’→3’.
5.Потребностьвзатравке, которойявляетсянебольшойфрагментРНК.
6.Прерывистость.
Правиларепликации:
1)весьгеномреплицируетсяодинраззаклеточныйцикл;
2)инициация репликации влечет деление клетки после её завершения, т.е. завершение репликации – сигнал для
клеточногоделения.
Репликон– единица генома, вкоторой содержатся: точка начала репликации (origin) – точка ori – последовательность ДНК, в которой инициируется процесс удвоения ДНК, и точка окончания репликации (terminus) – сегмент ДНК, в которомпроцессудвоенияДНКостанавливается.
Репликация контролируется на стадии инициации, начавшись – не останавливается и заканчивается после удвоения всего репликона. Скорость репликации генома регулируется частотой инициирующих событий: взаимодействиясori регуляторныхбелков.
Бактериальная ДНК содержит 1 репликон, следовательно, 1 точку ori. У Escherichia coli скорость копирования ДНК постоянна и приблизительно равна 1500 пар нуклеотидов в секунду. Т.о. можно подсчитать, что весь геном этой
бактерии~4,6×106 парнуклеотидов(п.н.) реплицируетсяприблизительноза40-50 мин.
Эукариотическая ДНК содержит большое число репликонов. За один клеточный цикл все репликоны активируются один раз. Скорость удвоения ДНК у эукариот составляет приблизительно 10-100 п.н./сек, поэтому инициация репликациинамногихучасткахДНК(ori) ускоряетэтотпроцесс.
Репликативная вилка – область репликации ДНК, перемещающаяся от ori вдоль родительской ДНК, которая расплетаетсяислужитматрицейдлясинтезадочернейДНК. Этообласть, гдепроисходитудвоениеДНК.
При репликации в одном направлении вдоль ДНК движется 1 репликативная вилка (характерно для вирусов). При репликациив2 противоположныхнаправленияхотточкиori – движутсядверепликативныевилки. РеплицированнаяДНКвнутринереплицированнойимеетвид«глазка»
Для определения количества вилок в линейных молекулах ДНК |
|
используется электронная микроскопия, с помощью которой |
репликативныевилки |
определяют расстояние от каждого конца глазка до конца молекулы |
|
ДНК. Еслитолькоодинконецподвижен, следовательно, вДНКтолько |
|
однарепликативнаявилка. Еслиобаконцаподвижны, следовательно, |
|
вилкадвунаправленная. |
|
ДляопределенияколичествавилоквкольцевыхДНКихпредварительно |
|
расщепляют ферментами (рестриктазами), т.е. переводят в линейную |
|
форму. |
|
Механизмырепликацииодинаковыдляпрокариотиэукариот. Для репликации необходимы: матрица – расплетённые цепи исходной ДНК, субстраты дезоксирибонуклеотидтрифосфаты (Обратите внимание, чтосубстратысодержаттриостаткафосфорнойкислоты!),
ионы Mg2+, белки, обеспечивающие деспирализацию двунитевой ДНК (SSB-белки, от англ. single strand bind – белки, связывающиеся с одной цепью ДНК, препятствуя образованию дуплекса) и ферменты. Их названия понять и запомнить очень просто. Во-первых: все ферменты имеют окончание –аза. Во-вторых: названия происходят от действия, котороевыполняетфермент. Кферментамрепликацииотносятся:
1.ДНК-полимеразы(полимеризуют, синтезируютДНК) – основнойферментрепликации;
2.ДНК-лигазы (в англ. ligation - сшивание), которые зашивают разрыв в одной цепи ДНК путём образования фосфодиэфирнойсвязимеждунуклеотидами; и
3.ферменты, расплетающиедвойнуюспиральисходноймолекулыДНК:
-ДНК-топоизомеразы– устраняютузлыиклубкивдлинныхмолекулахДНК, т.е. расплетаютсверхспирали,
-ДНК-хеликазы (в англ. helix - спираль) – ферменты, которые разрушают водородные связи между цепями ДНК и раскручиваютдвойнуюспиралькак«собачканамолнии».
Все белки, функционирующие в репликативной вилке, образуют комплекс, репликативную машину, которая называетсяреплисомой.
СинтезДНКпроисходитодновременнонаобеихцепяхДНК.
Ферментыибелкирепликации
1. ДНК-полимеразы. ВсеудлиняютцепьДНКприсоединениемнуклеотидак3’-ОН-концуцепиДНКилиРНК.
А. Прокариотические.
ДНК-полимераза I – одноцепочечный белок с тремя активностями. (в репликации и репарации). 1 – полимеразная – необходим праймер (РНК-затравка), содержащий 3’-ОН-группу и матрица (цепь ДНК), определяющая присоединение правильного (комплементарного) нуклеотида. Функция – заполнение брешей между сегментами в цепях ДНК; 2 - к 3’→5’-экзонуклеазная– гидролизфосфодиэфирныхсвязейводнойцепиДНКс 3’-конца. Функция– удалениеошибочно присоединённого нуклеотида с растущего 3’-ОН-конца; 3 - 5’→3’-экзонуклеазная – гидролиз фосфодиэфирных связей в однойцепиДНКс 5’-конца. Функция– удалениенебольшихучастковРНК-затравкифрагментовОказаки.
Приобработке трипсином in vitro ферментраспадается на2 фрагмента: Большой(С-концевой, фрагментКлёнова) 76 кДа, проявляетполимеразнуюи3’→5’-экзонуклеазнуюактивности; Малый(N-концевой) 36 кДас5’→3’-экзонуклеазнойакт-ю. ДНК-полимеразаII. 120 кДа. Рольнеясна. Вероятно, принимаетучастиеврепарации.
ДНК-полимераза III. Холофермент, т.е. олигомерный белок, обладает высоким сродством к ДНК-матрице с высокой эффективностьюкопирования. Ключевойферментрепликации. Структуруферментасм. впрезентации..
Б. Эукариотические.
ДНК-полимеразаα– вядре. Олигомерныйфермент≈ДНК-полимеразеIII. Главныйферментрепликации. ДНК-полимеразаβ– вядре, одноцепочечныйбелок. Функция– заполнениебрешей врепарации ДНК-полимеразаγ- вядреиМТХипластидах. Состоитиз4 идентичныхполипептидов. Главныйферментрепликации вМТХипластидах; вядрефункциянеясна..
ДНК-полимеразаδ(дельта) - участвуетврепликациизапаздывающейцепиДНК, иврепарации. ДНК-полимеразаε(эпсилон) - участвуетврепликациилидирующейцепиДНК, иврепарации, рекомбинации.
2. ДНК-лигазы. – образуют фосфодиэфирные связи между 5’-фосфо- и 3’-ОН-группами соседних дезоксирибонуклеотидоввместахразрывовцепейДНК, которыекомплементарныматрицеДНК. Функция– соединение фрагментовОказакиприрепликации, атакже прирепарацииигенетическойрекомбинации.
А. прокариотические. –одноцепочечныебелки. Б. эукариотические: ДНК-лигазыI, ДНК-лигазыII, ДНК-лигазыIII. Прокаритоические и ДНК-лигазы I проявляют АМФ-зависимую топоизомеразную активность, т.е. устраняют топологическиенапряжениявновосинтезированныхфрагментахОказаки.
Механизм: АТФилиНАД+ используютсякакисточникэнергии. См. слайд.
3. Белки, расплетающиедвойнуюспиральДНК. 2 этапа.
1.Расплетение сверхспирали ДНК с помощью ДНК-топоизомераз. Создаются условия для непрерывного движение репликативной вилки. Особая ДНК-топоизомераза II, обнаруженная только у прокариот, названа ДНК-гираза (тетрамер) – вноситотрицательныесупервиткидляоблегчениярасхожденияцепейДНК. Механизмдоконцанеизучен. Координированное действие ДНК-топоизомераз и ДНК-гиразы (у бактерий) регулирует степень суперспирализации ДНК и т.о. влияют на скорость перемещения репликативной вилки. Топоизомераза IV (относится к топоизомеразе II) необходимадлярасхождениякатенанов.
2.Далеерасплетение дуплекса ДНКпроисходиттольковлокальном участке(репликативной вилке) приучастии белковдвухтипов.
А. ДНК-хеликазы (ДНК-зависимые АТФазы) – ферменты, разрушающие водородные связи между комплементарными цепями в ДНК с использованием энергии гидролиза АТФ. Максимальная скорость может быть достигнута при совместномдействиинесколькихразныххеликаз. УE/ coli более10 разныххеликаз, учеловекаобнаружено6.
Б. SSB-белки(single strand bind), илибелкиАльбертса– тетрамерныебелки, дестабилизирующиедвойнуюспиральДНК,
понижают температуру плавления ДНК на 20-40°С, связываются электростатичекси с сахаро-фосфатным остовом одиночныхцепей ДНК, не закрывая оснований, т.о. не препятствуют комплементарному присоединению нуклеотидов в ходе репликации и препятствуют образование двуспиральных и шпилечных структур. Белки стимулируют ДНК- полимеразуиДНК-хеликазы, защищаютодноцепочечнуюДНКотнуклеаз.
Дополнительныебелкирепликации: 1. белкиинициации– распознаютточкуначаларепликации; . шарнирныймеханизм дляпродвижения репликативной вилки; 3. белки, распознающие точку окончания репликации (terminus) – Tus-белки; 4. белки, способствующиесуперскручиваниюновыхмолекулДНК.
Всебелкирепликацииобразуютмультиферментныйкомплекссмолеукл. Массойболее1 млнДа– реплисому.

МодельрепликацииДНКуE. coli
КольцеваяДНКE. coli (4 639 221 п.н.) реплицируетсядвунаправленоотточкиначаларепликации, котораяназываетсяori с – последовательность из 245 пар азотистых оснований, которая содержит: а) 4 сайта по 9 нуклеотидов связывания белка-инициатора dna A, называемых dna A-боксами; б) 3 сайта по 13 нуклеотидов, богатые АТ-парами. В точке ori с ДНКимеетнеправильнуюдвойнуюспираль, асложнуюдвойнуюструктуру, напоминающуюклеверныйлист.
Процессрепликацииделятнатриэтапа: инициация, элонгацияитерминация.
1. Инициация. Инициацияначинаетсяс«узнавания» инициаторнымибелкамиспецифическихпоследовательностейв точкеori. Последовательностьсобытий:
1.Активированные молекулыбелка-инициатораdna A вприсутствииАТФ связываютсяс 4 dna A-боксами вточкеori с. Т.о. обеспечивается разделение цепей ДНК в соседней А=Т-богатой области, образуется открытый комплекс, и следующиекомпонентырепликационноймашинымогутзанятьстартовоеместо.
2.С комплексом ДНК/dna A соединяется белок dna С, что способствует переходу другого белка dna В в расплетённую областьДНК. Белокdna В– хеликаза, которыйрасплетаетДНКвточкеori сиформируетсяинициирующий«глазок» из несколькихсотенразделенныхпарнуклеотидов.
Одноцепочечныеучастки«глазка» стабилизируютсяSSB-белками. Точкаori готоваксинтезуРНК-праймера(затравки) и последующемусинтезуДНК.
3.Формируется предзатравочный комплекс: с комплексом [dna В- dna С] связывается четыре полипептида (n, n’, n’’ и i(dnaT)), ролькоторыхнеясна.
4.Образуется праймосома. К предзатравочному комплексу добавляется фермент праймаза (белок dna G), которая синтезируетРНК-затравку, илипраймер– короткийфрагментРНК(10-12 нуклеотидов), 3’-конецкоторогоиспользуется ДНК-полимеразойIII длясинтезаДНК.
5.Сборка реплисомы. С праймосомой взаимодействует ДНК-полимераза III и два белка с функциями хеликаз, которые двигаютсяпоДНКвпередирепликативнойвилки: хеликазаII ибелокrep.
Вреплисому у E. coli также входят ДНК-полимераза I для заполнения «брешей» и удаления праймера, ДНКлигаза(«сшивание» фрагментовОказаки), гираза(топоизомераза) длявведенияотрицательныхвитков.
Существуетдвемоделиинициациирепликацииклеточноймассой(массаинициации):
1)В течение клеточного цикла непрерывно инициируется белок-инициатор (dna A) и накопление его критического количестваслужитсигналомдляинициациирепликации. Этонаиболеепредпочтительнаямодельинициациирепликации.
2)В клетке синтезируется белок-ингибитор и по мере увеличения объёма клетки его концентрация уменьшается, т.о. ингибиторстановитсянеэффективениинициируетсярепликацияДНК.
2. Элонгация. С3’-концапраймера(РНК-затравки) ДНК-полимеразаIII начинаетсинтезироватьновуюцепьДНК присоединениемкаждогопоследующегодезоксинуклеозидтрифосфататолькок3’-концуимеющейсяцеписвыделением пирофосфата. Синтезидетвнаправлении5’→3’ (принципрепликации) одновременнонаобеихцепях. Однако, таккак цепиДНКантипараллельны, аДНК-полимеразысинтезируютДНКприсоединениемкаждогопоследующегонуклеотида толькок3’-концуимеющейсяцепиив1960-хгг. РейжиОказакиэкспериментальнодоказал, чтосинтезоднойцепи происходитфрагментарно, прерывисто. ПозжеэтифрагментыбылиназваныфрагментамиОказаки.
В1967 г. наVII МеждународномбиохимическомконгрессевТокиопредложенасхемасинтезаДНК.
Т.о. синтез одной цепи – Лидирующей - происходит непрерывно от 5’- к 3’-концу в направлении движения репликативной вилки и необходим только 1 акт инициации и один праймер. Синтез второй цепи – Отстающей – фрагментарно, также от 5’- к 3’-концу, но в противоположном направлении репликативной вилки, инициируется многократно, т.о. синтезируется много праймеров и фрагментов Оказаки. У прокариот длина фрагментов Оказаки составляет1000-2000 нуклеотидов, уэукариот– 150-200 (до300) нуклеотидов.
Реплисома удлиняет лидирующую цепь и одновременно инициирует синтез РНК-затравок (до 10 нуклеотидов) на расстоянии 1000-2000 нуклеотидов друг от друга на ДНК отстающей цепи. ДНК-полимераза III синтезирует цепь ДНК доследующейзатравки. ДалееДНК-полимеразаI удаляетпраймерс5’-концаблагодаря5’-экзонуклеазнойактивностии одновременно замещая рибонуклеотиды дезоксирибонуклеотидами. Далее ДНК-лигаза сшивает фрагменты Оказаки в непрерывнуюцепь.
При включении неправильного нуклеотида ДНК-полимеразы I и III удаляют ошибочный нуклеотид с 3’-конца, гидролизуяфосфодиэфирнуюсвязьзасчет3’-5’-экзонуклеазнойактивности.
3. Терминация. ПридостиженииреплисомыопределеннойтерминаторнойпоследовательностинуклеотидовтерминаторовдвижениерепликативнойвилкиисинтездочернихцепейДНКпрекращается. СинтезированнаяДНКсамопроизвольносворачиваетсявбиспираль.
Процессрепликациисложен, требуетмногоэнергиидлядействияхеликаз, синтезаРНК-затравокиДНК, активацииДНКполимеразыIII припереходенановыйфрагментОказаки, дляработытопоизомераз, высокоупорядочен, быстриточен.
Американский биохимик Артур Корнберг совместно с Северо Очоа за открытие механизма биосинтеза нуклеиновых кислот в 1959 г. был удостоен Нобелевской премии по физиологии и медицине. Используя в качестве матрицыприроднуюДНК, А. КорнбергвпервыеосуществилсинтезДНКin vitro, т.е. впробирке.
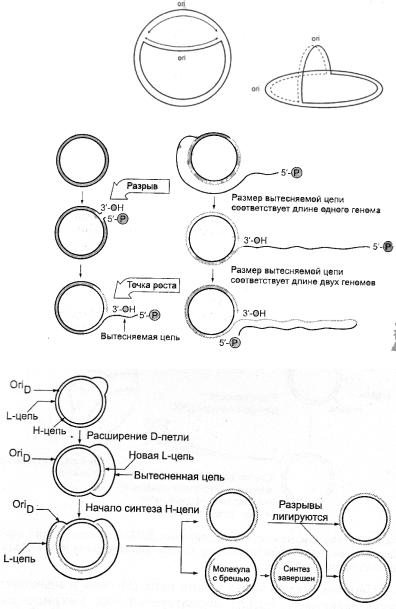
Модели репликации ДНК (для всех живых организмов общей модели репликации нет)
1. Репликация ДНК по типу глазка – у линейных молекул ДНК движение репликативной вилки формирует глазок (независимо от количества вилок). У кольцевых молекул ДНК, например, у E. сoli, присутствие глазка приводит к образованию θ - структур.
2.Репликация по типу катящегося кольца (разматывающегося рулона). Протекает у одноцепочечных ДНК фагов М13, ϕХ174 илиувирусовсциклическойдвуцепочечнойДНК.
Двуцепочечная кольцевая ДНК надрезается специфическим ферментом в уникальном сайте только одной цепи и к образовавшемуся 3’- концу ДНКполимераза присоединяет нуклеотиды. Матрицей является интактная замкнутая цепь ДНК, т.о. синтезируется только лидирующая цепь и 5’-конец исходной родительской ДНК вытесняется.
Новая цепь может содержать любое число единиц генома, которая затем фрагментируются в каждой точке ori и фрагменты замыкаются в одноцепочечное кольцо.
3.Репликация по типу Д-петли. По такому механизму осуществляетсярепликация ДНКмитохондрий. Одну нитьДНКобозначаютН, вторую– L. СначалаНцепь используется как матрица для синтеза одной новой цепи. Синтез происходит на коротком участке и приводит к вытеснению исходной комплементарной L-цепи, которая остаётся одноцепочечной и образуемая структура называется Д-петлей (от англ. displacement – вытеснение). После репликации 67%
длины Н-цепи раскрывается точка oriД в L-цепи, в которой инициируется синтез новой Н-цепи в противоположном направлении с использованием вытесненнойL-цепивкачествематрицы.
Итог: репликация двух цепей протекает не одновременно и к моменту завершения синтеза дочерней L-цепи Н- цепь синтезируется только на 30-40% длины кольца. В результате освобождается одна полная двуцепочечная кольцевая ДНК и одна кольцевая молекула с брешью, которая затем застраивается и разрыв зашивается лигазой.
Репликация ДНК у эукариот
В целом этот процесс у эукариот менее изучен из-за большой сложности структурной организации генома. Репликация у эукариот протекает с образованием большого количества репликативных вилок, т.е. характерна полирепликоновая организация хроматина. Размеры репликонов 20 тыс. – 200 тыс. пар нуклеотидов. Репликация протекает в двух направлениях, т.е. образуется две репликативных вилки.
Ori у дрожжей содержит 2 структурных компонента: 1) DUE (DNA unwinding element) – легко расплетаемый участок ДНК; 2) функциональнаяавтономнореплицирующаясяпоследовательность(ARS).
Хромосома эукариот линейна. При репликации праймер у 3’-конца родительской цепи разрушается, но ДНКполимераза не может достроить ДНК, т.к. нет 3’-конца, и дочерние цепи становятся короче на размер одного праймера (10-20 нуклеотидов). Поэтому для предотвращения укорочения цепи ДНК на концах хромосом находятся участки нереплицируемой ДНК – теломеры (длина 10-15 тыс. пар оснований), которые были обнаружены в 1978 г. Е. Блэкберн. На этом участке синтезируется праймер. Теломера состоит из большого числа повторов (около 2000 раз) 6 нуклеотидов (у человека ТТАГГГ). Теломеры удлиняются с помощью фермента теломеразы, который содержит РНК, используемую в качестве матрицы, присоединяет к 3’-концу теломеры синтезированный фрагмент ДНК для сохранения исходных размеров хромосомы. В норме теломераза присутствует только в половых и стволовых клетках.
Т.о. теломеры выполняют роль «буферной зоны», а также защищают концы ДНК от действия экзонуклеаз и позволяют концам хромосом прикрепляться к ядерной мембране.
Т.к. ДНК эукариот связана с ядерными белками-гистонами, что снижает скорость репликации. На участке репликативной вилки гистонов нет, они находятся на расстоянии 200-400 п.н. от вилки. Роль «молекулярного сопровождающего» и промежуточного акцептора гистонов в клетке выполняет кислый белок – нуклеоплазмин, который связывает гистоны и передаёт их новосинтезированной молекуле ДНК. В нуклеосомах смешения старых и новых гистонов нет, но их распределение по2 дочерним молекулам ДНК, вероятно, случайно.
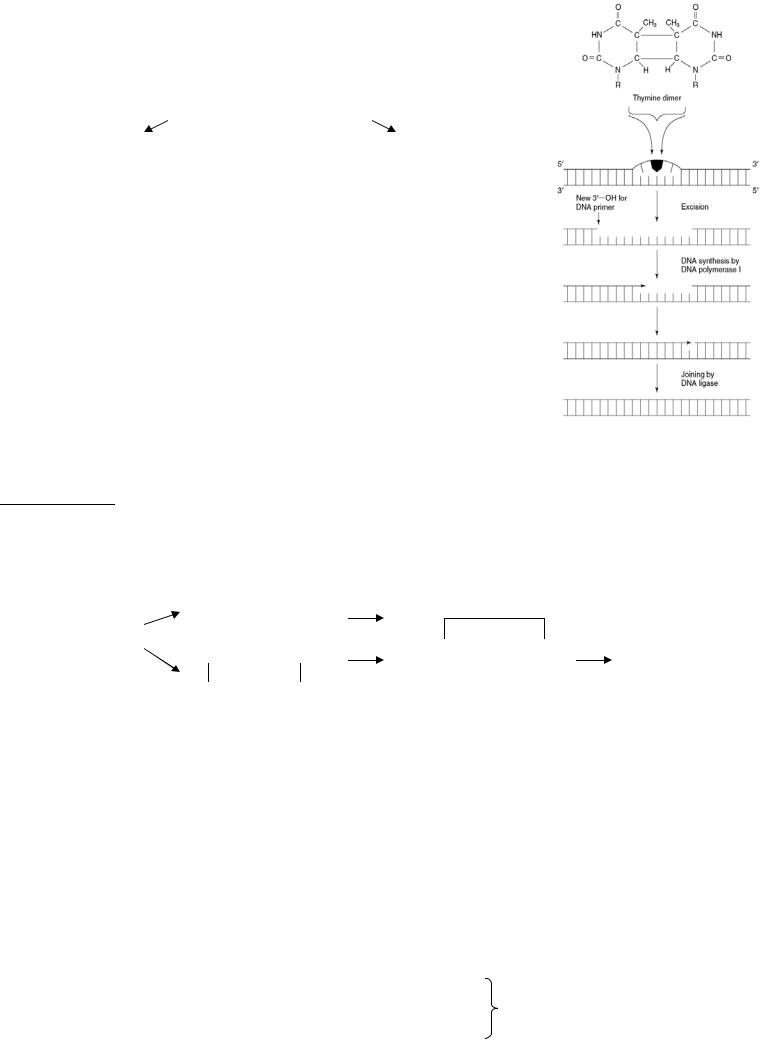
РЕПАРАЦИЯ ДНК |
3А |
Конститутивная репарация, т.е. ферменты репарации присутствуют в клетке |
|
|
в постоянных количествах.
ДНК-полимераза I за счет 3’→5’-экзонуклеазной активности проверяет правильность нуклеотида новой цепи и гидролизует концевой нуклеотид, если основание не комплементарно родительской цепи. ДНК-полимераза III добавляет нуклеотидытолькоприкомпелементарностипредыдущегонуклеотида.
|
|
МЕХАНИЗМЫРЕПАРАЦИИ |
|
|
|||
ОБРАЩЕНИЕПОВРЕЖДЕНИЯ |
ЭКСЦЕЗИОННАЯРЕПАРАЦИЯ |
||||||
1а. |
Фотореактивация |
– |
(заменаповрежденногоучастка) |
||||
1б. Репарация димеров. УФ приводит |
|||||||
фотореактивный фермент расщепляет |
к образованию тиминовых димеров в |
||||||
ковалентные |
связи |
между |
цепи ДНК и блокирует активность |
||||
пиримидинами |
(Т=Т) |
при |
ДНК-полимеразы III. При участии |
||||
использовании энергии поглощенного |
АТФ нуклеаза f вырезает тиминовый |
||||||
синего света. |
Дезалкилирование |
димер (+ 7 нуклеотидов от 5’-конца |
|||||
2а. |
|
до димера и 4 нуклеотида от 3’-конца |
|||||
(деметилирование, деэтилирование) - |
после димера). Образовавшуюся |
||||||
из |
шестого положения |
остатка |
брешь заполняет ДНК-полимераза I, а |
||||
гуанина фермент метилгуанин-ДНК- |
ДНК-лигаза – сшивает. |
|
|||||
алкилтрансфераза |
катализирует |
2б. Репарация депуринизированной |
|||||
перенос алкильных групп на фермент, |
ДНК. |
При |
действии |
высокой |
|||
т.о. фермент инактивируется. |
|
температуры |
некоторые |
пуриновые |
|||
|
|
|
|
нуклеотиды |
теряют |
азотистые |
|
|
|
|
|
основания - апуринизация. Апуриновая |
|||
|
|
|
|
эндонуклеаза вырезает этот участок, а |
|||
|
|
|
|
далее ДНК достраивается как в |
|||
|
|
|
|
репарации димеров (см. пп.1б). |
|||
3б. Репарация химически модифицированных азотистых оснований. А) ДНК-гликозилазы – ферменты специфичные к одному из модифицированных азотистых оснований (узнает один тип изменений), вырезают только азотистое основание из нуклеотида и образуется апуриновые или апиримидиновые участки. Дальнейший ход событийсм. пп.2б. Б) Инсертазывстраиваютвповрежденныйнуклеотиднормальноеазотистоеоснование.
SOS-репарация осуществляется индуцибельными ферментами. Включается, если нарушения ДНК грозят гибелью клетке. Последовательность событий: 1. уменьшается скорость репликации; 2. блокируется деление клетки; 3. индуцируется синтез белков, участвующих в образовании олигонуклеотидов. Действие – краткосрочное (40-60 мин), а далее переключается на конститутивную репарацию.
РЕКОМБИНАЦИОННАЯ РЕПАРАЦИЯ – использование материала 1 молекулы ДНК для восстановления другой молекулы ДНК. Рекомбинационная репарация эффективна для дефектов, образующихся в дочерних цепях при репликации матрицы ДНК, содержащей повреждённые основания. Например: удаление участка с
Т=Т-димером, не удаленным эксцезионной репарацией. |
|
|
|
|
|
|||||
АТЦААТ=ТАЦТАГ |
АТЦААТ=ТАЦТАГ |
|
АТЦААТ=ТАЦТАГ |
|
||||||
ТА |
ТЦ репа- |
ТАГ ТТ А АТ ГАТЦ |
|
|||||||
ТАГ ТТА А ТГАТЦ |
|
|
|
рация |
|
|
|
|
|
|
АТЦААТ ТАЦТАГ |
АТЦААТ ТАЦТАГ |
ресинтез бреши |
||||||||
|
|
|||||||||
|
|
|
|
|
ТА |
ТЦ |
в нормальной ДНК |
|||
|
ТАГ ТТА АТГАТЦ |
|
||||||||
|
|
|
|
замещение бреши нормальной |
|
|||||
При репликации реплисома пропускает |
|
|
||||||||
димер Т=Т, поэтому 1 дочерняя |
|
гомологичной цепью |
|
|
|
|||||
молекула ДНК содержит брешь, |
|
из другой молекулы ДНК - |
|
|
|
|||||
а вторая ДНК – нормальная. |
|
одноцепочечный обмен |
|
|
|
|||||
Т.о. повреждение (Т=Т) сохраняется и рекомбинационная репарация будет повторяться до удаления димера эксцезионной репарацией.
СИНТЕЗ РНК (ТРАНСКРИПЦИЯ)
История:
1940 г. Т.Касперсон обнаружил, что в отличие от ДНК, находящейся в ядре, РНК локализована в цитоплазме. Ж. Брашеобнаружил, чтобóльшаячастьРНКвцитоплазмеассоциированасбелкамивмаленькиечастицы.
В1950-хгг. былодоказано, чтоэтичастицы– рибосомы, являютсяместомсинтезабелка.
1961 г. - Ф.Жакоб и Ж.Моно сформулировали концепцию о существовании РНК-посредника (мРНК), переносящего информациюотДНКкрибосоме. В1961 гБреннер, ЖакобиМезельсонподтвердилиэтугипотезуэкспериментально. 1960 г. – С.Вейсс, Ж.Гурвиц и А.Стивенс независимо друг от друга открыли главный фермент транскрипции –
ДНК-зависимуюРНК-полимеразу.
ДНК-зависимаяРНК-полимераза– отсутствуетэкзонуклеазнаяактивность
Прокариоты: Наиболее полно описана РНК-полимераза E. coli. Общее количество молекул фермента в клетке может достигать 7 тыс. РНК-полимераза – олигомерный белок, состоит из нескольких субъединиц.
Полный фермент (холофермент) состоитиз:
двух α-субъединиц – функция – соединение спромотором (см. далее); |
кор-фермент - полипептидные цепи |
β-субъединица – функция – каталитический центр фермента; |
(α2ββ’ω) соединены прочно +2 атома |
β’-субъединица – функция – взаимодействие фермента с ДНК; |
цинка. Кор-фермент обладает |
ω-субъединица – функция – ? |
полимеразной активностью |
σ-фактор - функция – обеспечивает стабильное связывание РНК-полимеразы с промоторами. σ-фактор
соединяется с кор-ферментом слабыми связями. Транскрипция инициируется только полным ферментом, далее σ-фактор освобождается и элонгация осуществляется кор-ферментом(без σ-фактора).

Промотор – последовательность ДНК, обеспечивающая начало транскрипции.
Эукариоты: 3 ядерных РНК-полимеразы и 1 содержится в митохондриях и хлоропластах. Ядерные ферменты: РНК-полимераза I локализована в ядрышках, синтезирует рРНК, РНК-полимераза II локализована в нуклеоплазме, синтезирует г-яРНК, РНК-полимераза III локализована внуклеоплазме, синтезирует мяРНК и тРНК.
ПРИНЦИПЫиПРАВИЛАТРАНСКРИПЦИИ
1.Комплементарность– нуклеотиднаяпоследовательностьРНКкомплементарнаДНК
2.РНК является точной копией одной цепи ДНК в определённом участке (от 1 до нескольких генов). Копируется однакодирующая(матричная, значащая) цепьДНК.
3.При синтезе РНК транскрибируются отдельные фрагменты ДНК – транскриптоны – единица транскрипции, последовательность нуклеотидов ДНК, включающая группу генов, между промотором (последовательность ДНК передгеном, скоторойвзаимодействуетРНК-полимеразаиинициируетсятранскрипция) итерминатором
4.НаправлениесинтезаРНК: 5’→3’
5.РНК образуется из макроэргов: АТФ, ГТФ, ЦТФ и УТФ на 1 цепи ДНК при помощи РНК-полимеразы. Нуклеотидыприсоединяютсяк3’-концусосвобождениемпирофосфата(какврепликации).
6.ПервыйнуклеотидвРНК– адениловаяилигуаниловаякислоты
7.На5’-концеРНКсохраняетсятрифосфат.
Выделяют3 этапатранскрипции
Этапы транскрипции
1. Инициация – связывание РНК-полимеразы с ДНК и распознавание промотора. Инициация определяет начало синтеза РНК, скорость и регуляцию транскрипции. Образуется сложный комплекс между РНКполимеразой и участком ДНК – промотором. Промотор – последовательность ДНК, расположенная перед геном, с которой взаимодействует РНК-полимераза и инициирует транскрипцию. В 1964 г Ф.Жакоб, А.Уллман, Ж.Моно сформулировали концепцию промотора как регуляторного элемента. Транскриптоны у прокариот содержат генетическую информацию нескольких генов и называются оперонами, следовательно,
продуктами транскрипции оперонов являются полицистронные мРНК. |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
Структура промотора |
|
|
|
|
Прокариоты: промоторвключает~ 40 п.н. Впромоторевыделяют3 структурныхучастка: |
|
|
||||||||||
|
верхняя зона |
|
нижняя зона |
1) Стартовая точка – нуклеотид в кодирующей цепи |
||||||||
|
|
|
|
|
|
|
|
ДНК, который определяет включение первого нуклеотида |
||||
|
|
|
|
|
|
|
врастущуюцепьРНК. |
|
|
|||
|
|
промотор |
|
ген |
|
|
||||||
|
|
|
|
|
|
|
|
ДНК |
перед |
стартовой |
точкой |
называется |
|
|
|
|
|
|
|
|
|||||
-35 |
-10 |
+1 |
|
|||||||||
|
последовательность против хода транскрипции (верхняя |
|||||||||||
|
|
направление синтеза РНК |
зона) и обозначают знаком «минус». Участок ДНК после |
|||||||||
|
|
|
|
|
|
|
|
стартовойточкиназываетсяпоследовательностьпоходу |
||||
транскрипции (нижняя зона) и обозначают знаком «плюс». Положения нуклеотидов в кодирующей цепи ДНК нумеруются в обоих направлениях от стартовой точки и значения номеров возрастают по мере удаления от стартовойточки.
Стартоваяточкадлянекодирующейцепи– пурин, следовательно, на5’-концеРНКбудетАилиГ.
2) В некодирующей цепи в центре «-10» находится последовательность ТАТААТ – блок Прибнова. В центре «-10» наблюдается лёгкое расплетание ДНК, т.о. блок обеспечивает связывание РНК-полимеразы и ориентации фермента, увеличиваяэффективностьтранскрипции.
3) «Блок -35» - в центре «-35» содержится последовательность ТТГАЦА – район распознавания – сайт для
присоединенияσ-фактораРНК-полимеразы.
Последовательностьсобытийинициациитранскрипции(см. слайд)
Холофермент связывается с ДНК в области промотора, образуется закрытый двойной комплекс, происходит локальное расплетение ДНК (12-17 п.н.) - открытый двойной комплекс. Далее включается два первых нуклеотида с образованием
фосфодиэфирнойсвязимеждуними– тройнойкомплекс; σ-факторотделяется– прочныйтройнойкомплекс. 2. Элонгация. Кор-фермент движется по цепи ДНК, расплетая нити, продолжает наращивать цепь РНК. Открытый комплекс – 15-20 п.н., следовательно, по мере движения фермента нативность ДНК восстанавливается. В основе транскрипции – реакция полимеризации между 5’-трифосфатной группой нового нуклеотида и 3’-ОН-группой последнего нуклеотида цепи РНК. После образования фосфодиэфирной связи фермент продвигается по матрице на 1 нуклеотид и реакция
повторяется. Скорость элонгации при 37°С – 40-50 (до 100) нуклеотидов/сек (у эукариот – 20-30).
3. Терминация – РНК-полимераза синтезирует РНК до достижения терминатора - происходит остановка включения нуклеотидов в цепь РНК, освобождение образовавшегося транскрипта и отделение РНК-полимеразы от ДНК-матрицы, происходитвосстановлениенативностиДНК.
Два типа терминаторов: 1) ρ-независимая терминация: на 3’конце РНК образуются шпильки (4-8), богатые Г≡Ц-парами, и синтезируется участок из 6 остатков Ура. Шпильки останавливают движение РНК-полимеразы и слабые
связиУ=дАлегкоразрушаются РНКосвобождается; 2) ρ-зависимая: необходим ρ-белок (55кДа, активная форма - тетрамер). На 3’-конце РНК образуются шпильки, но
Г≡Ц-пар меньше, чем в ρ-независимой терминации, и нет участка из остатков Ура. Существует 2 модели ρ-
зависимой терминации: а) ρ-фактор связывается с 5’-концом синтезируемой РНК и далее движется вдоль РНК, используя для этого энергию гидролиза НТФ, в терминаторе догоняет и взаимодействует с РНК-полимеразой,
способствуя отделению РНК; б) неактивный ρ-фактор движется вместе с РНК-полимеразой, но неактивен, т.к. ингибируется выделяемым пирофосфатом, в области терминатора активируется (т.к. РНК полимераза останавливается, выделенияпирофосфатанет) ипроисходитотделениеРНК.

ОСОБЕННОСТИ ТРАНСКРИПЦИИ у ЭУКАРИОТ |
4А |
1. Структура промотора. Сходно строению промотора прокариот. Наиболее всего изучены промоторы |
|
для |
РНК-полимеразы II (см. Слайд). В промоторе эукариот выделяют 3 структурных участка: 1) Стартовая точка – для некодирующей цепи – аденин. 2) В некодирующей цепи в центре «-25» находится последовательность из 7 нуклеотидов ТАТА(А/Т)А(А/Т) – блок Хогнесса – определяет местоположение стартового нуклеотида, следовательно, отвечает за инициацию транскрипции. 3) «Блок -75» - в центре «-75» содержит последовательность ГГ(Ц/Т)ЦААТЦТ – «ЦААТ-блок» - контролирует связывание РНК-полимеразы II с матрицей и частоту инициации транскрипции.
2. При транскрипции умеренно транскрибируемых генов или потенциально активных генов хроматиновая фибрилла разрушается, теряется белок-гистон Н1 и к нуклеосомам присоединяется белок HMJ (см. слайд). У интенсивно транскрибируемых генов нуклеосомы могут полностью исчезать.
3. Терминация- доконцанеясно.
СОЗРЕВАНИЕ РНК: ПРОЦЕССИНГ и СПЛАЙСИНГ Процессинг – процесс формирования зрелых (функционально активных) молекул РНК из предшественников
– первичных транскриптов. ПРОКАРИОТЫ:
мРНК (иРНК). Процессинг мРНК протекает редко, в основном, молекулы являются первичными транскриптами, которые взаимодействуют с рибосомами. Большинство мРНК полицистронны (полигенны), транскрибируется несколько генов, формируется 1 оперон и имеется 1 промотор.
рРНК. В результате транскрипции образуется предшественник – первичный транскрипт 30S РНК.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
РНКаза III |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
РНКаза М – принимает участие в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
формировании 3’- и 5’-концов у 23S рРНК |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
РНКаза М5 – участвует в процессинге |
|
16S рРНК |
тРНК |
23S рРНК 5S рРНК |
тРНК |
|||||||||||||
5S рРНК |
||||||||||||||||
входит в 30S |
|
|
|
|
|
входят в 50S |
|
|
|
|||||||
субъединицы рибосомы |
субъединицы рибосомы |
|
|
|
|
|||||||||||
тРНК. РНКаза Р отщепляет нуклеотиды с 5’-конца. РНКаза Д отщепляет нуклеотиды с 3’-конца до достижения 3’-концевой последовательности ЦЦА (см. строение тРНК). Если последовательности ЦЦА в РНК нет, то последовательность синтезируется внематрично с помощью фермента – тРНК-нуклеотидил-трансферазы.
ЭУКАРИОТЫ:
мРНК (иРНК). Предшественником мРНК является г-яРНК. После транскрипции к 5’-концу присоединяется «кэп», а к 3’-концу – полиАс помощью полиА-полимеразы. В 1977 г. было показано, что эукариотические геныимеют прерывистое строение. Гены эукариот состоятиз экзонов(последовательность нуклеотидов, представленных в мРНК) и интронов(последовательности нуклеотидов, которых нет вмРНК). Впроцессинге происходит вырезание интронных участков и сшивка последовательностей РНК, соответствующих экзонам в ДНКс образованием мРНК
– сплайсинг (мор. сшивка концовканатов без узлов). Размеры интронов разнообразны и длиннее экзонов(10010000 нуклеотидов). Интроны начинаются с ГУ (5’-конец) и заканчиваются АГ(3’-конец)-последовательностями. Число интроновможет варьировать: от1 до нескольких десятков.
Модели сплайсинга
1. Аутосплайсинг (самосплайсинг). А) Без участия ферментов, за счет самой РНК (рибозимы).
а) происходит разрыв фосфодиэфирной связи по левому концу интрона, т.о. образуется левый экзон РНК и интрон&правыйэкзон.
б) 5’-конецинтрона присоединяется к 2’-ОН-концу аденина в сайтеветвления в) 3’-ОН-группа экзона 1 нуклеофильно атакует фосфатную
группуэкзона2 иобразуется3’-5’-фосфодиэфирнаясвязь. Б) С участием м-яРНК. Важную роль в сплайсинге играют м-яРНК, которые в комплексе с белками образуют сплайсеосому. Существует 5 м-яРНК: U1, U2, U4, U5, U6. Механизм: сплайсеосома «распознаёт» оба конца интрона. м-яРНК образуют комплементарные пары с концами интрона, который образует петлю. Далее белки сплайсеосомы «вырезают» интрон и «склеивают» экзоны.
2. Альтернативный сплайсинг – внутри одного гена вырезаются различные участки. Т.о. одна первичная последовательность нуклеотидов в ДНК используется для синтеза нескольких разных белков.
Четыре вида альтернативного сплайсинга:
|
|
Ин П2 Экз2 Ин Экз3 Ин Экз4 |
• Альтернативный выбор промотора. Существует 2 |
|||
|
П1 Экз1 |
|||||
Выбор П1 |
Выбор П2 |
альтернативных промотора, выбор которых зависит |
||||
от специфических транскрипционных факторов, |
||||||
134 |
|
234 |
||||
|
характерных для данного типа клеток |
|||||
|
|
|
|
Экз4 Ин |
||
П1 Экз1 Ин Экз2 Ин |
Экз3 Ин |
|||||
• Альтернативный выбор 3’-участка. Существует 2 |
||||||
|
|
|
|
|
||
123АААА |
|
124АААА |
альтернативных участка для прибавления поли-А к 3’- |
|||
|
концу РНК. Выборучастка зависит от типа клеток. |
|||||
|
|
|
|
|
||

П Экз1 Ин Экз2 Ин Экз3 Ин Экз4 |
• Альтернативныйсплайсингпутемвыборакассеты |
||
экзона(вгенесинтезабелкатропонинаТскелетной |
|||
|
|
||
1234 |
124 |
мышцы). Экзонымогутбытьиспользованывлюбой |
|
комбинации, анекоторыемогутбытьнезадействованы. |
|||
|
|
||
• Транс-сплайсинг– соединениесегментовдвухразличныхпервичныхмолекулРНК. Например, утрипаносомы. Значениесплайсинга: уклеткипоявляетсягенетическаягибкость, т.е. изодноготранскриптаразнымивидами сплайсингаможнополучитьразныемРНК, кодирующиесинтезразныхбелков. Возможно, чтоприклеточной дифференцировкепроисходитизменениехарактерасплайсинга, помереразвитияклеткиоднапоследовательность ДНКможетиспользоватьсядляобеспечениябиосинтезаразныхбелков. Нарушениесплайсингаможетприводитьк заболеваниям(фенилкетонурия, β-талассемия). Вопрососудьбеироливыщепляемыхинтроновдоконцанеясен. рРНК. Первичный транскрипт – 45S РНК является предшественником 18S, 28S и 5.8S рРНК. Во время транскрипции или сразу после неё 45S-предшественник метилируется по рибозе, т.о. «отмечаются» участки, которые должны войти в состав зрелых рРНК. Молекула 45S РНК расщепляется РНКазами, об активности которых до настоящего времени мало известно.
тРНК. Синтезируются в виде 4,5S РНК-предшественников (~100 нуклеотидов). Зрелые 4S тРНК(~70-80 нуклеотидов) содержат на концах дополнительные последовательности. ЦЦА-последовательность на 3’-конце синтезируется внематрично, каку прокариот.
После процессинга и сплайсинга РНК может покинуть ядро через поры. Однакомеханизмы транспорта не ясны. Распад мРНК: 1) деаденилирование с 3’-конца (см. строение мРНК) экзонуклеазой; 2) отрезание КЭПа ферментом Dep1; 3) 5’-экзонуклеаза гидролизует мРНК.
ОБРАТНАЯ ТРАНСКРИПЦИЯ
Процессоткрытв1964 гТеминомприизучениионкогенныхвирусов. В1969-1970 гг. выделеныобратныетранскриптыиз онкогенныхвирусовиклеток, зараженныхими. ОнкогенныевирусысодержатРНКиподвлияниемобратныхтранскриптаз (РНК-зависимых ДНК-полимераз; ревертаз) на матрице РНК, к которой присоединен комплементарный олигорибонуклеотид (затравка), синтезируется ДНК с образованием гибридов РНК-ДНК. Далее на цепи ДНК синтезируется вторая цепь ДНК. Синтезированная ДНК может встраиваться в ДНК клетки-хозяина и передаваться в поколениях клеток без активации. При определенных условиях ДНК вируса может активироваться. Обратная транскриптазаобладает5’-3’-полимеразнойактивностью, содержитZn2+ вактивномцентре. Ферментможетсинтезировать ДНК на РНК вирусов, но наибольшей активностью обладает при синтезе ДНК на РНК своего вируса. Благодаря этим свойствамобратнаятранскриптазаиспользуетсявгеннойинженерии, длядиагностикираковыхзаболеваний.
СИНТЕЗ БЕЛКА (ТРАНСЛЯЦИЯ)
История:
1958 г. Фр.Крик – провозглашение Центральной Догмы Молекулярной Биологии – в клетке информация, переданная от гена к белку, не может вернуться в обратном направлении. Информация – точная последовательностьоснованийвнуклеиновыхкислотахилиаминокислотныхостатковвбелках.
Внач. 1950-хгг. ПолЗамечникидр. доказали, чторибосомыместосинтезабелкаизаминокислот.
1956-1958 гг. - М.Хогленд, П.Замечник при инкубации аминокислот, АТФ и цитоплазматической фракции клеток печенипоказали, чтопроисходитактивацияаминокислотиихприсоединениектРНК.
1958 г. Фр.Крик – тРНК выполняет роль адапторной молекулы. Одна часть тРНК взаимодействует с аминокислотой, другаячастьтРНК«узнает» нуклеотиднуюпоследовательность, котораякодируетданнуюаминокислоту.
Трансляция – перевод последовательности нуклеотидов мРНК в последовательность аминокислотных остатков белков на рибосоме.
Генетический код
Маршалл Ниренберг с соавт. в 1960-х гг установили, что 1 аминокислоту кодируют 3 нуклеотида, т.е. 1 аминокислота кодируется триплетом, или кодоном. Кодон – группа оснований ДНК или РНК, с помощью которой закодирована 1 аминокислота. Экспериментально установлено, что 61 кодон кодирует аминокислоты, а 3 кодона не несут информации – сигналы терминации синтеза белка. Генетический код читается в виде неперекрывающихся триплетовс фиксированной стартовой точкой.
Свойства генетического кода: 1) триплетность – 1 аминокислоту кодируют три расположенных рядом нуклеотида; 2) специфичность – 1 триплет кодирует 1 аминокислоту; 3) вырожденность – одну аминокислоту может кодировать несколько триплетов. Синонимы - кодоны, соответствующие одной аминокислоте. Большинство таких кодоном различаются только последним основанием триплета, что сводит к минимуму эффект мутаций; 4) универсальность – у всех живых организмов генетический код универсален; 5) непрерывность – у всех организмовкод линейный, однонаправленный и непрерывный.
Трансляция осуществляется белоксинтезирующей системой: рибосомы; мРНК; тРНК; белковые факторы и
ферменты инициации, элонгации, терминации; набор аминокислот; набор аминоацил-тРНК-синтетаз, образующих аминоацил-тРНК (аа-тРНК); АТФ и ГТФ; Mg2+, Ca2+, K+, NH4+.
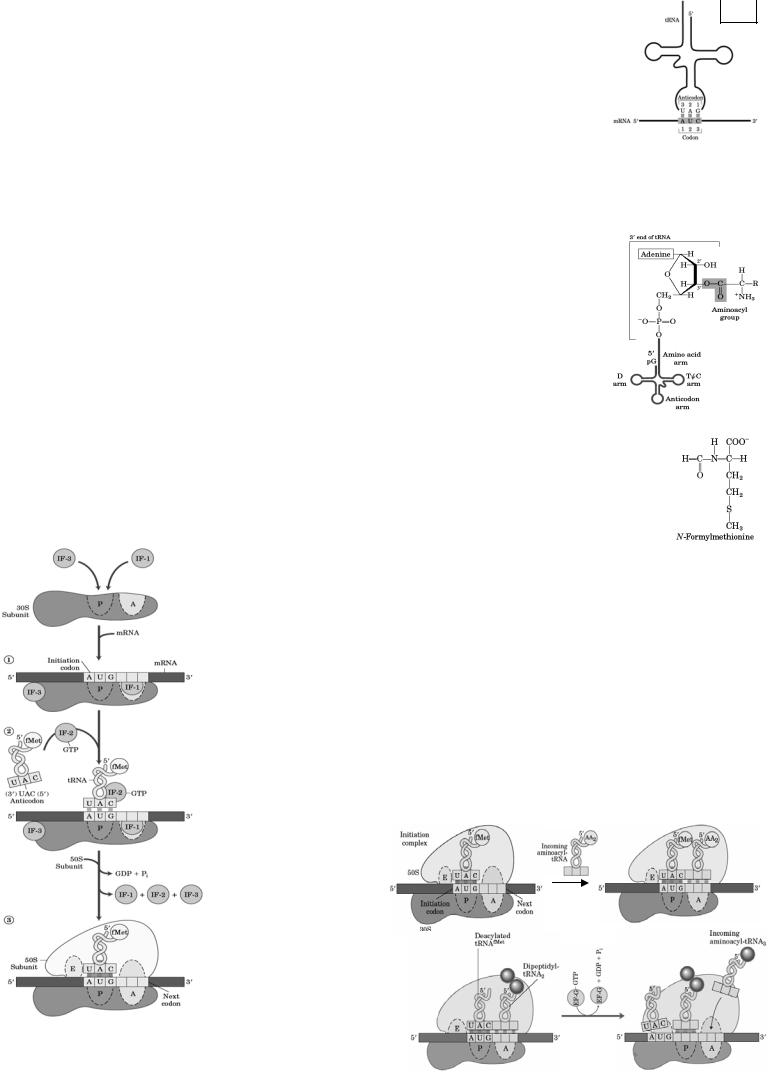
Взаимодействие кодона и антикодона. Гипотеза «качаний», или Wobble-гипотеза: |
5А |
два первых основания кодона образуют прочные пары Уотсона-Крика с двумя последними основаниями антикодона. Спаривание третьего основания кодона и первого основания с 5’-конца антикодона приводит к образованию менее прочной «качающейся» пары.
Этапы трансляции
Прокариоты:
1. Активация и рекогниция аминокислот (нахождение активированной аминокислоте соответствующую тРНК)– протекает в цитоплазме. Каждой аминокислоте соответствует от 1 до 6 тРНК. В 1957 г. Пол Замечник и Мэлон Хоглендустановили, что в трансляции участвуют аминоацил-тРНК-синтетазы. Протекает в2 этапа.
1) образование аминоацил аденилата. Аминокислота активируется с помощью АТФ. Реакцию катализируют аминоацил-тРНК-синтетазы (АРСаза) – ферменты, специфичные к соответствующей аминокислоте, поэтому существует более 20 аминоацил-тРНК-синтетаз:
аминокислота (АК) + АТФ → АК~АМФ + ФФн
аминоацил аденилат
связан с ферментом
2) перенос аминоацильной группы от фермента на 2’- или 3’-ОН-группу рибозы тРНК с
образованием аминоацил-тРНК:
(АК~АМФ)АРСаза + тРНК → АК~тРНК + АМФ + АРСаза ∑: АК+тРНК+АТФ → АК~тРНК + АМФ + ФФн
Далееаминоацил-тРНКпоступаетврибосому. |
|
|
2. Инициация (медленная стадия) – ряд событий, предшествующих образованию |
аминоацил-тРНК |
|
пептидной связи между двумя первыми аминокислотами. В рибосоме есть 2 центра: |
||
|
||
донорный (пептидильный, Р-центр) и акцепторный (аминоацильный, А-центр). Инициация |
||
начинается с образования малых инициирующих комплексов, которые ассоциируются в большой инициирующий комплекс. В комплекс входят: рибосома, мРНК, аминоацил-тРНК, белковые факторы инициации (IF1, IF2, IF3), ГТФ. Первая инициирующая аминокислота с тРНК - формилметионин (fMet-тРНКfMet). Инициирующие кодоны: АУГ, ГУГ, реже УУГ.
Аминокислоты соединяются в последовательности, закодированной в мРНК.
Последовательность событий: 1) 30S субъединица рибосомы соединяется с IF3; 2) к комплексу присоединяется IF1 и образуется малый инициирующий комплекс; 3) fMetтРНКfMet ассоциируется с ГТФ и IF2 с образованием второго малого инициирующего комплекса; 4) первый малый инициирующий комплекс (п.2) связывается с 5’-концом мРНК и распознаётся инициирующий кодон, который располагается в пределах недостроенного Р-центра; 5) два малых инициирующих комплекса ассоциируются в большой инициирующий комплекс + 50S субъединица рибосомы, образуются А- и Р- центры. В Р-центре находится инициирующий кодон, соединённый с fMet-тРНКfMet. В А-центре – только кодон мРНК. Гидролиз ГТФ приводит к конформационным изменениямврибосоме, отделяютсябелковыефакторыинициации.
3. Элонгация – образование и удлинение полипептидной цепи - быстрая стадия. Рибосома перемещается от первого до последнего кодона на кодирующей части мРНК (от первой пептидной связи до последней аминокислоты). Участвуют: ГТФ и факторы элонгации (EF-Tu (Tu), EF-Ts (Ts), EF-G (G)). Этапы:
1)связывание, согласно кодону, аминоацил-тРНК в А-центре рибосомы;
2)Образование пептидной
|
связи. |
Формилметионин из |
|
|||
|
Р-центра переносится в А- |
|
||||
|
центр |
и |
образуется |
|
||
|
пептидная связь с помощью |
|
||||
|
транспептидазы. |
|
|
|
||
|
3) Транслокация. |
Рибосома |
|
|||
|
перемещается на один кодон |
|
||||
|
с помощью EF-G и ГТФ в |
|
||||
|
направлении 5’→3’, |
|
||||
Образование |
комплекс тРНК-дипептид |
3) |
||||
перемещается |
в |
Р-центр. |
||||
инициирующегокомплекса |
||||||
|
тРНКfMet отделяетсяот |
|
||||
рибосомыиуходитвцитоплазму, А-центросвобождается.

ДалееполипептидстРНКвР-центрепереноситсянааминоацил-тРНКвА-центре.
4. Терминация – завершение синтеза полипептидной цепии освобождение отрибосомы. Сигналы – стоп-кодоны на мРНК: УАА, УАГ, УГА. В А-центр вместо аминоацил-
тРНК входят белковые факторы терминации: RF1, RF2 и RRF (ribosome release factor). Транспептидаза, при участии ГТФ, в Р-центре гидролизует связь тРНК-полипептид, который
отделяется от рибосомы.
ОСОБЕННОСТИ ТРАНСЛЯЦИИ у ЭУКАРИОТ В основном синтез белка аналогичен синтезу у прокариот с
некоторыми отличиями: инициирующий кодон – только |
|
АУГ, инициирующая аминокислота – метионин, большее |
Терминация |
число белковых факторов трансляции (более 10, в обозначении приставка «е» - эукариотического происхождения), на цепи мРНК синтезируется только 1 полипептид.
Различия в трансляции у эукариот, по сравнению с прокариотами, заключаются, в основном, в инициации: 1) к 40S субъединице рибосомы присоединяется еIF-3 и еIF-1; 2) Met-тРНКMet с ГТФ и еIF-2 образуют с 40S субъединицей (п.1) преинициирующий комплекс (43S); 3) с 43S комплексом (п.2) соединяется мРНК и образуется 48S комплекс; 4) к 48S комплексу присоединяется 60S субъединица и образуется 80S инициирующий комплекс, отделяются все факторы инициации. Далее процесс синтеза белка протекает аналогично трансляции у прокариот.
Трансляция протекает с затратой энергии: при активации аминокислоты АТФ гидролизуется до АМФ, следовательно затрачивается 2 макроэргических связи; для инициации трансляции необходима 1ГТФ, элонгации – 1ГТФнадоставкуаминоацил-тРНКвА-центри1ГТФнатранслокацию; терминации1ГТФ.
Скорость трансляции зависит от температуры: у бактерий при 37°С – 12-17 аминокислот/сек, у эукариот - ~2 аминокислоты/сек.
ОСОБЕННОСТИ ТРАНСКРИПЦИИ и ТРАНСЛЯЦИИ у ПРОКАРИОТ и ЭУКАРИОТ Прокариоты: до завершения транскрипции рибосома может соединяться с частично синтезированной мРНК и
начинается синтез белка - совместная транскрипция-трансляция. При активном синтезе белка в клетке с освобождающимся во время трансляции 5’-концом мРНК может связываться следующая рибосома, что приводит к образованию полирибосом (полисом). Одна мРНК может кодировать несколько белков, следовательно, мРНК, несущая несколько цистронов (цистрон – это открытая рамка считывания, т.е. последовательность РНК, начинающаяся со стартового кодона и транслируемая в белок), называются полицистронной РНК. Эукариоты: синтез РНК и белка разобщен и новый транскрипт подвергается посттранскрипционным модификациям. В мРНК только одна открытая рамка считывания.
ПРОЦЕССИНГ и ТРАНСПОРТ полипептидных цепей
Процессинг – созревание и сворачивание полипептидной цепи. Осуществляется ферментами, заключается в удалении инициирующих аминокислот, отщеплении лишних аминокислотных остатков или части полипептидной цепи, введении фосфатных, метильных, карбоксильныхилидр. групп, присоединенииолигосахаридовилипростетическихгруппыидр. Сплайсинг – вырезание внутренней короткой аминокислотной последовательности – интеина, и соединение наружных N- иС-концевыхчастей– экстеинов.
Фолдинг – процесс сворачивания полипептидной цепи в правильную пространственную структуру.
Белки, содержащие на N-конце сигнальную последовательность из гидрофобных аминокислотных остатков.
Когда сигнальная последовательность достигнет ~ 70 аминокислотных остатков с ней взаимодействует комплекс белков SRP, который предохраняет растущий полипептид от деградации и направляет его к мембране эндоплазматического ретикулума (ЭПР). Элонгация временно останавливается и сигнальная последовательность соединяется с рибофорином в мембране эндоплазматического ретикулума, образуется мембранный канал – транслокон. ЭлонгациявозобновляетсяиодновременнопроисходитперемещениепептидачерезмембрануЭПР. После синтезабелкасигнальнаяпоследовательностьотщепляетсясигналазойиполипептидподвергаетсяпроцессингу.
Полипептиды без сигнальной последовательности взаимодействуют с шаперонами (см. далее).
Гипотеза «расплавленной глобулы». Этапы самосборки белков: 1. В развернутой полипептидной цепи с помощью водородных связей и гидрофобных взаимодействий образуются участки вторичной структуры. 2. Образование «расплавленной глобулы» в результате образования контактов между удаленными атомами. 3. Формируется нативнаяконформациябелковоймолекулы. Этосамыймедленныйэтапобразованиязрелогобелка.
Шапероны, шаперонины– белки, которые помогают правильной сборке других полипептидсодержащих структур in vivo. Шапероны состоят из 1-2 полипептидных цепей, шаперонины - олигомерные белки. Шапероны помогают сборке трехмерной конформации белка, ингибируют неправильное образование связей, защищают «расплавленные глобулы» от агрегации, переносят новосинтезированные белки в различные отделы клетки. Шапероны являются белками теплового шока и их синтез увеличивается при температурном воздействии на клетку, поэтому их называют hsp (heat shock proteins). Классификация шаперонов основана на величине молекулярной массы полипептидных цепей от 10 кДа (для белка hsp10) до 90 кДа (для белка hsp90) и выше. Шапероны hsp70 связываются с полипептидной цепью, сходящейсрибосомы, препятствуютагрегацииполипептидаиудерживаютеговразвернутомсостоянии. Далее
