
Laboratornye_raboty_po_fome / 6 Теория цветности / Teor_sved
.pdfВВЕДЕНИЕ
Проблема связи строения молекулы того или иного химического соединения с его физическими и химическими свойствами давно интриговала ученых и практиков.
Однако проектирование структуры молекулы под ее будущие свойства реализуется лишь в некоторых простейших случаях, например, для органических красителей, в молекуле которых имеется цепочка сопряженных связей.
Как известно, многие задачи физики и химии относительно легко находят решение при применении концепции идеального газа. В этой модели частицы движутся независимо друг от друга, потому что в этом случае пренебрегают взаимодействием частиц (считается, что средняя кинетическая энергия частиц много больше их энергии взаимодействия). Давление на стенку в этом случае равно сумме импульсов, переданных за секунду отдельными частицами при их столкновении со стенкой, а энергия газа равна просто сумме энергий отдельных частиц.
Реальные газы в случае высоких температур и малых давлений хорошо описываются моделью идеального газа. И в этом простейшем случае методами статистической физики все термодинамические функции удается вычислить до конца. И снова энергия газа равна сумме энергий отдельных частиц.
В случае идеального квантового газа пренебрежение силовым взаимодействием между частицами оказывается еще недостаточным, чтобы частицы были действительно независимыми. Дело в том, что при расстояниях между частицами меньших, чем длина волны де-Бройля
r≤λ.=h/mv,
между частицами существует определенное влияние одинаковых (тождественных) частиц друг на друга, если они находятся в близких квантово-механических состояниях. Это, так называемое, обменное взаимодействие, приводит к их взаимной корреляции в поведении. Однако им можно пренебречь для обычных газов, состоящих из сравнительно тяжелых атомов и молекул при всех температурах, при которых они еще газообразны. При таких температурах такой газ называется невырожденным идеальным газом. Для невырожденного идеального газа функция распределения снова распадается на произведение функций распределения для отдельных частиц. Так мы снова возвращаемся к “одно-частичной “ физике, когда поведение частиц становится независимым во внешнем силовом поле. В статистической физике используются функции распределения Максвелла-Больцмана, что приводит для распределения частиц по координатам во внешнем поле к барометрической формуле, а распределение по скоростям сводится к распределению Максвелла.
Как это ни удивительно, но приближение независимых частиц оказалось достаточно плодотворным и в такой, казалось бы сложной области знания как квантовая химия. Эту идею удалось использовать для объяснения многих свойств некоторых химических соединений, обладающих развитой системой, так называемых, сопряженных связей. Эту идею удалось использовать для объяснения некоторых особенностей магнитных свойств таких ароматических соединений, как бензол и нафталин, особенностей поглощения света молекулами красителей, передачи влияния заместителя вдоль цепочки атомов и молекул с сопряженными связями - все эти, как и многие другие физические и химические свойства веществ, явления интерпретируются, как результат необычной подвижности электронов вдоль чередующейся системы двойных связей в молекулах. В квантовомеханических расчетах также многоэлектронную волновую функцию представляют через одноэлектронные волновые функции, описывающие состояния отдельных электронов в молекуле (так называемые молекулярные орбитали МО). Каждая такая функция описывает движение данного электрона в поле ядер и усредненном поле других электронов.
Целью настоящей работы можно считать ознакомление учащихся с методом

приближения независимых частиц (метод свободных электронов) и применение этого метода для решения задачи о проектировании структуры (дизайна) молекулы красителя с заранее заданными свойствами, прежде всего, с цветом будущего красителя.
В этой работе студенты познакомятся с методикой квантовомеханических оценок свойств некоторых органических соединений (таких, например, как линейные полнены), исходя из знакомой им по курсу общей физики модели движения частицы в одномерной потенциальной яме. В качестве объекта применения этого приближения выбираются молекулы некоторых органических красителей. Здесь же учащиеся познакомятся с элементами, так называемой, теории цветности, где устанавливается связь между объективным физическим свойством - поглощением молекулой света определенной длины волны и субъективным восприятием цвета красителя.
1.Поглощение света
В результате поглощения света веществом его интенсивность закономерно уменьшается: как показывает опыт, величина поглощенной энергии пропорциональна падающей интенсивности света и толгцине поглощающего слоя:
-dI= kIdx, |
(1-1) |
где I - интенсивность света, падающего па слой толщиной dx;
k - так называемый коэффициент экстинкции (погашения) или попросту коэффициент поглощения света.
Интегрируя это выражение по толщине слоя
получим закон Бугера-Ламберта:
Часто бывает так, что для однородного вещества коэффициент экстинкции оказывается пропорционален его плотности р, а коэффициент экстинкции раствора пропорционален его концентрации с.
Тогда, естественно, определить удельный коэффициент экстинкции:
Далее, если ввести в обиход молярную концентрацию с в молях/литр, то вводится молярный коэффициент экстинкции
и тогда окончательно ослабление интенсивности света в веществе запишется в виде закона Бера:
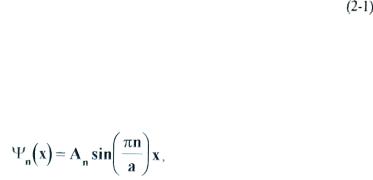
В случае если молярный коэффициент экстинкции έ строго постоянен (отсутствие взаимодействия между частицами), полезно перейти к еще более фундаментальной удельной величине коэффициента погашения, связанного с одной частицей. Если n=C*Na - число молекул в единице объема (здесь введено число Авогадро NA), ТО отношение коэффициента поглощения К к числу частиц в единице объема:
К/n=δ
имеет смысл эффективного сечения поглощения одной молекулы.
Закон Бугера-Ламберта-Бера постоянно применяется для характеристики интенсивности поглощения света веществом на данной длине волны. Как правило, на спектрофотометре измеряют оптическую плотность Dλ на длине волны λ, которая легко определяется по закону:
Dλ = lg(I0/I)= έcd
2.Модель свободных электронов
Для объяснения особых свойств металлов (высокой электропроводности, теплопроводности, самой металлической связи между атомами металла и высокой прочности) первой появилась модель свободных электронов. Она исходила из предположения, что валентные электроны не связаны с атомами, а образуют электронный газ, по свойствам сходный с идеальным газом. По этой модели электроны свободно движутся по всему кристаллу выполняя роль связующего звена между положительными ионами кристаллической решетки. При приближении электронов к границам кристалла на них начинает действовать электрическое поле положительно заряженной кристаллической решетки, удерживающее, таким образом, электроны от вылета из кристалла. Это, естественно, позволяет рассматривать металл как своеобразную потенциальную яму, заполненную электронами.
Простейшей квантовомеханической моделью связанного состояния электрона в атоме или металле является потенциальная яма прямоугольной формы шириной а, равной размеру куска металла.
Пусть яма в первом приближении имеет бесконечную глубину. Решение уравнения Шредингера (2-1)
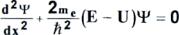 ,
,
для этого случая приводит к следующим выражениям для собственных функций и собственных значений энергии:
Собственные функции ψa(x) (см. рис I):
где а - ширина ямы;
n=1,2,3...- квантовое число, задающее номер квантового состояния. Собственные значения Еn:

Физически допустимые решения задачи, таким образом, возможны только для определенных квантовых состояний системы, задаваемых квантовым числом n =1,2,3,..., описываемых волновыми функциями ψa(x) и обладающих определенными значениями энергии Еn (рис. 1).
Таким образом, при n=1 частица находится в основном, невозбужденном состоянии. Для перехода на более высокий уровень потребуется количество энергии ∆Е:
Эта энергия возбуждения ∆Е увеличивается, как видно, вместе с ростом номера квантового состояния n и в сильной степени зависит от размеров области локализации частицы - ширины потенциальной ямы а:
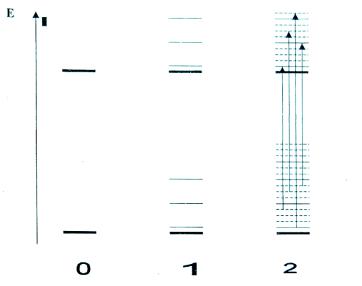
Реально электрон может покинуть металл, если ему сообщить энергию равную работе выхода. Чтобы отразить это обстоятельство, нужно считать, что потенциальная яма будет конечной глубины. Как показывает решение уравнения Шредингера, и в этом случае, в основном, характер квантовых особенностей решения сохраняется, допустимые состояния также определяются квантовыми числами п= 1,2,3.., появляются собственные значения энергии Еn связанных состояний, но в отличие от бесконечно глубокой ямы, волновые функции теперь будут заходить за пределы ямы. Иными словами область локализации частицы несколько шире, чем размеры потенциальной ямы. Схематически это решение показано на рис. 2.
Рис. 1. Вид ψn -функций для электрона в бесконечно глубокой потенциальной яме.
Рис. 2. Вид волновых функций для электрона в потенциальной яме глубиной Uo
3. Элементы теории цветности
Ощущение того или иного цвета может возникнуть при воздействии на зрительный нерв светового излучения с длиной волны из видимого диапазона (в пределах от 400 до 760 нм).
Совместное действие компонент излучения во всем этом интервале при их естественном соотношении интенсивностей («радуга») воспринимается глазом как фон и поэтому вызывает ощущение БЕЛОГО света. Любые отклонения в интенсивности компонент излучения от естественной (как в сторону увеличения ее при селективном рассеянии или отражения света, так и уменьшения (при поглощении света) вызывает ощущение окрашенного света. При этом глаз воспринимает свет (дополнительный цвет) как дополнительный к тому, который поглощается из падающего светового потока. Так возникает и закрепляется в сознании ощущение того или иного цвета.
Излучения, составляющие дополнительные цвета, могут иметь самые различные спектральные составы от монохроматических до излучений со сплошным спектром. Например, чтобы получить два пучка света (со сплошным спектром) соответствующим дополнительным цветам, достаточно пропустить пучок белого света через не поглощающее светоделительное зеркало, которое сильно отражает одну из частей спектра (например, синюю), тогда прошедший пучок желтый, относящийся к оставшейся части спектра, как раз и будет дополнительным к первому (к синему). Справедливо и обратное утверждение, что к желтому пучку света будет дополнительным синий. Ниже в таблице 1 представлены интервалы длин световых волн, вызываемые ими цветовые ощущения и соответствующие им дополнительные цвета.
Окрашенные вещества и красители интенсивно поглощают свет в видимой области (400800 нм). Красителями называют такие вещества, которые, кроме того, что они поглощают видимый свет, обладают еще дополнительными свойствами, как то: стойко окрашивать ткани, растворяться в растворителях, применяемых в технологической практике и пр. Для этого в их молекулярную структуру вносят соответствующие функциональные группызаместители.

Таблица 1.- ДОПОЛНИТЕЛЬНЫЕ ЦВЕТА
п/п |
Спектральные |
цвета |
Дополнительные |
|
поглощаемого света |
|
цвета белого света. |
|
цвет |
λ, нм |
Наблюдаемый цвет |
|
|
|
|
|
Ультрафиолетовый |
<400 |
Бесцветный |
1 |
Фиолетовый |
|
Желтовато-зеленый |
|
|
435 |
|
2 |
голубой |
|
Желтый |
|
|
480 |
|
3 |
Зелено-синий |
|
Оранжевый |
|
|
490 |
|
4 |
Сине-зеленый |
|
Красный |
|
|
500 |
|
5 |
зеленый |
|
Пурпурный |
|
|
560 |
|
6 |
Желто-зеленый |
|
Фиолетовый |
|
|
580 |
|
7 |
желтый |
|
синий |
|
|
595 |
|
8 |
оранжевый |
|
Зеленовато-синий |
|
|
605 |
|
9 |
красный |
|
Синевато-зеленый |
|
|
730 |
|
10 |
пурпурный |
|
Зеленый |
|
|
760 |
|
Рис. 2а.
Рис. 2б.
4.Связь структуры молекулы и ее спектра поглощения
Под действием света в видимой области и в ближайшей к ней слева и справа ультрафиолетовой и инфракрасной областях электромагнитного спектра может происходить возбуждение молекул, сопровождающееся их переходом на более высокие энергетические состояния, что сопровождается соответствующим поглощением энергии излучения.
Если атомы могут возбуждаться только по электронным уровням и от этого их спектры поглощения являются относительно простыми - линейчатыми, то в случае поглощения света молекулами их спектры поглощения носят, так называемый, полосатый характер.
0- электронные уровни;
1- колебательные уровни;
2- электронно-колебательные и вращательные уровни. Рис. 3. Сложная структура спектра молекулы
Действительно, энергетическое состояние молекулы складывается из трех компонент: электронного возбуждения, возбуждения по колебательным уровням и, наконец, возбуждения по вращательным уровням (соответственно убыванию их энергии):
Е=Еэл + Екол + Евращ.
Поэтому в молекулах каждое электронное состояние включает систему более близко расположенных колебательных подсостояний, каждое из которых в свою очередь характеризуется своим набором очень тесно расположенных вращательных уровней.
Следовательно, любой отдельный электронный переход в молекуле представлен огромным числом линий, которые не могут быть практически разделены обычной спектроскопической техникой, от этого, как уже говорилось, спектры поглощения молекул наблюдаются в виде плавных и широких полос. Связь между химическим строением молекулы и ее электронными спектрами определяется поглощением света и соответствующими этому электронными переходами в молекуле в целом или в ее отдельных фрагментах. Вообще говоря, поглощение энергии молекулой определяется, как правило, всей ее системой химических связей между отдельными атомами в целом, правда, иногда в молекуле формируются некоторые относительно “автономные “части (эти структурные элементы называют хромофорами (цветоносителями - греч.)\ которые вносят свой собственный, опять же, только относительно устойчивый вклад в суммарный спектр поглощения в виде отдельных полос. Типичными хромофорами являются такие ненасыщенные группы как: NO2,NO, =C=O,-N=N, -CH=CH- и некоторые другие.
Однако, положение этих самостоятельных полос поглощения в значительной степени зависит от строения молекулы (от ее углеродного “скелета"), а так же от наличия тех или иных заместителей (отдельных атомов и их групп) в молекуле органического соединения. В данной работе рассматривается система сопряженных связей как хромофор в молекуле красителя и именно для этого случая использование модели независимых частиц дает наиболее плодотворные результаты. Здесь нас в первую очередь будет интересовать влияние вариации углеродного скелета молекулы на ее спектр поглощения.
Рис. 4. Смещение и увеличение интенсивности длинноволновой полосы поглощения при увеличении длины цепи сопряженных связей в соединении:
СНз—(CH==CH)m —СООН
Будем считать в первом приближении, что различные заместители и внешние факторы (влияние растворителя) конечно, будут вносить какие-то дополнительные изменения в спектр, однако их вклад, как правило, будет значительно меньшим в сравнении с первым обстоятельством.
Влияние заместителей (а также растворителей) на спектры поглощения часто качественно оценивают следующим образом. Уменьшение энергии поглощенного кванта (и соответственно, сдвиг максимума поглощения в сторону длинных волн) характеризуют понятием — батохромногосдвига.; увеличение энергии поглощаемого света приводит к, так называемому, гипсохромному сдвигу (сдвиг максимума полосы поглощения в сторону коротких волн). Интенсивность поглощения света - как говорят, углубление цвета характеризуется следующим образом. Гиперхрамия - усиление интенсивности поглощения, соответственно, гипохромия - ослабление интенсивности поглощения, ослабление насыщенности цвета.
В соответствии с заданной темой нас в дальнейшем должно интересовать так называемое —π*- сопряжение и его проявление в электронных спектрах.
—π* - сопряжением называется взаимодействие электронов нескольких кратных связей, при котором образуется единое легко подвижное облако π- электронов, охватывающее все атомы этой системы связей.
4.1. Влияние размеров системы сопряженных связей в молекуле
Линейно сопряженная система двойных связей является важным хромофором в природных красителях, таких как каротин, и в искусственных, например, цианиновых

красителях.
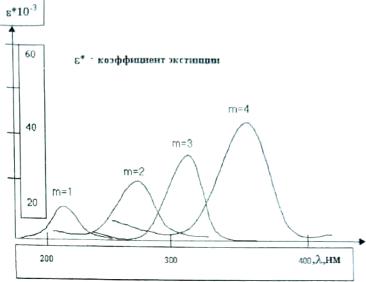
Сопоставляя положения максимумов поглощения простейших цианиновых красителей
(см. рис. 5),
можно сделать вывод, что последовательное удлинение полиметиновой дета на один фрагмент -СН==СН- смещает максимум поглощения на постоянную величину 80-100 нм, что можно описать простым соотношением:
λmax=A*m+B, |
(4-1) |
где А и В - постоянные для данного типа красителей, m - число фрагментов (-СН=СН-). Аналогичную закономерность изменения положения длинноволновой полосы поглощения показывают карбоцианиновые красители (см. рис. 6)
Рис.5. Зависимость длины волны (λmax;) максимума полосы поглощения карбоцианиновых красителей от числа сопряженных двойных связей (m)
Удовлетворительное объяснение зависимости, наблюдаемой в электронных спектрах линейно сопряженных полиенов, может быть обосновано с привлечением модели свободных электронов (так называемая металлическая модель). Кстати сказать, исторически первым и довольно удачным объектом применения квантово-механических расчетов в органической химии, как раз и были карбцианиновые красители.
В теории свободных электронов при описании π -электронных систем в сопряженных линейных полиенах используется в качестве модели решение задачи о частице в одномерной потенциальной яме.

Здесь скелет сопряженной системы рассматривается как одномерная потенциальная яма с постоянным потенциалом внутри и бесконечно высокими стенками. Обычно предполагается, что длина ямы равна длине сопряженной цепи, увеличенной на необходимое число длин связей между гетероатомами (в данном случае азота), являющимися “стенками” потенциальной ямы конечной глубины (см. рис. 2). Каждое решение рассматривается как “орбиталь”, на которой по принципу Паули могут расположиться два электрона. Основное состояние молекулы можно получить, размещая по два электрона на каждую орбиталь по мере возрастания номера квантового состояния n до тех пор, пока, таким образом, не разместятся все π-электроны. Электронные спектральные переходы рассматриваются как возбуждения электрона и переход его с одной из занятых орбиталей на какую-либо из свободных.
Интересующий нас первый переход соответствует возбуждению электрона (формула 2- 3):
Если π - электронная система молекулы состоит из N электронов, то в основном состоянии должно быть занято N/2 энергетических уровней. Первый переход соответствует возбуждению электрона с орбитали n=N/2 на орбиталь n'=N/2+l. Поскольку каждый атом углерода вносит в π-электронную систему полиена один π-электрон, N электронов соответствуют N атомам и длина потенциальной ямы должна оцениваться следующим образом.
В первом приближении, длины связей С-С и C-N можно принять равными друг другу и положить равными d. В этом случае расстояние между крайними атомами азота вдоль зигзагообразной цепи, будет равно:
(m+2k*)d,
где m равно числу групп -СН=СН-.
k*- поправочный коэффициент на конечность ямы (см. рис. 3). Этот коэффициент k* равен рациональному числу и является добавкой к целому m (во всем аналогичен поправкам Ридберга в спектроскопии атома.
В данном приближении считаем, что π-электроны могут свободно двигаться между атомами азота, и поэтому длина потенциального ящика а будет равна:
a=(m+2k*)d. (4-2)
По принципу Паули квантовое число n равно
n=m/2,
подсталяя его в выражение для энергии возбуждения, получим:
(4-3)
Подставляя в уравнение (4-3) выражение (4-2) получим:
