

Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
Линии фазовых превращений (испарение - I, плавление - II, сублимации - III) отображают термодинамическое равновесие двухфазных систем и делят диаграмму на области различных агрегатных состояний.
Энергетической границей между жидкостью и
паром является теплота испарения, а между
твердым телом и жидкостью – теплота
плавления. Так как процессы испарения и
плавления протекают при постоянной температуре, то теплоты испарения, плавления и сублимации есть теплоты изотермических превращений. Теплота фазового перехода
обозначается символом r.

Диаграмма фазовых состояний чистого вещества

Критические параметры являются важнейшими термодинамическими постоянными вещества.
Критическая температура – это температура, при которой и выше которой газ никаким сжатием не может быть переведен в жидкое состояние. Критическое давление – это такое давление, при котором и выше которого жидкость невозможно перевести в газообразное состояние никаким изменением температуры.
В закритической области ( p > pк ; T > Tк ) вещество
может находиться только в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путем по линии 1-2. Можно этот переход
осуществить через закритическую область, то есть без изменения агрегатного состояния, например по линии
1 -1¢ - 2¢ - 2

Поэтому в принципе, для простых тел (однородных систем) должно существовать единое уравнение состояния F( p, v, T ) =0 , описывающее любое одно-
фазное состояние вещества.
Уравнение состояния идеальных газов - уравнение
Клапейрона: |
pv = RT |
|||||||||||
для 1 кг газа |
||||||||||||
для G кг газа |
pV = GRT |
|||||||||||
|
|
|
pv = |
|
|
|
T |
|||||
для 1 кмоля газа |
R |
|||||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
pV = |
|
|
|
|
|
|
|||
|
|
|
G |
R |
T |
|
||||||
для G кмолей газа |
||||||||||||
|
|
|
|
|
|
|
|
|
||||

где R – характеристическая постоянная газа; Т – абсолютная температура газа; µR = R = 8314
( Дж/кмоль К ) – универсальная газовая постоянная, не зависящей от природы газов.
В инженерных расчетах часто пользуются уравнением состояния идеального газа с введением в
него поправочного коэффициента (z), называемого
коэффициентом сжимаемости
pv = zRT
Коэффициент сжимаемости (z) учитывает различие между идеальным и реальными газами (для идеального газа z = 1).

Для обобщения данных по коэффициентам сжимаемости различных газов был использован принцип «соответственных» состояний, сформулированный Ван-дер-Ваальсом. Принцип «соответственных» состояний утверждает, что критическое состояние действительно является одинаковым для всех веществ.
В критической точке для всех веществ r = 0,
æ ¶2 p ö |
|
, æ ¶p ö |
|
, æ |
¶ 2 p ö |
|
. |
||||||
ç |
|
÷ |
= 0 |
ç |
|
÷ |
= 0 |
ç |
|
2 |
÷ |
= 0 |
|
¶ |
¶v |
ç |
¶v |
÷ |
|
||||||||
ç |
2 ÷ |
|
è |
øv |
|
è |
|
ø |
T |
|
|||
è |
T |
øv |
|
|
|
|
|
|
|
|
|||
Вещества находятся в соответственных состояниях при одинаковом удалении от критической точки.

Степень удаления от критической точки определяется с помощью приведенных параметров:
приведенного давления |
p = |
|
p |
|||
|
pк |
|||||
|
|
|
|
|||
приведенной температуры |
t = |
|
T |
|
||
Tк |
||||||
|
|
|||||
|
|
v |
приведенного объема |
w = vк |
|
|
|
|
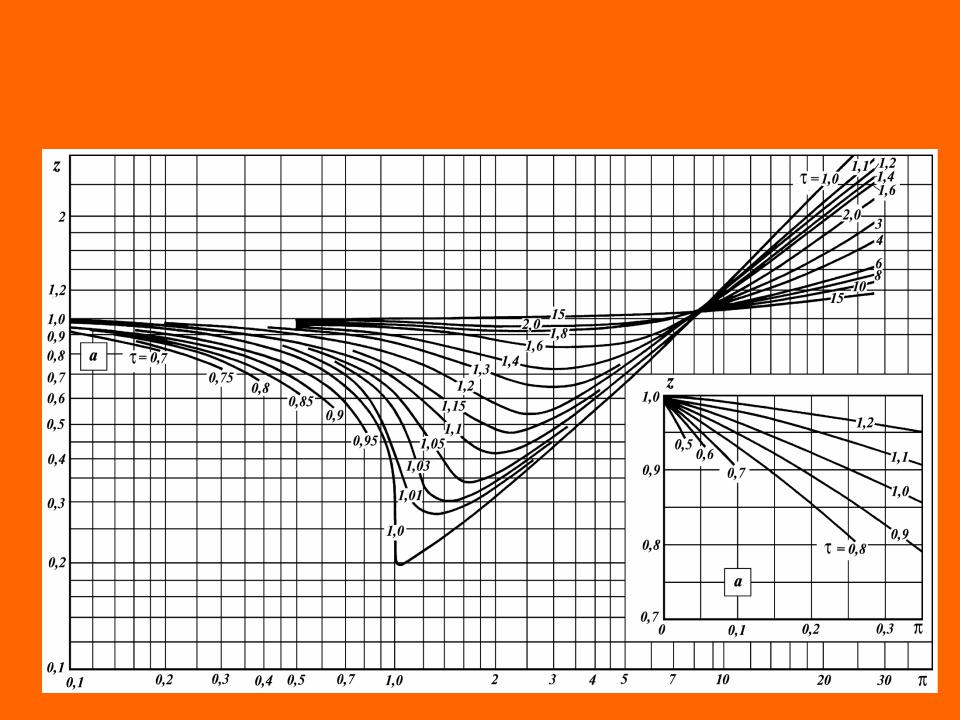
Зависимость коэффициента сжимаемости углеводородных газов

Смеси жидкостей, паров и газов
Смесью называется термодинамическая система состоящая из n-компонентов химический не взаимодействующих между собой веществ.
Массовой концентрацией или массовой долей mi
называется отношение массы компонента к массе всей смеси
|
G |
G |
|
m = |
i |
= |
i |
|
n |
||
|
G |
||
|
åGi |
||
|
|
|
i=1 |

Молярной концентрацией или молярной долей i-го компонента ri называется отношение количества
киломолей этого компонента Gi к общему числу
киломолей смеси
r = |
|
G |
i |
= |
|
G |
i |
||||
|
|
|
|
|
n |
||||||
|
|
|
|
||||||||
i |
G |
||||||||||
|
|
å |
|
i |
|||||||
|
|
G |
|||||||||
|
|
|
|
|
|
|
i=1 |
||||
