
- •Билет № 1.
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •28)Углеводы. Классификация. Функции
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •24) Общее представление о липидах. Классификация липидов
- •1) Структурная
- •2) Запасная (энергетическая)
- •3) Защитная
- •4) Важный компонент пищевого сырья
- •2 Классификация липидов
- •2.12. Химическое равновесие. Обратимые и необратимые реакции
- •2.13. Константа химического равновесия. Прогнозирование смещения химического равновесия
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •53. Кооперативное связывание кислорода гемоглобином, эффект бора, влияние 2,3-бфг на сродство гемоглобина к кислороду. Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
- •18) Альдегиды, особенности строения карбонильный группы. Химические свойства альдегидов: образование
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •16) Спирты и фенолы. Многотомные спирты.
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •20. Химические свойства карбоновых кислот с участием карбоксильной группы: декарбоксилирование, образование солей, амидов, ангидридов, галогенгидридов, сложных эфиров.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •27)Особенности растворов вмс: набухание и растворение
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •Полисахариды. Классификация. Функции
- •1. Клеточная локализация и функция
- •2. Строение миоглобина
- •3.Связывание гема с апомиоглобтом
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •17. Механизм действия буферных систем. Буферные системы крови
- •48)Вторичная структура белка
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •54)Классификация сложных белков
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25)Физико-химические свойства белков
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
20. Химические свойства карбоновых кислот с участием карбоксильной группы: декарбоксилирование, образование солей, амидов, ангидридов, галогенгидридов, сложных эфиров.
В отличие от спиртов и фенолов, карбоновые кислоты обладают заметной кислотностью, хотя и значительно уступают по силе минеральным кислотам, таким, как фосфорная или соляная. Поскольку кислотность напрямую связана с легкостью отщепления протона, сила кислоты увеличивается, если отрицательный заряд аниона лучше компенсируется отрицательными индуктивными или мезомерными эффектами
Получение
ангидридов кислот.
Ангидриды кислот можно рассматривать
как продукты дегидратации двух молекул
кислоты. При отнятии воды от карбоновых
кислот (которое удается осуществить
только при помощи фосфорного ангидрида
Р2О5) можно получать смешанные и
моноангидриды:
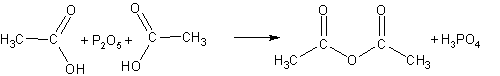
Другой способ получения ангидридов- реакция солей карбоновых кислот с галогенангидридами кислот:
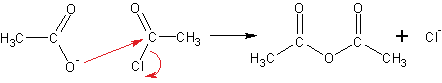
Уксусный ангидрид- жидкость, кипящая при 140 оС, обладающая неприятным резким запахом. Ангидрида муравьиной кислоты не существует.
Образование амидов
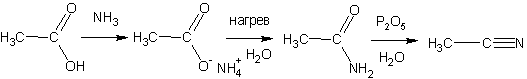
Получение галогенангидридов кислот
Хлорангидриды кислот получают классическими реакциями замены гидроксильной группы на галоген (так же, как и в случае со спиртами):
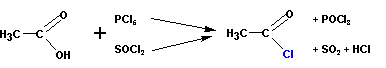
Или при реакции соли карбоновой кислоты с хлористым сульфурилом:
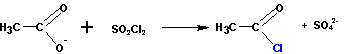
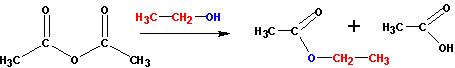
Получение сложных эфиров
Этерификация кислот спиртами приводит к сложным эфирам с переменным успехом.
Реакция протекает в кислой среде и обратима. Роль кислоты заключается в активации (усилении реакционной способности) карбоновой кислоты (но не спирта!) путем протонирования:
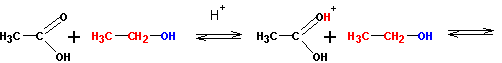
Протонированная по атому кислорода карбонильной группы кислота атакуется атомом кислорода спирта (на нем имеются две неподеленные пары электронов):
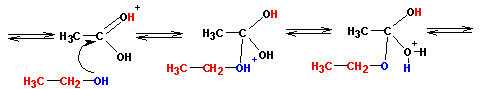
Реакция завершается переносом протона, отщеплением воды и, наконец, отщеплением самого протона (регенерация катализатора):

Поскольку все стадии этерификации обратимы, для увеличения выхода приходится отгонять из реакционной смеси продукт (эфир) или связывать воду. Обратите внимание, что в составе сложного эфира присутствует атом кислорода от спирта, а не от кислоты. Успех реакции в значительной степени зависит от строения спирта и кислоты. Так, наиболее успешно реакция протекает с короткими молекулами спиртов и кислот. Важное значение имеет то, чтобы ни спирт, ни кислота не были стерически затруднены у реакционных центров (гидроксильной и карбоксильной групп). Скорость реакции этерификации кислот спиртами растет с понижением значения рН до определенной величины, а с дальнейшим снижением рН опять падает. Связано это со все возрастающей степенью протонирования (по атому кислорода) молекулы спирта и, соответственно, потерей ей реакционной способности (атаковать карбонильный углерод).
Другим удобным способом получения сложных эфиров является реакция солей карбоновых кислот с галоидными алкилами:

При наличии ангидридов и галогенангидридов кислот наиболее удобно получать эфиры из них, так как эти реакции идут практически полностью (и необратимо). С галогенангидридами спирты реагируют по схеме:
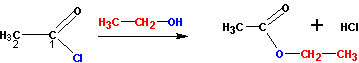
С ангидридами реакции идут немного менее активно, но гораздо лучше, чем с самими кислотами. В реакцию берут спирт и ангидрид кислоты:
Билет № 17
