
- •Часть 1
- •5. Определение твердости металлических образцов км по методу Польди
- •Лабораторная работа № 1
- •3. Атлас макро - и микроструктур металлов и сплавов. Болховитинов н.Ф., Болховитинова е.Н. − Москва: Машгиз, 1959. - 88 с
- •Лабораторная работа № 2
- •Лабораторная работа № 3
- •Контрольные вопросы по теме работы (устные ответы)
- •Лабораторная работа № 4
- •3. Гост 1215-79. «Отливки из ковкого чугуна. Общие технические условия».
- •4. Гост 1585-85. «Чугун антифрикционный для отливок. Марки».
- •5. Гост 7293-85. «Чугун с шаровидным графитом для отливок. Марки».
- •Лабораторная работа № 5
- •3. Типовой химический состав нелегированных сталей.
- •4. Влияние массовой доли углерода с, % на показатели механических свойств стали.
- •5.Влияние постоянных примесей.
- •7. Примеры прочтения (расшифровки) марок нелегированных сталей.
- •9. Новые понятия – термины:
- •Порядок выполнения работы.
- •1. Гост р 54384-2011 - Сталь. Определение и классификация по химическому составу и классам качества.
- •Лабораторная работа № 6
Контрольные вопросы по теме работы (устные ответы)
1) Что такое наклеп (нагартовка)?
2) Какой базовый фактор изменяется при наклепе?
3) В каких случаях наклеп вреден?
4) Что такое текстура металла?
5) Как изменяются свойства в результате наклепа?
6) Какие способы применяют для поверхностного упрочнения деталей?
7) Что такое дорнование? выглаживание?
8) Какой материал считается в настоящее время самым прочным?
9) Как изменяется шероховатость (чистота поверхности) в результате наклепа разными способами?
10) Как снять наклеп?
11) Для чего отбивают косу перед сенокосом?
12) Почему твердость металла детали, изготовленной штамповкой, во многих местах выше твердости заготовки?
13) К какому виду деформации – холодной или горячей – надо отнести: а) прокатку олова при комнатной температуре (tпл Sn = 232 ºС); б) деформацию стали при 400 ºС (tпл стали = 1500 ºС).
14) Как повлияет на значение твердости, найденной методом Бринелля, повторное измерение в том же месте или поблизости от него?
15) Можно ли создать значительное упрочнение свинца, если его подвергнуть деформации при комнатной температуре? (tпл Рb = 324 ºС.)
16) Как изменятся свойства стали обшивки корпуса судна в районе вмятины в сравнении с соседними участками?
17) Почему нельзя использовать по назначению стальные гвозди, найденные на месте пожара?
При недостатке места для эскизов и таблиц допускается приложение к отчету дополнительного листа.
Приложение № 3.2
Таблица
Соответствия чисел твёрдости HRB и HB [3]
а) в) с)
HRB |
HB |
34,7 |
75 |
36.2 |
76 |
37,4 |
77 |
38,4 |
78 |
39.1 |
79 |
40,1 |
80 |
40,8 |
81 |
42,0 |
82 |
42,5 |
83 |
43,0 |
84 |
44,2 |
85 |
45,0 |
86 |
45,7 |
87 |
46,4 |
88 |
47,2 |
89 |
47,9 |
90 |
49,4 |
92 |
HRB |
HB |
57,3 |
103 |
59,4 |
106 |
61,0 |
109 |
62,0 |
111 |
63,3 |
113 |
64,6 |
115 |
66,4 |
118 |
67,0 |
120 |
68,5 |
122 |
70,0 |
125 |
71,0 |
127 |
72,2 |
130 |
74,4 |
135 |
76,3 |
140 |
78,1 |
144 |
79,5 |
148 |
80,8 |
152 |
HRB |
HB |
81,9 |
156 |
83,2 |
160 |
84,0 |
156 |
85,0 |
166 |
86,1 |
170 |
87,1 |
171 |
88,0 |
170 |
89,5 |
181 |
91,5 |
190 |
93,4 |
200 |
95,0 |
209 |
96,7 |
219 |
98,1 |
228 |
99,5 |
238 |
100,0 |
229 |
101,0 |
235 |
102,0 |
241 |
|
|
Вместо таблицы можно использовать формулу, приведенную в работе [6]:
HB = 60 [(HRB / 70)3 + 1]
Лабораторная работа № 4
Тема: «Изучение диаграммы состояния системы сплавов железо – углерод»
Цель лабораторной работы – изучить диаграмму состояния системы сплавов железо – углерод, класси-
фикацию сплавов этой системы, фазовый состав и превращения в сплавах в функции температуры, усвоить все соответствующие термины и определения.
1. Сплавы и системы сплавов – основные понятия и определения.
Сплавы – это металлические конструкционные материалы (КМ), получаемые при совместном расплавлении и последующем затвердевании двух и более исходных веществ, называемых компонентами.
Пример: Выберем в качестве компонентов медь (Cu) и никель (Ni). Изменяя концентрацию, иначе – массовое соотношение компонентов в процентах, можно получить бесчисленное множество сплавов меди с никелем. Это бесчисленное множество в совокупности называется системой сплавов, в данном примере – системой медно-никелевых сплавов. Сплавы, образованные двумя компонентами, называются бинарными. В зависимости от строения сплавы подразделяются на три типа: механические смеси, твердые растворы и химические соединения. В механических смесях каждый компонент сохраняет свое кристаллическое строение. В твердых растворах только один компонент сохраняет свою кристаллическую решетку, а атомы второго компонента размещаются внутри нее (твердые растворы внедрения и замещения). В случае химического соединения ни один из компонентов не сохраняет свою кристаллическую решетку, образуется новая кристаллическая решетка.
Некоторые металлы (Fe, Ti, Zr, Ca, Co и др.) в разных температурных интервалах имеют различную
кристаллическую решетку. Это явление носит название полиморфизма. Вместе с тем существует понятие
аллотропии. Аллотропия − существование одного и того же химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам, − так называемых аллотропных модификаций. Понятие аллотропии используют преимущественно в отношении неметаллов при нормальной температуре. Например, алмаз, графит, фулерен, графен – суть аллотропные модификации угдерода (С).
2. Диаграммы состояния.
Каждый из множества сплавов конкретной системы имеет свою характерную температуру плавления tпл и в зависимости от температуры изменяет свое состояние и фазовый состав. Эту информацию, представляемую в графической форме, отражают так называемые диаграммы состояния системы. Наиболее простыми являются диаграммы состояния систем бинарных сплавов. В таких диаграммах по оси абсцисс откладывают концентрацию в процентах (массовую долю) одного из компонентов, а по оси ординат – температуру. Если компоненты сплавов обозначить как А и В и по оси абсцисс откладывать концентрацию компонента В в процентах (см. рис.2), то, очевидно, что точка 100 на оси абсцисс будет соответствовать чистому компоненту В (В = 100 %), а точка 0 (начало координат, В = 0 % ) – чистому компоненту А (А = 100 %).
Диаграмму состояния конкретной системы сплавов строят по результатам опытов с нагретыми до
расплавления и затем медленно охлаждаемыми образцами сплавов, имеющих разное массовое соотношение
(концентрацию) компонентов. Можно, например, взять 10 образцов – образец компонента А, образец
компонента В и 8 образцов сплавов, в которых компонент В содержится, к примеру, в количестве 10, 20, 30, 40, 50, 60, 70 и 80 %. Медленно охлаждая расплав каждого образца можно определить температуры начала tн и tк конца затвердевания сплава (кристаллизация сплавов в отличие от кристаллизации чистого компонента
происходит в интервале температур, см. рис. 1).
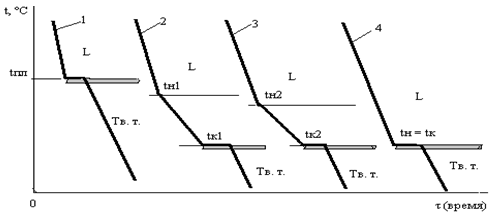
Рис. 1. Опытные кривые охлаждения расплавов: 1 – чистого компонента, 2, 3 – сплавов, 4 - эвтектики
Таким образом, для каждого образца опытным путем находят значения температур tн и tк и, используя
шкалу температур на оси ординат, отмечают на диаграмме соответствующие точки. Соединяя их плавными линиями получают диаграмму состояния системы сплавов двух компонентов (бинарных сплавов).
В зависимости от типа сплавов диаграммы состояния имеют разный вид. На рис.2 схематично представлены диаграммы состояния для сплавов типа «механическая смесь» (а), для сплавов двух компонентов с
неограниченной взаимной растворимостью (б) и сплавов двух компонентов с ограниченной растворимостью
(в). Диаграмма состояния системы сплавов компонентов, образующих химическое соединение, здесь не
рассматривается.
а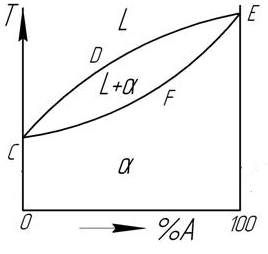 )
б
)
б

в)
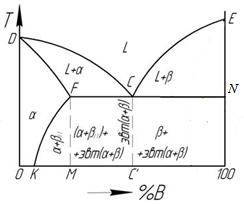
Рис. 2. Диаграммы состояния системы сплавов компонентов А и В (схемы)
а) механическая смесь; б) неограниченная растворимость; в) ограниченная растворимость.
Рассматривая эти диаграммы, можно легко установить, что ординаты точек D и E соответствуют температуре плавления компонентов А и В, а линии DСE и CDE представляют собой геометрическое место точек – температур конца расплавления сплавов, а при охлаждении расплава – температур начала кристаллизации –процесса затвердевания кристаллического тела. Эти линии называются линиями ликвидус. Выше этих линий все сплавы находятся в жидком состоянии (L). Далее, ниже линий FCG, CFE и DFCN жидкая фаза L отсутствует – все сплавы находятся в твердом состоянии. Эти линии называются линиями солидус. Это геометрическое место ординат – температур начала расплавления или окончания кристаллизации при охлаждении расплава. Участки диаграммы, расположенные между линиями ликвидус и солидус, соответствуют переходному двухфазному состоянию – из твердого в жидкое (при нагревании) или из жидкого в твердое (при охлаждении).
Фазой называют часть системы, отделенную от других частей границей раздела. Граница раздела – это поверхность, при пересечении которой резко меняются свойства. В нашем случае границей раздела являются поверхности разнородных зерен, иначе - кристаллов неправильной формы, иногда называемых кристаллитами.
В процессе кристаллизации изменяются и состав жидкости, и количество каждой фазы – по мере охлаждения количество твердой фазы увеличивается, а жидкой уменьшается. Известно так называемое правило отрезков, используя которое можно определить фазовый состав сплава и состав каждой фазы. Для этого через точку, характеризующую состояние какого-либо сплава, например, точку «а» (см. рис. 3), проводят линию, параллельную оси абсцисс до пересечения с линиями, ограничивающими данную двухфазную область. Точки пересечения укажут фазовый состав сплава (А + L), а абсциссы точек пересечения покажут состав фаз. Для примера на рис. 3 фаза А содержит 0 % компонента В (100 % А), а в фазе L (в жидкости) − с ' % B.
М ожно
также
определить долевое соотношение этих
фаз – оно будет обратно-пропорционально
длинам отрезков аb
и ас.
С увеличением температуры по мере
нагрева сплава длина отрезка ас,
отражающая количество твердой фазы,
будет уменьшаться и на линии ликвидуса
будет равна нулю.
ожно
также
определить долевое соотношение этих
фаз – оно будет обратно-пропорционально
длинам отрезков аb
и ас.
С увеличением температуры по мере
нагрева сплава длина отрезка ас,
отражающая количество твердой фазы,
будет уменьшаться и на линии ликвидуса
будет равна нулю.
Правило отрезков в диаграммах состояния бинарных сплавов можно применить только в двухфазных областях. В однофазной области диаграммы имеется лишь одна фаза: любая точка внутри области характеризует ее концентрацию.
Как видно из рис. 2, процесс затвердевания (или рас-
Рис.3. Применение правила отрезков плавления) у всех сплавов на диаграммах а) и в) происхо-
дит в интервале температур, за исключением одного сплава определенной концентрации (абсцисса точки С, а на Рис. 3 −. точки i), который затвердевает или расплавляется как чистый компонент, т.е. не в интервале температур, а при достижении одной определенной температуры, при этом − наименьшей для данной системы сплавов типа «механическая смесь». Такой сплав называется эвтектическим, или эвтектикой, и обычно обозначается буквой Э. Сплавы с меньшей концентрацией компонента В называются доэвтектическими, а сплавы с большей концентрацией компонента В – заэвтектическими.
Как уже отмечалось, в процессе кристаллизации, например, доэвтектических сплавов по мере образования кристаллитов (зерен) компонента А его концентрация в жидкой фазе (в расплаве) уменьшается, а концентрация (массовая доля, %) компонента В, соответственно, возрастает. Когда она достигает эвтектических значений, сразу образуются (зерна) эвтектики. Этим объясняется присутствие эвтектических зерен как в доэвтектических, так и в заэвтектических сплавах. Таким образом, за исключением эвтектики, все сплавы типа «механическая смесь» в твердом состоянии состоят из зерен двух видов – зерен одного из компонентов и зерен эвтектики, т. е. являются двухфазными.
Диаграмма системы сплавов двух компонентов с неограниченной взаимной растворимостью (рис. 2, б)
показывает, что все сплавы этой системы в твердом состоянии однофазны - состоят из зерен альфа-твердого
раствора.
В случае ограниченной растворимости диаграмма (рис. 2, в) несколько усложняется. Как можно видеть, максимальная растворимость ограничивается величиной абсциссы точки F. При большей концентрации
компонента В образуются механические смеси с дополнительной фазой – альфа-твердым раствором в
доэвтектических сплавах. В виду того, что растворимость зависит от температуры – с уменьшением
температуры растворимость уменьшается и растет с увеличением температуры – появляется соответствующая линия FK – линия предельной растворимости компонента В в компоненте А. Ограничительная линия FK показывает, что при охлаждении (уменьшении температуры) сплава с концентрацией компонента В меньшей, чем абсцисса точки F, избыточная часть компонента В выйдет из твердого раствора и образует дополнительную фазу – вторичные кристаллы (зерна) компонента В. Первичные кристаллы (зерна) компонента В образуются при кристаллизации заэвтектических сплавов. Таким образом, на диаграмме видим: две однофазные области (выше линии ликвидус DCE и участок DFK), четыре двухфазные (участки DFC, CEN, под линией FK и заэвтектические сплавы) и одну область трехфазного состояния.
3. Свойства компонентов сплавов железо – углерод.
Железо (Fe) − блестящий светло-серый металл. Имеет: плотность ρ = 7870 кг/м3, температуру плавления 1539 °С, предел прочности при растяжении σb = 200 … 250 МПа (технически чистое железо), предел текучести σт = 120 МПа, относительное удлинение δ = 50 %, твердость по Бринеллю НВ 80. Железо имеет три полиморфных модификации (см. рис. 4):
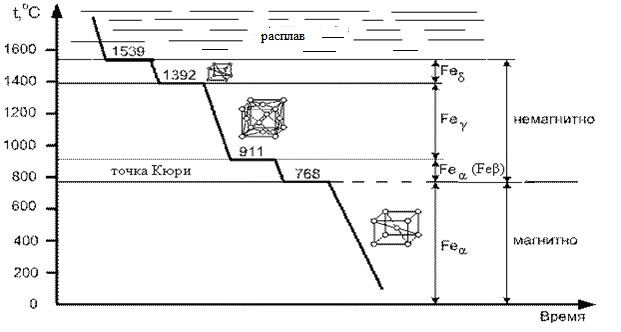
Рис. 4. График охлаждения расплава железа.
– альфа-железо - Fe α −- низкотемпературная модификация с кубической объемо-центрированной (КОЦ) решеткой, существует до 910 °С. Альфа-железо магнитно, но при t = 768 °С (точка Кюри) становится немагнитным. Немагнитное альфа-железо раньше обозначали как бета-железо (Feβ), однако разницы в строении Feβ и Fe α в дальнейшем обнаружено не было;
– гамма-железо Feγ - высокотемпературная модификация железа с гранецентрированной кубической (ГЦК) решеткой существует в интервале 910—1400 °С;
– дельта-железо Feδ − высокотемпературная модификация железа с кубической объемо-центрированной (КОЦ) решеткой, существует в интервале от 1400 °С до температуры плавления.
Температуры полиморфных превращений железа называют критическим точками.
Углерод (С) в макромасштабе имеет две аллотропные модификации – графит и алмаз. На наноуровне
известны фуллерены (глобулы – большие молекулы с 60 и более атомами углерода) и графен – пленка
толщиной в один атом углерода. В железоуглеродистых сплавах углерод находится в химически связанном или свободном состоянии в виде графита.
Свойства графита: цвет серо-черный, плотность 2250 кг/м3, не плавится, имеет хорошую электропроводность, очень малую прочность (при 20 °С σв = 20 МПа) и, соответственно, низкую твердость - НВ 3. Графит имеет слоистое кристаллическое строение. Атомы плотно упакованы в пределах каждого слоя. Расстояние между слоями атомов в 2,4 раза больше, чем между атомами в слое. Связь между атомами в пределах слоя весьма прочная, а между слоями значительно слабее. Поэтому графит легко отслаивается.
При сплавлении с железом очень небольшая часть углерода растворяется в железе, а бóльшая его часть взаимодействует с железом химически, образуя карбид железа, и, кроме того, может находиться в свободном состоянии в виде зерен графита.
Твердый раствор внедрения углерода в гамма-железе называется аустенитом и обозначается буквой А.
Согласно опытным данным максимальная растворимость углерода в Feγ не превышает 2,14 % при температуре 1147 °С.
Твердый раствор внедрения углерода в альфа-железе называется ферритом, обозначается буквой Ф.
Максимальная растворимость углерода в альфа-железе составляет 0,02 % при температуре 727 °С, а при
комнатной температуре (20 °С) около 0,006 %, т.е. растворяется исключительно мало. Больше всего углерода содержится в карбиде железа – 6,67 %. Карбид железа получил название цементита, обозначается буквой Ц.
4.Метастабильная и стабильная диаграммы состояния системы сплавов Fe – C.
Как и все другие диаграмма состояния системы сплавов железо – углерод построена на основе опытных данных и много раз уточнялась. На рис. 5. представлена в упрощенном виде так называемая метастабильная диаграмма этой системы. Метастабильная – значит относительно стабильная и допускающая переход в еще более стабильное (устойчивое) состояние. Метастабильная диаграмма имеет по оси абсцисс две шкалы: концентрации цементита (0…100 %) и концентрации углерода (0…6,67 %). Цементит здесь рассматривается как временный (промежуточный) компонент, который при определенных условиях уступит место термодинамически стабильному графиту и диаграмма железо – графит будет называться стабильной (см. рис. 6).
Диаграмма железо - графит получена в условиях очень медленного нагрева и охлаждения (доли градуса в минуту) и при содержании в сплаве примеси кремния (Si) в количестве 3 …3,5 %. Диаграмму железо – цементит получают в условиях более высоких скоростей нагрева и охлаждения образцов (порядка нескольких градусов в минуту).
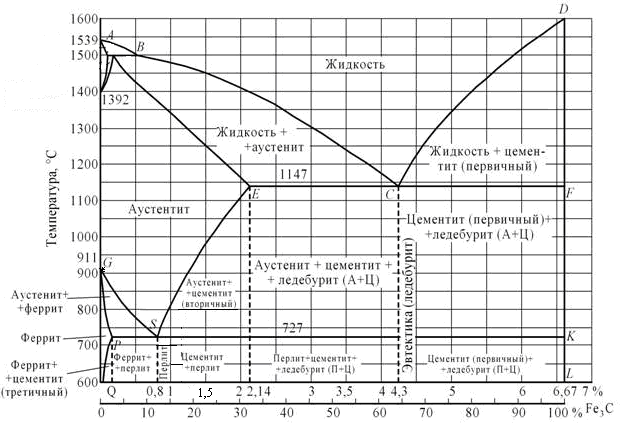
Рис. 5. Метастабильная диаграмма состояния системы сплавов железо – цементит

Рис. 6. Диаграмма состояния системы сплавов железо – графит (стабильная диаграмма)
Сравнивая эти диаграммы видим, что линии E'C'F' и P'S'K' расположены выше линий ECF и PSK, а линия E'S' – левее линии ES. При этом абсцисса точки E оказывается меньше 2,14 ( около 1,96), что позволяет принять среднее значение в 2 %.
Линии и фазы на диаграмме по рис.5.:
АВСD (линия ликвидус - место точек начала кристаллизации) и AHJECF (линия солидус - место точек конца кристаллизации) разграничивают начало и конец первичной кристаллизации, происходящей при затвердевании жидкой фазы при охлаждении сплавов. Линии ES и PQ показывают предельную растворимость углерода соответственно в гамма-железе и альфа-железе. При понижении температуры растворимость уменьшается и избыточный углерод, покидая твердый раствор, образует с железом химическую связь в виде цементита. Цементит, выделяющийся из жидкого сплава, принято называть первичным – Ц1; из аустенита – вторичным –Ц2, а из феррита - третичным.
Две горизонтальные линии ECF и РSК соответствуют началу (концу) двух превращений при постоянной температуре. При 1147 °С (горизонталь ECF) жидкая часть сплава при достижении эвтектической
концентрации углерода (как в точке С) одномоментно превращается в эвтектическую смесь аустенита, состав которого соответствует точке Е, и цементита. Эта фаза получила название ледебурита. При 727 °С (горизонталь PSK) происходит эвтектоидное превращение – образуется эвтектоидная смесь феррита и цементита, называемая перлитом. В отличие от эвтектики, образующейся из жидкости, эвтектоид перлит возникает из твердых фаз. Перлит чаще кристаллизуется в виде чередующихся пластинок феррита и цементита. После специальной термической обработки перлит может иметь зернистую структуру.
Однофазные области диаграммы: жидкий расплав - выше линии ликвидус АВСD; феррит (Ф) – область GPQ, аустенит (А) - область АESG.
Двухфазные области: АCЕ - в равновесии жидкий расплав и кристаллы аустенита, CDF - в равновесии жидкий расплав и кристаллы цементита, GSP - в равновесии кристаллы аустенита и феррита и другие области за исключением сплавов с содержанием углерода 2,14… 4,3 % в твердом состоянии.
Ниже линии PSK (температура 727 ° С) никаких превращений не происходит. Поэтому шкала температур (по оси ординат) из соображений экономии места начинается не с 0, а часто с 400…600 ° С (область концентраций углерода менее 0, 02 % (точка Q) не в счет вследствие малости величин. К тому же масштаб по оси абсцисс для этой показанной на диаграмме области концентраций имеет условный характер).
Стоит обратить внимание и на шкалу концентраций цементита, которая начинается с 0 %. Между тем видно, что в сплавах с содержанием углерода менее 0,8 % цементит как фаза при любой температуре отсутствует. Дело в том, что эта шкала учитывает здесь цементит, входящий в эвтектоидную смесь – перлит.
Все основные линии диаграммы в целом представляют собой геометрическое место критических точек – температур начала (конца) фазовых превращений.конкретных сплавов. Некоторые критические точки имеют условное обозначение: при нагреве – Ас1 (на линии PSK), Асм (на линии ES), Ас3 (на линии GS), Ас2 (точка Кюри); при охлаждении, соответственно, - Аr1 , Аrм и Аr3.
5. Классификация железо - углеродистых сплавов.
Сплавы железа с углеродом, содержащие до 0,02 % С, называют техническим железом. Сплавы железа с углеродом при содержании углерода от 0,02 до 2% носят название нелегированных сталей (от 0,02 до 0,8% - доэвтектоидные стали, от 0,8 до 2 % - заэвтектоидные стали). Сплавы с содержанием углерода около 0,8 % называются эвтектоидными. Сплавы железа с углеродом , содержащие от 2 до 6,67 % С называются чугунами (от 2 до 4,3 % С – доэвтектические, от 4,3 до 6,67 %С - заэвтектические чугуны). Сплавы с содержанием углерода около 4,3 % называются эвтектическими чугунами.
Механические свойства фаз.
- Аустенит - HB = 150…180, δ = 40…50%, немагнитен;- Феррит имеет низкую прочность σв = 200…250 МПа, σ0,2 = 120 МПа, НВ 80…100, высокую пластичность (δ = 30…40 %, ψ = 80 %), магнитен;
- Перлит пластинчатый имеет НВ 180 … 220; σв = 800 МПа, δ = 10 %; зернистый перлит - НВ 160 … 200;
σв = 650 МПа, δ = 20 %;
- Цементит - имеет высокую твердость НВ ~ 800, очень низкую пластичность;
- Ледебурит (эвтектика) - твердая и хрупкая фаза, НВ 600…700.
- Графит – см. п. 4.
Фазовые превращения в сплавах системы Fe – C.
Процесс кристаллизации - протекающий при охлаждении процесс перехода кристаллического тела из
жидкого состояния в твердое – сопровождается различными превращениями.
Для построения кривой охлаждения конкретного сплава надо на оси абсцисс диаграммы состояния найти этот сплав, т.е. процентное содержание (концентрацию) углерода в сплаве, и из найденной точки восстановить перпендикуляр. Линия перпендикуляра пересечет линии диаграммы состояния. Далее надо найти ординаты точек пересечения и использовать их для построения кривой t = f (τ).
В качестве примера рассмотрим превращения при кристаллизации расплава заэвтектического чугуна, содержащего 4,6 % углерода. Из точки 4,6 % на оси абсцисс восстановим перпендикуляр (см. рис. 7.).

Рис. 7. Диаграмма состояния и построение кривой охлаждения расплава заэвтектического чугуна.
Пересечение перпендикуляра с линиями диаграммы дает три точки: 1, 2, и 3. Кристаллизация начинается в точке 1 на линии ликвидус образованием в жидком расплаве кристаллов первичного цементита. При этом расплав обедняется углеродом и при температуре 1147 °С (точка 2) содержит только 4,3%С. При этой
температуре расплав кристаллизуется с образованием ледебурита. При дальнейшем охлаждении из аустенита, входящего в ледебурит, выходит избыточный углерод и образуется вторичный цементит. По достижении температуры 727°С аустенит, содержащий 0,8% С, превращается в перлит (точка 3) с образованием видоизмененного ледебурита. Дальнейшее охлаждение от точки 3' приводит к выделению из феррита, входящего в состав перлита, избыточного углерода с образованием третичного цементита. Таким образом, фазовый состав заэвтектического чугуна при комнатной температуре: Л +ЦI +ЦII. На диаграммах показывают только одну фазу ЦI, так как количество фаз ЦII и Ц3 мизерное.
Порядок выполнения работы:
- Изучить описание.
- Заполнить бланк-форму отчета (см. Приложение № 1).
- Подготовить устные ответы на контрольные вопросы (см. Приложение № 2)
- Завершить отчет и предъявить его преподавателю для проверки.
Список литературы
Материаловедение и технология конструкционных материалов: Учебник для вузов/ Солнцев Ю. П., Веселов В.А., Демянцевич В. П., Кузин А. В., Чашников Д. И.- изд. М.: «МИСИС», 1996. - 576 с.
Дриц М.Е., Москалев М.А. Технология конструкционных материалов и материаловедение. Учеб. Для вузов. –
М.: Высш. шк., 1990. – 447 с.: ил.
3. http://malishev.info/exams/matved/sem2/29/
Приложение № 4.1.
Форма отчета
ГУМРФ им.адм. С.О. Макарова
Кафедра технической эксплуатации флота
