
- •Фитоактивные соединения
- •3.1 Средства воздействия на фотосинтетические процессы
- •3.1.1 Блокаторы транспорта электронов в фотосистеме II
- •3.1.2. Акцепторы электронов фотосистемы I
- •3.1.3. Ингибиторы биосинтеза хлорофилла
- •3.1.4. Ингибиторы биосинтеза каротиноидов
- •3.1.5. Фотодинамические гербициды и противораковые средства
- •3.1.6. Ингибиторы клеточного деления
- •3.1.7 Ингибиторы биосинтеза липидов
- •3.1.8 Ингибиторы образования пластохинона
- •3.1.9 Гербицидные фосфорорганические ингибиторы метаболических превращений
- •3.1.10 Гербициды, нарушающие биосинтез алифатических аминокислот
- •3.2 Гербициды и регуляторы роста растений с фитогормональным механизмом действия
- •3.2.1 Гиббереллины и ингибиторы их образования
- •3.2.2 Синтетические аналоги ауксинов
- •3.2.3 Цитокинины
- •3.2.4 Продуценты этилена
- •3.2.5 Другие регуляторы роста и антидоты гербицидов
3.2.2 Синтетические аналоги ауксинов
Поиски веществ, которые стимулируют рост зеленых частей растений и вызывают, например, фототропизм (поворот растений в сторону света) долгое время были безрезультатными. Для доказательства химической основы фототропизма проводили разные опыты. Например, у растения отрезали верхушечную часть, ставили её разрезом на желатиновый диск и через некоторое время вставляли этот диск в надрез на стебле другого растения. Даже при освещении рассеянным светом в стороне с диском происходило удлинение клеток, вызывавшее наклон растения. Этот опыт исключал участие физических факторов в фототропизме, поскольку только химическое вещество, попавшее в результате диффузии из отрезанной части растения в желатиновый диск, могло вызвать удлинение или усиленный рост контактирующих с диском клеток и связанный с этим наклон стебля. Однако концентрация этого стимулятора роста была настолько мала, что аналитическая техника 30-40-х годов прошлого столетия не была в состоянии определить его строение или даже природу. Вещества с ауксиновой активностью искали среди продуктов жизнедеятельности других представителей живого и это дало результаты. Первое идентифицированное вещество с ауксиновой активностью было обнаружено в моче человека. Им оказалась индол-3-илуксусная кислота, образующаяся при катаболическом превращении триптофана, например, по схеме:
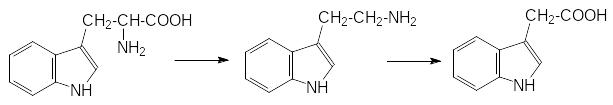
Её до настоящего времени часто называют гетероакусином, то есть ауксином из другого (нерастительного) источника, хотя давно было установлено, что именно индолилуксусная кислота является основным фитогормоном с ауксиновой активностью. Образуясь в точках роста растений, она перемещается до корней, вызывая усиленный их рост и деление клеток камбия у древесной растительности. Способность ауксинов стимулировать развитие корневой системы используется на практике для укоренения черенков растений.
В повышенной концентрации ауксины являются ингибиторами роста, вызывая эффект «апикального доминирования», то есть наиболее активно развивающаяся точка роста – апекс – выделяет больше всего ауксина и тормозит рост ниже расположенных почек. Если точку роста удалить, то начинают расти другие почки, но достаточно быстро выделяется одна как самая активная и рост других почек снова прекращается. Этот механизм фитогормональной регуляции препятствует бесконтрольному ветвлению, хотя в некоторых случаях прищипывание верхней почки позволяет получить более кустистое растение.
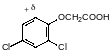
Считается, что ауксиновая активность связана с кислотной группой, на расстоянии 0,55 нм от которой должен находиться атом с дефицитом электронов (+). Этому требованию соответствуют индол-3-илуксусная кислота с частичным положительным зарядом на атоме азота пиррольного структурного элемента, 2,4-дихлорфеноксиуксусная кислота (2,4‑Д) и 2‑метил-4-хлорфеноксиуксусная кислота (2-М-4-Х) с дефицитом электронов в 6‑положении, 2,3,6-трихлорбензойная кислота (+ в 4‑положении) и некоторые другие ароматические и гетероароматические карбоновые кислоты.
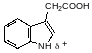

В качестве средства для укоренения черенков и регулятора роста растений применяется гетероауксин, для получения которого разработано несколько способов получения. В частности, это вещество образуется при алкилировании индола гликолевой кислотой при нагревании в водной среде в присутствии гидроксида калия под давлением при температуре около 250°С или при нагревании с полигликолятом в тетралине в соответствии со схемой:

Однако более мягким ауксиновым эффектом отличается 4-(индол-3-ил)масляная кислота (ИМК), образующаяся при алкилировании индола γ‑бутиролактоном по аналогии с предыдущим:

Расстояние, разделяющее электронодефицитный атом азота и карбоксильную группу в индольном структурном элементе у этого соединения не соответствует представленным выше требованиям к веществам с ауксиновой активностью, но метаболизм карбоновых кислот с ощеплением по схеме β-окисления с укорочением цепи на двухуглеродные остатки приводит к образованию из индолилмасляной кислоты ауксиновой индолилуксусной кислоты, чем и объясняется более мягкий и более продолжительный эффект стимуляции роста корней. ИМК является действующим веществом в поступающем в продажу препарате Корневин.
Высокой гербицидной активностью отличается 2,4,5-трихлорфенокси-уксусная кислота (2,4,5-Т, 6-положение свободно), тогда как 2,4,6‑трихлорфеноксиуксусная кислота неактивна. Фитогормональная активность сохраняется у 2-(2,4-дихлорфенокси)пропионовой кислоты, а у 2,4-дихлорфеноксиизомасляной кислоты она отсутствует.
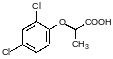
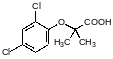
Синтез феноксиуксусных кислот основан на реакции соответствующих фенолятов с натриевой солью хлоруксусной кислоты, известной как реакция Вильямсона. Хлоруксусную кислоту получают хлорированием уксусной кислоты или гидратацией трихлорэтилена в присутствии серной кислоты:
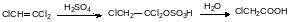
Для получения 2,4-дихлорфенола используют экзотермическую реакцию хлорирования фенола, которую проводят в углеграфитовых теплообменниках. Другая аппаратура в таких условиях слишком сильно корродирует.

При хлорировании фенола на первой стадии образуется смесь о- и п‑хлорфенола, которая при дальнейшем хлорировании с высоким выходом превращентся в 2,4-дихлорфенол. Действием водного раствора гидроксида натрия его переводят в растворимую в воде натриевую соль, реагирующую с хлорацетатом натрия с образованием натриевой соли 2,4-Д:

При синтезе 2-М-4-Х сначала проводят конденсацию о-крезолята натрия с хлорацетатом и после этого хлорируют полученную на первой стадии крезоксиуксусную кислоту. Такая последовательность превращений обусловлена тем, что при взаимодействии о-крезола с хлором наряду с целевым 4‑хлор-о-крезолом образуется много 6‑хлор-о-крезола, который не находит практического применения. Избирательно в 4-положение можно хлорировать о-крезол сульфурилхлоридом (SO2Cl2), но для многотоннажного производства этот способ получения 4‑хлор-о-крезола не годится.
Агрохимические препараты с 2,4-Д и 2-М-4-Х до настоящего времени используются в практике сельского хозяйства. Это связано прежде всего с тем, что к агонистам ауксинов не вырабатывается резистентность. Так, например, до настоящего времени выпускается бутиловый эфир 2,4-Д. Перевод кислоты в эфир значительно повышает гербицидную активность, так как липофильные эфиры легче проникают в наземные части растений, в клетках которых они гидролизуются с образованием активных кислот.
Вместо использовавшихся ранее солей арилоксиуксусных кислот с диметиламином сейчас используют соли с холином. Такие соли более безопасны, поскольку вторичные амины в присутствии содержащихся в почве солей азотистой кислоты превращаются в канцероненные нитрозамины. В частности, соль холина и 2,4-Д входит в состав гербицидного препарата Энлист-Дуо (Enlist-Duo).
Структурные аналги ауксинов проявляют фармакологическую активность. Так, например, лишённые фитоактивности производные феноксиизомасляных кислот проявляют антидиабетические свойства. Соединением с мягкой ауксиновой активностью является о‑крезоксиуксусная кислота:
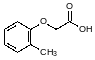
В виде триэтаноламинной соли в смеси с хлорметилсилатраном она входит в состав регулятора роста растений Мивал-Агро (см. с. ). Широкие исследования биологической активности о-крезоксиуксусной кислоты, проводившиеся в Иркутском институте органической химии СО РАН, выявили у неё лекарственные свойства. В настоящее время триэтаноламинная соль о-крезоксиуксусной кислоты входит в состав фармакологического средства Трекрезан, используемого в качестве иммуномодулятора с хорошими адаптогенными свойствами. Трекрезан стимулирует выработку интерферонов, повышает выносливость и устойчивость организма к гипоксии.
Серьезные экологические проблемы были связаны с производством и использованием 2,4,5-Т. Исходным продуктом для этого гербицида является 2,4,5-трихлорфенол, который получали из побочных продуктов синтеза инсектицида линдана, представляющего собой один из пространственных изомеров гексахлорциклогексана. Его неактивные изомеры подвергали термическому дегидрохлорированию, а полученную смесь трихлорбензолов снова хлорировали, получая в основном 1,2,4,5-тетрахлорбензол:
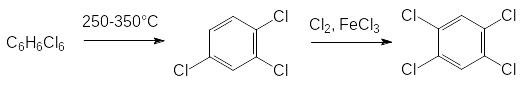
При нагревании в автоклаве 1,2,4,5-тетрахлорбензола с раствором щелочи в метаноле получали 2,4,5-трихлорфенолят натрия, который использовали в производстве 2,4,5-Т и фунгицидного трихлорфенолята меди.
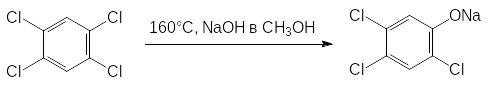
Однако побочным продуктом получения трихлорфенолята натрия является тетрахлордибенздиоксин, образующийся в результате конденсации двух молекул фенолята:
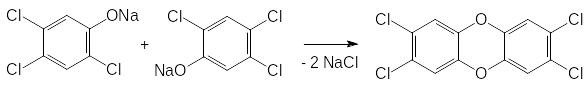
В США были наработаны большие количества 2,4,5-Т, предназначенного для использования в качестве дефолианта под названием Agent orange. Когда в нём были обнаружены опасные концентрации диоксина, стал вопрос о уничтожении наработанных партий этого гербицида, однако сжигание хлорзамещенных ароматических соединений сопровождается образованием ещё большего количества хлорзамещенных дибенздиоксинов. В соответствии с этим, администрацией США было принято решение об использовании Agent orange в ходе боевых действий во Вьетнаме в 1964-1975 гг. для обработки тропических лесов. Деревья без листвы лишали боевые части Северного Вьетнама возможности скрытного перемещения. Кроме того, в районах, которые не подчинялись администрации Южного Вьетнама, американцы обрабатывали рисовые поля очень сильным и стабильным гербицидом с ауксиновой активностью под названием Тордон (пиклорам). Его получают из -метилпиридина (‑пиколина) исчерпывающим хлорированием в жёстких условиях с последующим аминированием по ‑положению и гидролизом по схеме:
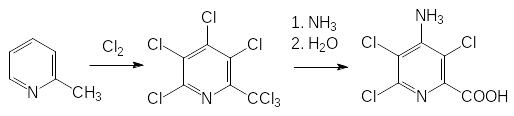
Обработанные этим гербицидом поля при нормах внесения в несколько кг/га не пригодны для выращивания сельскохозяйственных культур в течение нескольких лет.
В ограниченном объеме применяется в качестве гербицида с ауксиновым механизмом действия 2-метокси-3,6-дихлорбензойная кислота (дикамба, Банвел), которую получают из 1,2,4-трихлорбензола по схеме:
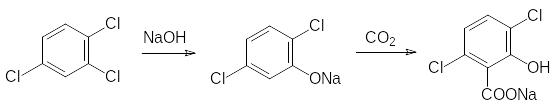
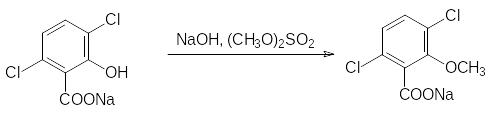
Известно большое число проявляющих ауксиновую активность карбоновых кислот с ароматическими и гетероциклическими фрагментами, но приведенных здесь примеров достаточно для получения представления о их роли в качестве гербицидов и регуляторов роста растений.
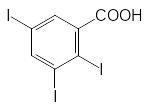
В качестве гербицидов могут также использоваться вещества с антиауксиновой активностью. Одно из первых соединений этой группы, 2,3,5-трииодбензойная кислота, до сих пор используется в исследовательских работах в качестве эталона при изучении блокировки транспорта ауксинов в растениях.
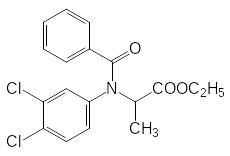
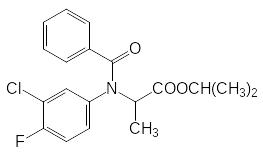
Другая группа антиауксинов была найдена при поиске аналогов арилоксиуксусных кислот. Так, при алкилировании анилинов производными хлоруксусной и хлорпропионовой кислоты образуются азааналоги арилоксиуксусных кислот, но гербицидные свойства у них отсутствуют. Однако при ацилировании основного атома азота в этих соединениях были получены вещества, которые достаточно долго использовались на практике, например, Суффикс и Барнон:
 и
и
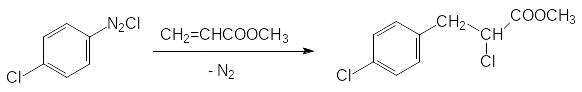
Аналогичной гербицидной активностью обладает также метиловый эфир 2-хлор-3-(4-хлорфенил)пропионовой кислоты (хлорфенпроп-метил), образующийся по реакции хлорида 4-хлорфенилдиазония с метиловым эфиром акриловой кислоты:
Модификация структуры хлорзамещенных феноксипропионовых кислот введением в их молекулу 1,4-фениленового спейсера между 2,4‑дихлорфеноксигруппой и остатком пропионовой кислоты привела к получению нового класса успешных гербицидов, действие которых основано в основном на блокировани биосинтеза липидов (см. с. ).
