
- •Химия и токсикология агрохимических препаратов
- •1 Введение
- •2 Пути поступления в организм ксенобиотиков и меры токсичности
- •3 Фитоактивные соединения
- •3.1 Средства воздействия на фотосинтетические процессы
- •3.1.1 Блокаторы транспорта электронов в фотосистеме II
- •3.1.2. Акцепторы электронов фотосистемы I
- •3.1.3. Ингибиторы биосинтеза хлорофилла
- •3.1.4. Ингибиторы биосинтеза каротиноидов
- •3.1.5. Фотодинамические гербициды и противораковые средства
- •3.1.6. Ингибиторы клеточного деления
- •3.1.7 Ингибиторы биосинтеза липидов
- •3.1.8 Ингибиторы образования пластохинона
- •3.1.9 Гербицидные фосфорорганические ингибиторы метаболических превращений
- •3.1.10 Гербициды, нарушающие биосинтез алифатических аминокислот
- •3.2 Гербициды и регуляторы роста растений с фитогормональным механизмом действия
- •3.2.1 Гиббереллины и ингибиторы их образования
- •3.2.2 Синтетические аналоги ауксинов
- •3.2.3 Синтетические аналоги цитокининов
- •3.2.4 Продуценты этилена
- •3.2.5 Другие регуляторы роста и антидоты гербицидов
- •4 Фунгициды
- •5 Инсектициды
- •5.1 Хлорорганические инсектициды
- •5.2 Инсектицидные органические производные кислот фосфора
- •5.3 Карбаматные инсектициды
- •5.4 Пиретрины и пиретроиды
- •5.5 Неоникотиноиды
- •5.6 Ингибиторы биосинтеза хитина
- •5.7 Агонисты ювенильного гормона
- •5.8 Инсектициды с различными механизмами действия
- •5.9 Репелленты и аттрактанты членистоногих
- •5.10 Метод стерильных насекомых
- •Заключение
5.6 Ингибиторы биосинтеза хитина
Новый механизм инсектицидной активности был выявлен при реализации биорационального подхода к поиску новых биологически активных соединений. При попытке объединить в одной молекуле структурные элементы двух гербицидов с разными механизмами гербицидной активности – диурона (нарушает транспорт электронов в ФС II) и дихлорбенила (блокирует биосинтез целлюлозы), была выбрана структура 2,6‑дихлорбензоилзамещенных мочевин:
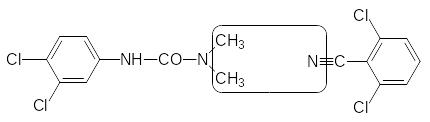
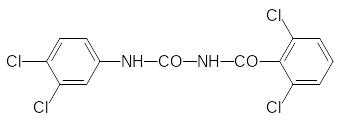
Соединение, представляющее собой 2,6-дихлорбензоилзамещенную мочевину, не показало гербицидной активности, однако в системе агрохимического скрининга любое новое соединение проходит испытания по всем возможным видам активности, включая и испытания на инсектицидную активность. При этом было установлено, что такая тетрахлорзамещённая бензоилфенилмочевина нарушает развитие насекомых на личиночной стадии, препятствуя образованию полноценного панциря в результате блокировки биосинтеза хитина. Активность первого полученного соединения была недостаточна для практического использования, но её усовершенствование привело к получению коммерчески успешных инсектицидов, которые по-прежнему входят в арсенал средств для борьбы с насекомыми вредителями. Резкое увеличение активности было получено при замене 2,6-дихлорфенильного остатка на 2,6-дифторфенильный. В качестве примера можно привести формулы дифторбензурона (препаративная форма Димилин) и пенфлурона:
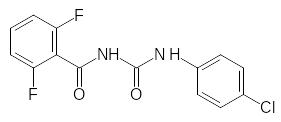
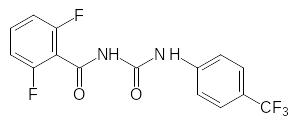
Одним из последних введённых в практику инсектицидов, ингибирующих биосинтез хитина, является Люфенурон, в составе которого гидрофобная компонента представлена гексафторпропильной группой:
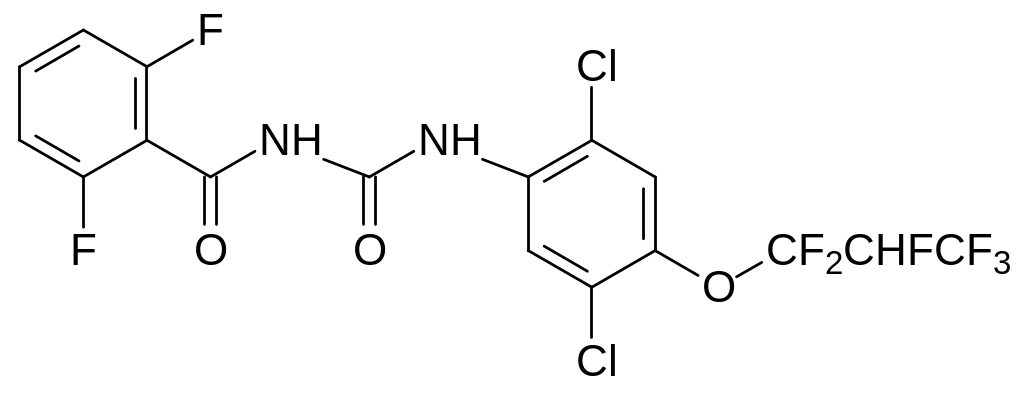
Для синтеза 2,6-дифторбензойной кислоты используют реакцию обменного фторирования. В диметилсульфоксиде при температуре около 180С взаимодействие 2,6-дихлорбензонитрила с безводным фторидом калия приводит к образованию 2,6-дифторбензонитрила:

Гидролиз этого нитрила в кислой среде приводит к образованию 2,6‑дифторбензойной кислоты или её амида.
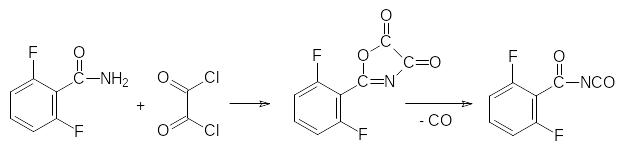
При действии на амиды карбоновых кислот фосгена они снова превращаются в нитрилы, тогда как взаимодействием амидов с оксалилхлоридом (дихлорангидрид щавелевой кислоты) их можно перевести в соответствующие ацилизоцианаты:
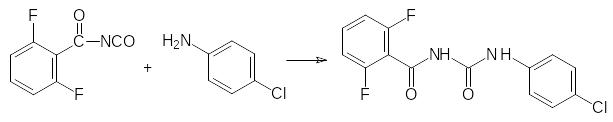
Реакция 2,6-дифторбензоилизоцианата с 4-хлоранилином приводит к образованию дифторбензурона:
Возможны, конечно, и другие способы получения ацилмочевин. Эти малотоксичные соединения применяют, например, при выращивании грибов, которые поражаются личинками мух и комаров. Ингибирующие биосинтез хитина инсектициды могут быть использованы для борьбы с саранчой и в других областях сельского хозяйства.
5.7 Агонисты ювенильного гормона
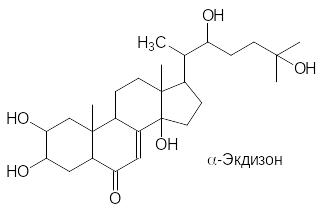
Членистоногие отличаются от других представителей животного мира тем, что их тело заключено в жёсткую оболочку – панцирь (кутикулу). Он выполняет как защитные, так и опорные функции, из-за чего панцирь насекомого часто называют экзоскелетом. Рост насекомого, клеща или ракообразного возможен только после замены старого панциря на новый, более просторный. Процесс линьки контролируется несколькими гормонами. Сама линька запускается экдизоном – гормоном насекомых стероидной природы
Насекомые проходят несколько фаз развития: у высших насекомых с полным превращением из яйца появляется личинка, которая растёт, претерпевая несколько линек и сохраняя личиночный облик, затем она через стадию куколки превращается во взрослое насекомое – имаго. Такие превращения называют метаморфозом. Насекомые с неполным превращением (геми-метаморфозом), например, тараканы, выходят из яйца немного похожими на взрослое насекомое, приближаясь с каждой новой линькой к облику имаго. У них стадии развития от выхода из яйца до превращения в имаго называют нимфами.
На личиночной стадии развития специальные нейросекреторные клетки, отвечающие за рост и развитие насекомых, генерируют гормон, стимулирующий обмен веществ. В переднегрудных железах вырабатывается гормон линьки экдизон. Прилежащие тела выделяют ювенильный гормон, который при линьке не даёт насекомому превратиться в следующую фазу развития, стимулируя рост насекомого на личиночной стадии. После определённого числа линек генерирующие ювенильный гормон клетки железы атрофируются или же просто количество выделяемого ими ювенильного гормона оказывается недостаточным для блокировки метаморфоза выросшей личинки, и существование насекомого на личиночной стадии развития прекращается – включается первая фаза метаморфоза.
В роли ювенильного гормона (ЮГ) выступают четыре вещества, представляющие собой метиловые эфиры эпоксидированных непредельных кислот с цепью из двенадцати атомов углерода с метильными или этильными заместителями. Они получили цифровые обозначения, которые соответствуют порядку их обнаружения. ЮГ III представлен структурой
Наблюдения за развитием насекомых в природе показали, что питание некоторыми растениями приводит личинок к превращению в карликовые формы имаго. Действующие начала, вызывающие такое аномальное развитие, оказались достаточно простыми по строению замещёнными хроменами. В организме насекомого эти вещества эпоксидируются по двойной связи пиранового цикла в железе, отвечающей за выработку ювенильного гормона (приведено превращение одного из таких соединений прекоцена I под действием соответствующей эпоксидазы):
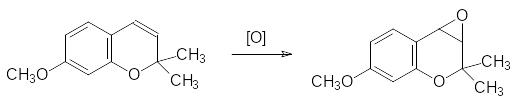
Эпоксидная группа в этом соединении алкилирует ДНК и другие биополимеры, что и приводит к ускоренной гибели клеток продуцирующей ювенильные гормоны железы.
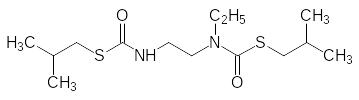
Поиски эффективных ингибиторов образования ювенильных гормонов или их антагонистов оказались безуспешными. В качестве примера можно привести структуры двух совершенно разных по строению соединений, которые оказались только агонистами ювенильных гормонов:

На примере ЮГ III был реализован биорациональный подход к модификации его структуры с целью повышения гормональной активности за счёт увеличения стабильности соответствующих аналогов в реакциях их биотрансформации.
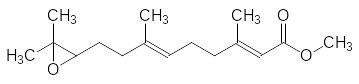
Слабыми местами в молекуле ЮГ III (метиловый эфир 10,11-эпокси-фарнезиловой кислоты) являются эпоксидная группа, двойные связи и сложноэфирная группа, метильный остаток которой легко гидролизуется неспецифическими эстеразами:
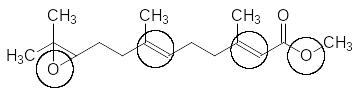
Переход от метилового эфира к этиловому и гидрирование одной из двойных связей приводят к росту ювеноидной активности всего лишь на 20 %. всё ещё сохраняет достаточно лабильную эпоксидную группу. Исключение её из структуры приводит к этиловому эфиру 3,7,11-триметилдодец-2-еновой кислоты с активностью в 4,5 раза превышающей активность этилового эфира 6,7-дигидро-10,11-эпоксифарнезиловой кислоты и в 5,2 раза превышающей активность ЮГ-III:
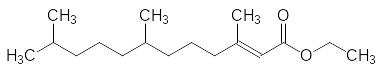
Однако и этиловые эфиры достаточно легко гидролизуются в биологических средах, поэтому на следующем этапе оптимизации структуры был испытан соответствующий изопропиловый эфир. Он в 14 раз превосходит по активности этиловый эфир и в 74 раза более активен, чем ЮГ III:
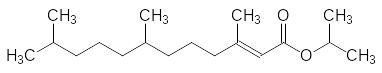
Затем была увеличена цепь сопряжения. Соответствующий изопропиловый эфир 3,7,11-триметилдодека-2,4-диеновой кислоты, получивший название гидропрен, уже можно было использовать в качестве синтетического агониста ювенильных гормонов:
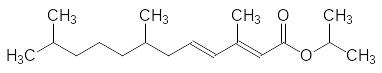
Гидропрен в 3,8 раза активнее эфира с одной олефиновой связью и в 284 раза превосходит по гормональной активности ЮГ-III. Однако сравнение структуры гидропрена и естественного гормона показывает, что этот ювеноид отличается от ювенильного гормона отсутствием нуклеофильной группы у концевого третичного атома углерода. Наиболее удачной заменой эпоксидной группы оказалась метоксигруппа:
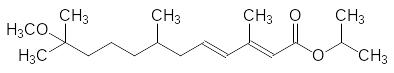
Изопропиловый эфир 3,7,11-триметил-11-метоксидодека-2,4-диеновой кислоты (метопрен) по гормональной активности превосходит гидропрен в 8,6 раза и он в 2430 раз активнее, чем ЮГ-III.
В соответствии с одним из способов получения метопрена в качестве исходного соединения используют цитронеллаль – 3,7-диметилокта-6-еналь, который входит в состав эфирных масел цитрусовых. По двойной связи этого вещества в присутствии кислот присоединяют метанол:
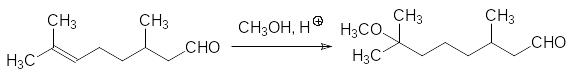
Полученный диметилметоксиоктаналь вводят в реакцию кротоновой конденсации с ацетоном в присутствии гидроксида бария:
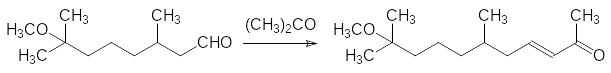
Полученный непредельный кетон реагирует с изопропиловым эфиром диэтоксифосфорилуксусной кислоты в присутствии трет-бутилата калия по реакции Хорнера с образованием метопрена и калиевой соли диэтилфосфорной кислоты:
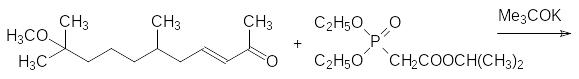
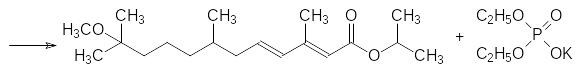
Обработанные метопреном личинки насекомых не превращаются в имаго. Некоторое время они продолжают активно питаться и расти, а затем, приняв вид «суперличинок», погибают, не дав потомства.
Метопрен не содержит атомов галогенов и ароматических структурных единиц, что делает его очень привлекательным с токсикологической точки зрения. Одна из препаративных форм этого регулятора роста насекомых (название инсектицид к нему даже не подходит) с токсичностью для теплокровных 34600 мг/кг используется для защиты складов с табачной продукцией от специфических вредителей, которые толерантны к содержащемуся в табаке никотину.
Высокой эффективностью отличается агонист ювенильного гормона с карбаматной функциональной группой феноксикарб. Его синтез начинается с реакции гидрохлорида этаноламина с 4‑гидроксидифенилоксидом при нагревании в присутствии фосфорного ангидрида:
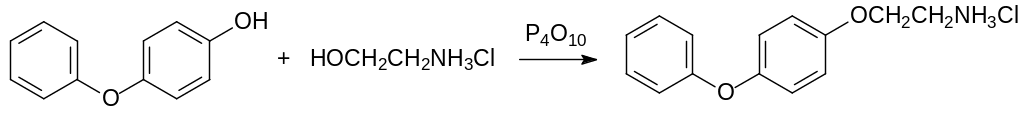
Образовавшийся в этой реакции с выходом около 50 % амин ацилируют этилхлоркарбонатом и получают феноксикарб:
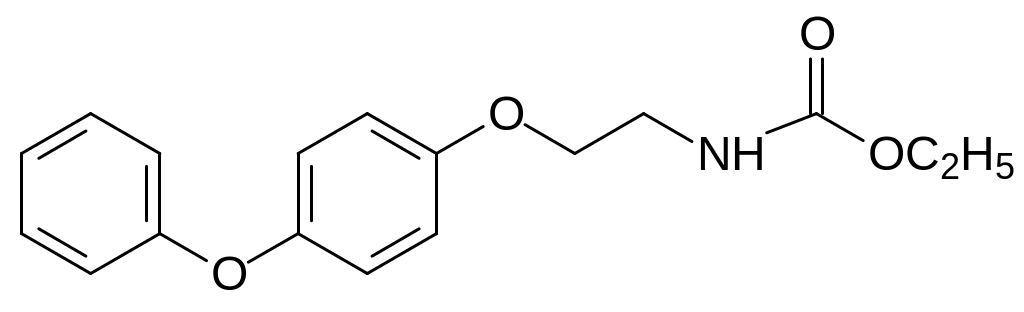
Феноксикарб безопасен для теплокровных (ЛД50 для крыс оставляет более 10 г/кг), полезных насекомых, хищных клещей. Его применяют для защиты древесины и в качестве ларвицида чешуекрылых. Инсектицидные препараты на основе феноксикарба преодолевают приобретённую резистентность к ингибиторам биосинтеза хитина, пиретроидам и фосфорорганическим инсектицидам.
