
- •Claude Bernard
- •Экспериментальная часть.
- •Литература.
- •A Tandem Amino-Cope Rearrangement/Enamine Alkylation Reaction
- •Steven M. Allin; Martin A. C. Button; Stephen J. Shuttleworth
- •Abstract
- •N-alkylation of enaminones
- •James K. Whitesell; Marilyn A. Whitesell
- •Intramolecular Photoarylations of N-(Haloaryl)ethyl β-Enaminones
- •Tammy Tiner-Harding; Patrick S. Mariano
- •Abstract
- •Regioselective control of N-aryl enaminone alkylation
- •Denise Dugat; Daniel Gardette; Jean-Claude Gramain; Bertrand Perrin
- •Thomas Burgemeister; Gerd Dannhardt; Ernst Eibler; Brigitte Paulus; Klaus Ziereis
- •Abstract
- •Ibrahim Chaaban; John V. Greenhill; Mohamed Ramli
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Экспериментальная часть.
Синтез (3-амино-6,6-диметилбицикло[3.1.0]гекс-2-ен-2-ил)метилкетона II:
H C |
CH |
|
|
|
H C |
CH |
H C |
CH |
3 |
3 |
|
|
|
3 |
3 |
3 |
3 |
H |
H |
|
- |
|
H |
H |
H |
H |
O |
|
HO |
O |
|
|
|
|
|
|
|
- |
|
|
II |
|||
|
I |
|
|
|
|
|
||
|
|
|
|
CH |
|
H C |
|
|
|
|
|
|
|
|
|
3 |
|
H C |
NC |
H C |
N |
|
|
|
||
3 |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
O |
NH |
|
|
|
|
|
|
|
|
2 |
К 350 мл спиртового раствора KOH при перемешивании в течение 10 мин. добавили 100 г кетонитрила I. Смесь нагрели и кипятили с обратным холодильником 15 мин., охладили и разбавили водой в три раза. Провели экстракцию смеси метилтретбутиловым эфиром (300, 300, 150 мл), эфирную фазу экстрагировали 1М HCl (900, 500, 300 мл). Полученный водный раствор нейтрализовали 30% аммиаком и экстрагировали tBuOMe (200, 200, 100 мл). Эфирный раствор высушили MgSO4 безв и отогнали растворитель. Выход 79%.
Синтез (3-амино-2-бензил-6,6-диметилбицикло[3.1.0]гекс-2-ил)метилкетона III:
H C |
CH |
|
Cl |
|
|
|
||
3 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
- |
CH |
|
|
|
II |
|
|
|
2 |
III |
|
|
|
|
CH |
+ |
OH |
|
|
||
|
|
|
H C |
|
|
|
||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
NH |
2 |
O |
|
O |
HN |
H C |
CH |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
3 |
|
5 г енаминокетона II растворили в 30 мл бензола, в раствор добавили 15 мл 40% водного раствора NaOH и 0.5 г Bu4N+NO-3, перемешивали несколько минут и постепенно (3 мин.) добавили 10 мл бензилхлорида. Смесь интенсивно перемешивали 1.5 часа при 3540˚С. Водную фазу отбросили, органическую экстрагировали 1М H2SO4 (15, 15, 15 мл). Экстракт нейтрализовали избытком 30% аммиака и экстрагировали метилтретбутиловым эфиром. Эфирный раствор высушили MgSO4 безв и отогнали растворитель. Выход 44%.
Синтез 1-(3-амино-6,6-диметилбицикло[3.1.0]гекс-2-ен-2-ил)этанола:
|
|
H C |
CH |
|
|
|
H C |
CH |
||
|
CH |
|
3 |
|
|
CH |
|
3 |
||
|
III |
|
3 |
|
|
IV |
|
3 |
||
|
2 |
|
|
|
|
2 |
|
|
||
|
|
|
|
|
|
|
|
|
||
H C |
|
|
|
|
NaBH |
|
H C |
|
|
|
3 |
|
|
|
|
4 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
HN |
|
|
|
|
|
HO HN |
|
|
|
4 г алкилированого енаминокетона III растворили в 40 мл этанола. В раствор всыпали 0.6 г NaBH4 и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавили водой и экстрагировали эфиром. Эфирную фазу промыли водой для удаления спирта и вылили в водный раствор 4 г Cu(OAc)2·2H2O. Голубые кристаллы отфильтровали и высушили на воздухе.
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Продукты исследовали методами хроматомасс-спектрометрии, ИК и ЯМР 13C и 1H. ЯМР спектры регистрировали на приборе Bruker DPX-500 (НИОХ СО РАН) в смеси CCl4/CDCl3; химсдвиги отсчитывали: в протонных спектрах – от сигнала остаточных протонов CDCl3 (7.250 м.д.), в спектрах 13С – от сигнала атома углерода CCl4 (96.10 м.д.). ИК спектры записывали на однолучевом спектрометре Bruker Vector 22 (256 усреднений с вычетом фона). Хроматомасс-спектрометрический анализ выполнен сотрудниками НИОХ.
Бензилхлорид и все растворители использовали свежеперегнанными. Точность отсчета температуры ±2°С, времени – ±2 мин. Тонкослойная хроматография выполнена на пластинках “Silufol”® (SiO2 на алюминиевой фольге).
Результаты и их обсуждение.
Из описанных выше реакций С-алкилирования наилучшим образом изучены реакции алкилирования -дикетонов и енаминов. По енаминокетонам, несмотря на их широкое применение в синтезе, данных значительно меньше. Практическая потребность в проведении алкилирования и обнаруженная неоднозначность протекания этой реакции потребовали ее более детального изучения на конкретных соединениях. В качестве алкилирующего реагента был избран бензилхлорид, в условиях реакции не дающий продуктов полиалкилирования (метилирование в тех же условиях может быть четырехпятикратным [14]).
Схема проведенных превращений такова:
|
|
CN |
H C |
CH |
|
|
|
|
|
||
|
|
|
3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
3 |
|
|
|
|
|
H C |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
(b) |
|
|
|
|
|
|
(a) |
|
|
|
|
|
|
H C |
|
|
I |
|
|
|
|
|
|
|
CH |
3 |
CH3 |
|
|
|
|
I I |
|
|
|
|
I I I |
|||
O |
|
|
|
|
|
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
H C |
CH |
|
|
|
3 |
|
H C |
|
|
||
|
|
|
|
|
|
|
|||||
3 |
|
3 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
NH |
2 |
O |
|
O |
HN |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
(d) |
|
|
|
|
|
|
|
|
|
H C |
|
|
|
|
(c) |
|
|
|
|
||
CH |
|
|
|
|
|
|
|
|
|||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
H C |
CH |
|
|
|
|
CH |
|
Cu |
CH2 |
3 |
(OAc)2 |
|
|
|||
|
|
3 |
I V |
3 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
H C |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
NH |
O |
|
|
|
HO HN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
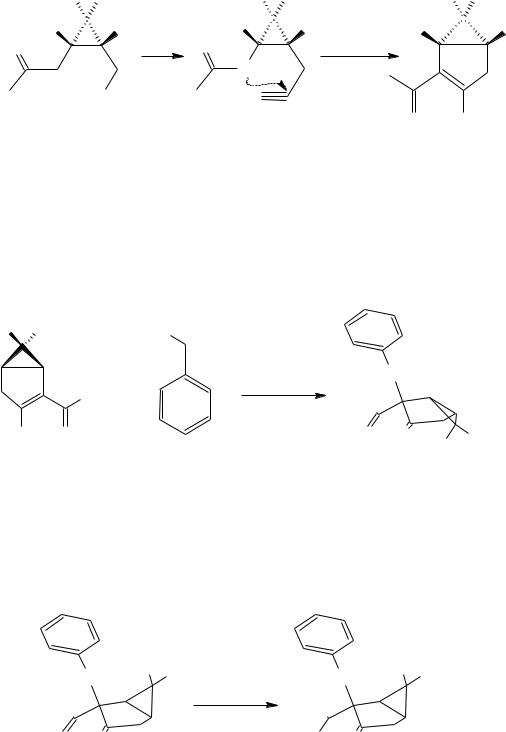
Кетонитрил I (исходное соединение, чистота ~90% (ГЖХ), предоставлен ЛТС НИОХ СО РАН) является производным природного терпена – 3-карена, выделяемого из соснового скипидара:

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
CH |
Cl CH |
NR |
2 |
CH |
3 |
3 |
|
3 |
|
|
NO |
|
|
NOH |
|
NOCl |
NHR |
|
|
|
2 |
|
|
H C |
|
|
H C |
|
|
|
|
|
|
|
3 |
CH |
|
|
|
||
3 |
CH |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
Cl-X = PCl |
, POCl |
, SOCl |
, |
|
H C |
CH |
||
|
3 |
3 |
||||||
|
5 |
|
3 |
2 |
CH |
|
|
|
ï |
-CH PhSO |
Cl |
|
3 |
I |
|
||
|
|
|
||||||
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
H C |
|
|||
|
3 |
|
CH |
|
|
|
|
|
|
|
X |
|
|
3 |
|
|
X |
|
|
- |
|
|
||
Cl |
|
- |
|
|
R |
N |
|
|
|
|
2 |
|
|
|
- |
|
|
|
|
CN |
|
|
||
Результирующее соединение IV используется далее в синтезе оптически активных комплексных соединений, используемых в асимметрическом катализе.
Кетонитрил I представляет собой вязкую темную жидкость, растворимую в органических растворителях и нерастворимую в воде. Реакция (а) проходит гладко и с высоким выходом (~80%) дает продукт конденсации – (3-амино-6,6- диметилбицикло[3.1.0]гекс-2-ен-2-ил)метилкетон II.
Отдельного рассмотрения заслуживает процесс бензилирования соединения II. Эта реакция при комнатной температуре протекает крайне неоднозначно, с выходом целевого продукта менее 10% и образованием трудноразделимой смеси изомерных продуктов и продуктов полиалкилирования. Схема превращений и идентифицированные продукты представлены на следующем рисунке:
H3C CH3
C6H6 / PhCH2Cl / têî ì í
TEBA, 40% KOH |
Ñì åñü |
|
 CH3
CH3
ñëèâ
NH2 O
2 x H2O
HO 2
5M HCl |
Î ðã. |
Î ðã. |
|
ô àçà |
ô àçà |
Ñì åñü
1M H2SO4 200/200/100
Âî äí . ô àçà
 OH-
OH-
Âî äí . ô àçà
Î ðã. ô àçà
Î ðã. ô àçà
-C H ; -C H 6 6 6 12
Î ðã. ô àçà
Âî äí . ô àçà
- 

Âî äí . |
OH- |
|
|
ô àçà |
|
3 |
|
CHCl |
|
хро м ато м асссп ектро м етр
ñëèâ
ЯМ Р- сп ектро м етр
Âî äí . ô àçà
<5%
CH2
Î ðã. |
-CHCl3 |
H3C |
|
|
|
||
ô àçà |
|
|
|
|
|
|
|
|
|
|
O |
HN |
|
CH3 |
|
|
|
|
|
|
|||
|
|
|
|
H3C |
|
||
|
|
|
|
|
|
|
|
Âî äí . |
|
|
|
ñëèâ |
|
|
|
ô àçà |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
CH3 |
|
Cl |
|
|
|
|
|
|
|
|
CH2 |
|
|
|
CH3 |
|
|
+ |
H3C |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
O HN |
H3C |
CH |
|
NH |
O |
|
|
|
3 |
|
|
|
|
|
+ |
O |
|
|
+ ... |
|
|
|
|
|
|
|
|
|
|
H3C CH3
CH3 <10%
NH O
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
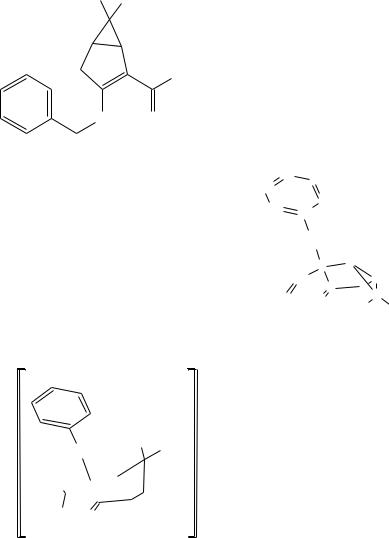
Показанные на схеме процессы обладают повторяемостью – по данным тонкослойной хроматографии в продуктах нескольких проведенных реакций набор компонентов один и тот же. Выходы выделенных веществ тоже примерно одинаковы. Спектры ядерного магнитного резонанса N-алкилированого продукта имеются в Приложениях. Его выход составляет 10%, но (!) – зимой. В тех же реакциях, осуществленных летом, продукт N- алкилирования зафиксирован не был.
Предположение о связи направления алкилирования с температурой реакционной смеси (а в методике указана комнатная температура) подтвердилось – проведение реакции при 35ºС дало в качестве преобладающего продукта (с выходом ~60%) целевой С-замещенный енаминокетон, алкилирование прошло так, как описано в “летней” методике. Попытки дальнейшего повышения температуры пока не предпринимались.
Полученный (3-амино-2-бензил-6,6-диметилбицикло[3.1.0]гекс-2-ил)метилкетон III был введен в реакцию с избытком боргидрида натрия для восстановлния карбонильной группы в спиртовую.
Точный состав и строение комплекса IV неизвестны – парамагнитный ион меди II препятствует получению спектров ЯМР, по данным ИК-спектра что-либо определенное сказать затруднительно. Сводка полученных характеристик соединений дана ниже:
H3C |
CH |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
1H NMR: 7.27; 7.25; 7.24; 7.18; 7.16; 7.14; 4.51; 4.30; 4.29; 3.55; 2.67; |
|||||||||||
|
2.65; |
2.63; |
2.61; |
2.32; |
2.28; |
2.05; |
1.85; |
1.84; |
1.83; |
1.83; |
1.03; |
1.01; |
|
0.73 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 13C NMR: 193.58; 167.40; 138.11; |
128.49; |
128.06; 127.14; 126.36; |
||||||
|
|
106.71; 76.65; 34.11; 27.82; 25.98; 22.51; 20.74;13.44 |
||||||||
|
NH |
O |
|
|
|
|
|
|
|
|
1-[3-(бен зилам ин о )-6,6-дим етилбицикло [3.1.0]гекс-2-ен -2-ил]м етилкето н |
|
|
||||||||
Carbon No. |
Chem. Shifts |
13 |
15 |
|
|
|
|
|
|
|
1 |
33.46 |
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2 |
21.85 |
|
|
|
|
|
|
|
|
|
|
|
14 |
|
|
|
|
|
|||
3 |
35.22 |
10 |
|
|
|
|
|
|
||
|
12 |
|
|
|
|
|
|
|||
4 |
184.78 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
5 |
61.88 |
|
|
CH2 |
|
|
|
|
|
|
6 |
19.83 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
7 |
27.16 |
|
|
9 |
|
|
|
|
|
|
8 |
27.16 |
|
|
|
1 |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|||
9 |
46.78 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
10 |
127.93 |
H3C16 |
|
|
|
2 |
|
|
||
11 |
129.89 |
|
17 |
4 |
|
3 |
|
|
|
|
|
|
|
|
6 |
|
|
||||
12 |
135.08 |
O HN |
|
|
|
|
|
|||
|
H C |
|
CH |
|
||||||
13 |
126.87 |
|
|
|
|
|
|
|||
14 |
127.93 |
|
|
|
|
3 |
7 |
|
8 |
3 |
15129.89
16209.36
17 |
28.65 |
1-(3-ам ин о -2-бен зил-6,6-дим етилбицикло [3.1.0]гекс-2-ил)м етилкето н |
||||||||||||||
|
|
|
|
IR: 3417.0; |
3293.6; |
3183.7; |
3061.1; |
3029.4; |
2994.4; |
2955.8; |
2920.0; |
|||||
|
|
|
|
2876.3; |
2359.1; |
1671.0; |
1587.3; |
1494.7; |
1451.8; |
1396.4; |
1332.4; |
|||||
|
|
|
|
1282.6; 1170.9; 1142.7; 1098.5; 1077.1; 1050.1; 1019.2; 948.9; 920.6; |
||||||||||||
|
|
|
|
882.8; 846.7; 800.4; 772.2; 755.2; 739.3; 704.0; 679.0; 636.2; 621.8; |
||||||||||||
|
|
|
|
578.7; 546.1; 488.8; 435.8. |
|
|
|
|
|
|
|
|
||||
Cu |
CH2 |
H3C |
CH3 |
(OAc)2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H3C 

HO HN
2
ди-(O,N)-1-[(1S,5R)-3-ам ин о -6,6-дим етилбицикло [3.1.0]гекс-2-ен -2-ил]этан о ат м еди(II)
Результаты проделанной работы можно суммировать следующим образом:

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
-синтезированы и охарактеризованы спектрально и хроматографически некоторые производные природного терпена 3-карена.
-обнаружена значительная зависимость хода реакции бензилирования (3-амино-6,6- диметилбицикло[3.1.0]гекс-2-ен-2-ил)метилкетона от температуры реакционной смеси. Установлено, что оптимальный выход С-бензилированного производного достигается при t≥35˚C.
-установлен тот факт, что “комнатная” температура – весьма ненадежная характеристика методики синтеза.
