
- •2.1. Видеоэндоскопическая хирургия
- •2.1.1. Видеолапароскопическая хирургия
- •2.1.2. Торакоскопическая хирургия
- •2.2. Интервенционная радиология
- •3.1. Пороки развития
- •3.2. Повреждения органов шеи
- •3.3. Абсцессы и флегмоны
- •3.4. Лимфаденит (специфический и неспецифический)
- •3.5. Опухоли шеи
- •4.1. Методы исследования
- •4.2. Заболевания щитовидной железы
- •4.2.2. Токсическая аденома (болезнь Пламмера)
- •4.2.3. Многоузловой токсический зоб
- •4.2.4. Эндемический зоб (йоддефицитные заболевания)
- •4.2.5. Спорадический зоб (простой нетоксический зоб)
- •4.2.6. Аберрантный зоб
- •4.2.7. Тиреоидиты
- •4.2.8. Гипотиреоз
- •4.3. Опухоли щитовидной железы
- •4.3.2. Злокачественные опухоли
- •4.4. Паращитовидные железы
- •4.4.1. Заболевания паращитовидных желез
- •4.4.1.1. Гиперпаратиреоз
- •4.4.1.2. Гипопаратиреоз
- •5.1. Методы исследования
- •5.3. Повреждения молочных желез
- •5.4. Воспалительные заболевания
- •5.4.1. Неспецифические воспалительные заболевания
- •5.5. Дисгормональные дисплазии молочных желез
- •5.5.1. Мастопатия
- •5.5.2. Выделения из сосков
- •5.5.4. Гинекомастия
- •5.6. Опухоли молочной железы
- •5.6.1. Доброкачественные опухоли
- •5.6.2. Злокачественные опухоли
- •5.6.2.2. Рак молочной железы in situ
- •5.6.2.3. Рак молочной железы у мужчин
- •5.6.2.4. Саркома молочной железы
- •6.1. Методы исследования
- •6.2. Грудная стенка
- •6.2.1. Врожденные деформации грудной клетки
- •6.2.2. Повреждения грудной клетки
- •6.2.3. Воспалительные заболевания
- •6.2.4. Специфические хронические воспалительные заболевания грудной стенки
- •6.2.5. Опухоли грудной стенки
- •6.3. Трахея
- •6.3.1. Пороки развития
- •6.3.2. Травматические повреждения
- •6.3.4. Стенозы трахеи
- •6.3.5. Пищеводно-трахеальные свищи
- •6.3.6. Опухоли трахеи
- •6.4. Легкие. Бронхи
- •6.4.1. Пороки развития бронхиального дерева и легочной паренхимы
- •6.4.2. Пороки развития сосудов легких
- •6.4.3. Воспалительные заболевания
- •6.4.3.1. Абсцесс легкого
- •6.4.3.2. Гангрена легкого
- •6.4.3.3. Хронический абсцесс легкого
- •6.4.4. Специфические воспалительные заболевания
- •6.4.4.1. Туберкулез легких
- •6.4.4.2. Сифилис легких
- •6.4.4.3. Грибковые заболевания легких (микозы)
- •6.4.4.4. Актиномикоз легких
- •6.4.5. Бронхоэктатическая болезнь
- •6.4.6. Кисты легких
- •6.4.7. Эхинококкоз легких
- •6.4.8. Опухоли легких
- •6.4.8.1. Доброкачественные опухоли
- •6.4.8.2. Злокачественные опухоли
- •6.5.1. Травматические повреждения
- •6.5.2. Воспалительные заболевания плевры
- •6.5.2.1. Экссудативный неинфекционный плеврит
- •6.5.2.2. Острая эмпиема плевры
- •6.5.2.3. Хроническая эмпиема
- •6.5.3. Опухоли плевры
- •6.5.3.1. Первичные опухоли плевры
- •6.5.3.2. Вторичные метастатические опухоли
- •7.1. Методы исследования
- •7.2. Врожденные аномалии развития
- •7.3. Повреждения пищевода
- •7.4. Инородные тела пищевода
- •7.5. Химические ожоги и рубцовые сужения пищевода
- •7.6. Нарушения моторики пищевода
- •7.6.1. Ахалазия кардии (кардиоспазм)
- •7.6.2. Халазия (недостаточность) кардии
- •7.7. Рефлюкс-эзофагит (пептический эзофагит)
- •7.8. Дивертикулы пищевода
- •7.9. Опухоли пищевода
- •7.9.1. Доброкачественные опухоли и кисты
- •7.9.2. Злокачественные опухоли
- •7.9.2.2. Саркома
- •8.1. Методы исследования
- •8.2. Повреждения диафрагмы
- •8.3. Диафрагмальные грыжи
- •8.4. Грыжи пищеводного отверстия диафрагмы
- •8.5. Релаксация диафрагмы
- •9.1. Методы исследования
- •9.2. Острый живот
- •9.3. Травмы живота
- •9.4. Заболевания брюшной стенки
- •9.5. Опухоли брюшной стенки
- •10.1.1. Паховые грыжи
- •10.1.2. Бедренные грыжи
- •10.1.3. Эмбриональные грыжи
- •10.1.4. Пупочные грыжи
- •10.1.5. Грыжи белой линии живота
- •10.1.7. Редкие виды грыж живота
- •10.1.8. Осложнения наружных грыж живота
- •10.2. Внутренние грыжи живота
- •11.1. Методы исследования
- •11.2. Пороки развития
- •11.4. Химические ожоги и рубцовые стриктуры желудка
- •11.5. Повреждения желудка и двенадцатиперстной кишки
- •11.6.1.2. Перфорация язвы
- •11.6.1.3. Пилородуоденальный стеноз
- •11.6.1.4. Пенетрация язвы
- •11.7. Острые язвы
- •11.9. Опухоли желудка и двенадцатиперстной кишки
- •11.9.2. Злокачественные опухоли желудка
- •11.9.2.1. Рак желудка
- •11.9.2.2. Саркома желудка
- •11.9.2.3. Лимфома желудка
- •11.9.3. Опухоли двенадцатиперстной кишки
- •12.1. Специальные методы исследования
- •12.2. Пороки развития
- •12.3. Травмы печени
- •12.4. Абсцессы печени
- •12.4.1. Бактериальные абсцессы
- •12.4.2. Паразитарные абсцессы
- •12.5. Паразитарные заболевания печени
- •12.5.2. Альвеококкоз
- •12.5.3. Описторхоз
- •12.6. Непаразитарные кисты печени
- •12.8.1. Доброкачественные опухоли
- •12.8.2. Злокачественные опухоли
- •12.9. Синдром портальной гипертензии
- •12.10. Печеночная недостаточность
- •13.1. Специальные методы исследования
- •13.3. Повреждения желчных путей
- •13.4. Желчнокаменная болезнь
- •13.4.1. Хронический калькулезный холецистит
- •13.4.2. Острый холецистит
- •13.5. Бескаменный холецистит
- •13.6. Постхолецистэктомический синдром
- •13.7. Опухоли желчного пузыря и желчных протоков
- •13.8. Желтуха
- •14.1. Аномалии и пороки развития
- •14.2. Повреждения поджелудочной железы
- •14.4. Хронический панкреатит
- •14.5. Кисты и свищи поджелудочной железы
- •14.6. Опухоли поджелудочной железы
- •14.6.1. Доброкачественные опухоли
- •14.6.2. Злокачественные опухоли
- •14.6.2.1. Рак поджелудочной железы
- •14.6.3. Нейроэндокринные опухоли
- •15.1. Пороки развития
- •15.2. Повреждения селезенки
- •15.3. Заболевания селезенки
- •15.4. Гиперспленизм
- •16.1. Повреждения средостения
- •16.2. Воспалительные заболевания
- •16.2.2. Послеоперационный медиастинит
- •16.2.3. Склерозирующий (хронический) медиастинит
- •16.3. Синдром верхней полой вены
- •16.4. Опухоли и кисты средостения
- •16.4.1. Неврогенные опухоли
- •16.4.2. Тимомы
- •16.4.3. Дизэмбриогенетические опухоли
- •16.4.5. Лимфоидные опухоли
- •16.4.6. Кисты средостения
- •17.1. Специальные методы исследования
- •17.2. Обеспечение операций на сердце и крупных сосудах
- •17.3. Ранения сердца и перикарда
- •17.4. Врожденные пороки сердца
- •17.4.1. Врожденные аномалии расположения сердца и магистральных сосудов
- •17.4.1.1. Стеноз легочного ствола (изолированное сужение легочной артерии)
- •17.4.1.2. Врожденный стеноз устья аорты
- •17.4.1.3. Открытый артериальный проток
- •17.4.1.4. Дефект межпредсердной перегородки
- •17.4.1.5. Дефект межжелудочковой перегородки
- •17.4.1.6. Тетрада Фалло
- •17.5. Приобретенные пороки сердца
- •17.5.1. Стеноз левого атриовентрикулярного отверстия (митральный стеноз)
- •17.5.2. Недостаточность левого предсердно-желудочкового клапана (митральная недостаточность)
- •17.7. Хроническая ишемическая болезнь сердца
- •17.8. Постинфарктная аневризма сердца
- •17.9. Перикардиты
- •17.9.1. Острые перикардиты
- •17.9.2. Выпотные перикардиты
- •17.9.3. Хронические перикардиты
- •17.10. Нарушения ритма
- •17.10.2. Тахикардии
- •18.1. Методы исследования
- •18.3. Врожденные пороки
- •18.4. Патологическая извитость артерий (кинкинг)
- •18.5. Гемангиомы
- •18.6. Травмы артерий
- •18.7. Облитерирующие заболевания
- •18.7.1. Облитерирующий атеросклероз
- •18.7.2. Неспецифический аортоартериит
- •18.7.4. Облитерирующие поражения ветвей дуги аорты
- •18.8. Аневризмы аорты и периферических артерий
- •18.8.1. Аневризмы аорты
- •18.8.2. Аневризмы периферических артерий
- •18.8.3. Артериовенозная аневризма
- •18.9. Тромбозы и эмболии
- •18.9.1. Эмболия и тромбоз мезентериальных сосудов
- •18.10. Заболевания мелких артерий и капилляров
- •18.10.1. Диабетическая ангиопатия
- •18.10.2. Болезнь Рейно
- •19.1. Методы исследования
- •19.3. Повреждения магистральных вен конечностей
- •19.4. Хроническая венозная недостаточность
- •19.4.1. Варикозное расширение вен нижних конечностей
- •19.4.2. Посттромбофлебитический синдром
- •19.4.3. Трофические язвы венозной этиологии
- •19.5. Острый тромбофлебит поверхностных вен
- •19.6. Острые тромбозы глубоких вен нижних конечностей
- •19.7. Окклюзии ветвей верхней полой вены
- •19.8. Эмболия легочной артерии
- •20.1. Заболевания лимфатических сосудов
- •20.1.1. Лимфедема
- •20.1.2. Лимфангиомы
- •21.1. Аномалии и пороки развития
- •21.2. Травмы тонкой кишки
- •21.3. Заболевания тонкой кишки
- •21.3.1. Дивертикулы тонкой кишки
- •21.3.2. Ишемия кишечника
- •21.3.3. Болезнь Крона
- •21.4. Опухоли тонкой кишки
- •21.5. Кишечные свищи
- •21.6. Синдром "короткой кишки"
- •22.1. Острый аппендицит
- •22.1.1. Типичные формы острого аппендицита
- •22.1.2. Атипичные формы острого аппендицита
- •22.1.3. Острый аппендицит у беременных
- •22.1.4. Острый аппендицит у ВИЧ-инфицированных
- •22.1.5. Осложнения острого аппендицита
- •22.1.6. Дифференциальная диагностика
- •22.3. Опухоли червеобразного отростка
- •23.1. Аномалии и пороки развития
- •23.1.1. Болезнь Гиршпрунга (аганглионарный мегаколон)
- •23.1.2. Идиопатический мегаколон
- •23.2. Воспалительные заболевания ободочной кишки
- •23.3. Дивертикулы и дивертикулез
- •23.4. Доброкачественные опухоли
- •23.4.1. Полипы и полипоз
- •23.5. Злокачественные опухоли
- •24.1. Методы исследования
- •24.2. Врожденные аномалии
- •24.3. Травмы прямой кишки
- •24.4. Заболевания прямой кишки
- •24.4.1. Геморрой
- •24.4.2. Трещина заднего прохода
- •24.4.3. Парапроктит и свищи прямой кишки
- •24.4.4. Выпадение прямой кишки
- •24.5. Рак прямой кишки
- •25.1. Острая непроходимость
- •25.1.1. Обтурационная непроходимость
- •25.1.2. Странгуляционная непроходимость
- •25.1.3. Динамическая непроходимость
- •26.1. Брюшина
- •26.1.1. Перитонит
- •26.1.1.1. Абсцессы (отграниченный перитонит) брюшной полости и малого таза
- •26.1.1.2. Туберкулезный перитонит
- •26.1.1.3. Генитальный перитонит
- •26.1.2. Опухоли брюшины
- •26.2. Забрюшинное пространство
- •26.2.1. Повреждение тканей забрюшинного пространства
- •26.2.3. Опухоли забрюшинного пространства
- •26.2.4. Фиброз забрюшинной клетчатки
- •27.1. Гормонально-активные опухоли надпочечников
- •27.1.1. Альдостерома
- •27.1.2. Кортикостерома
- •27.1.3. Андростерома
- •27.1.5. Феохромоцитома
- •27.2. Гормонально-неактивные опухоли
- •28.1. Источники донорских органов
- •28.2. Иммунологические основы пересадки органов
- •28.3. Реакция отторжения пересаженного органа
- •28.5. Трансплантация почек
- •28.6. Трансплантация поджелудочной железы
- •28.7. Трансплантация сердца
- •28.8. Пересадка сердце—легкие
- •28.9. Трансплантация печени
- •28.10. Трансплантация легких
- •28.11. Трансплантация тонкой кишки
- •28.12. Врачебный долг и трансплантология
щеводного сфинктера или механического препятствия. Они часто сочетают ся с ахалазией, эзофагоспазмом, фыжей пищеводного отверстия диафрагмы.
Эпифренальные дивертикулы небольших размеров, протекают бес симптомно и обнаруживаются случайно при эзофагографии с барием. При значительных размерах симптоматика сходна с таковой при грыже пище водного отверстия диафрагмы, ахалазии, диффузном эзофагоспазме, реф- люкс-эзофагите, раке пищевода. Пациенты жалуются на загрудинные боли, дисфагию, регургитацию. Диагноз уточняется при рентгенологическом ис следовании пищевода с барием, эзофагоскопии и выявлении нарушенной функции нижнего пищеводного сфинктера.
Лечение. Бессимптомные и малосимптомные дивертикулы размером до 3 см лечат консервативно. При увеличении дивертикула и появлении дисфагии, болей за грудиной показано хирургическое лечение. Из левосторон него торакотомического доступа дивертикул выделяют и удаляют. Так же как при дивертикуле Ценкера, производят экстрамукозную эзофагомиотомию до места перехода пищевода в желудок для того, чтобы устранить при чины повышения давления в пищеводе. Если имеется грыжа пищеводного отверстия диафрагмы или нарушение функции нижнего пищеводного сфинктера (ахалазия), то одновременно с удалением дивертикула произво дят соответствующие операции по поводу этих заболеваний. При ахалазии экстрамукозную эзофагомиотомию дополняют антирефлюксной операцией по Ниссену или другим аналогичным способом. Операции дают хороший эффект, летальность низкая, осложнения редки.
7.9. Опухоли пищевода
7.9.1, Доброкачественные опухоли и кисты
Доброкачественные опухоли и кисты пищевода наблюдаются редко.
Патологоанатомическая картина. Опухоли по отношению к стенке пи щевода могут быть внутрипросветными (полипообразными) и внутристеночными (интрамуральными). Внутрипросветные опухоли располагаются чаще в проксимальном или дистальном отделе пищевода, внутристеночные — в нижних двух третях его.
По гистологическому строению опухоли делят на эпителиальные (аденоматозные полипы, папилломы) и неэпителиальные (лейомиомы, рабдомиомы, фибромы, липомы, гемангиомы, невриномы, хондромы, миксомы и др.). Наиболее часто встречается лейомиома, развивающаяся из гладких мышечных волокон. Второе по частоте место занимают кисты (ретенционные, бронхогенные, энтерогенные). Кисты представляют собой тонкостен ные образования, содержащие светлую тягучую жидкость. Стенка кисты со стоит из фиброзной ткани с примесью гладких мышечных волокон и хряща. Внутренняя поверхность стенки выстлана мерцательным эпителием при бронхогенной кисте и цилиндрическим или плоскоклеточным — при энтерогенной. Ретенционные кисты располагаются в подслизистой основе пи щевода и образуются в результате закупорки протоков желез. Они никогда не достигают больших размеров.
Клиническая картина и диагностика. Доброкачественные опухоли и кис ты пищевода растут медленно, не вызывают клинических симптомов и об наруживаются случайно при рентгенологическом исследовании. Наиболее частым симптомом является медленно нарастающая на протяжении многих лет дисфагия.
211

Рис. 7.7. Доброкачественные опухоли пищевода. Рентгено грамма.
При интрамуральных опухолях, циркулярно ох ватывающих пищевод, дисфагия может носить по стоянный характер, иногда больные отмечают бо ли, ощущение давления или переполнения за гру диной. При опухолях шейного отдела пищевода, имеющих длинную ножку, может возникать регургитация опухоли в глотку с развитием асфиксии. При изъязвлении полипа или повреждении слизи стой оболочки пищевода, растянутой над большой интрамуральной опухолью, возможны изъязвление и кровотечение, кисты пищевода нагнаиваются. Вследствие сдавления опухолью трахеи, бронхов, сердца, блуждающих нервов могут возникать ка шель, одышка, цианоз, сердцебиение, боли в об ласти сердца, аритмия и другие расстройства. Воз можно злокачественное перерождение доброкаче ственных опухолей и кист пищевода.
Диагноз доброкачественной опухоли пищево да ставят на основании анализа клинической картины заболевания, данных рентгенологиче ского исследования и эзофагоскопии. Для добро качественных опухолей пищевода характерны сле дующие рентгенологические признаки (рис. 7.7): четкие ровные контуры дефекта наполнения, располагающегося на одной из стенок пищевода, сохранность рельефа слизистой оболочки и эла стичности стенок в области дефекта, четкий угол
между стенкой пищевода и краем опухоли. Всем больным с доброкачествен ными заболеваниями пищевода показана эзофагоскопия для уточнения ха рактера образования, его локализации и протяженности, состояния слизи стой оболочки. Биопсию можно производить только при деструкции слизи стой оболочки и при внутрипросветных новообразованиях.
Лечение. Основным методом лечения доброкачественных опухолей явля ется хирургический. Цель операции — удаление опухоли, профилактика возможных осложнений. Опухоли небольших размеров на тонкой ножке могут быть удалены через эзофагоскоп с помощью специальных инструмен тов или разрушены (электрокоагуляция). Внутрипросветныс опухоли на широком основании иссекают с участком стенки пищевода. Интрлмуральные опухоли и кисты пищевода почти всегда удастся энуклеировать без по вреждения слизистой оболочки. Отдаленные результаты операций хорошие.
7.9.2. Злокачественные опухоли
7.9.2.1. Рак
Рак составляет М)—8() % всех заболеваний пищевода. На долю других злокаче< гвенных сю поражений (саркома, меланома, злокачественная пен
ринома и лр.) ПРИХОДИТСЯ около I
>\/
Среди всех злокачественных заболеваний рак пищевода в нашей стране — шестое по частоте заболевание, встречающееся в большинстве случаев у мужчин в возрасте 50—60 лет. Смертность от рака пищевода составляет 6,4 на 100 000 жителей.
Заболеваемость раком пищевода неодинакова в разных районах мира, что объясняется своеобразием питания населения (состав пищи, различные приправы к ней, особенности приготовления), геолого-минералогическими особенностями почвы и воды.
Этиология и патогенез. В развитии рака большую роль играет хрониче ское воспаление слизистой оболочки пищевода вследствие механическо го, термического или химического раздражения. Риск развития рака суще ственно увеличивают курение (в 2—4 раза), злоупотребление алкоголем (в 12 раз), ахалазия, пищевод Баррета, папилломы и рубцовые изменения в пищеводе после ожога едкими веществами.
Предраковым заболеванием считают синдром Пламмера—Винсона (сидеропенический синдром), который развивается преимущественно у жен щин старше 40 лет, страдающих железодефицитной анемией. Возникает ат рофия слизистых оболочек ротовой полости, глоссит, ногти становятся лом кими, ложкообразными. Причиной дисфагии обычно является перемычка в шейном отделе пищевода, хотя нельзя исключить нарушение сократитель ной способности мышц. Для лечения применяют дилатацию пищевода бу жами и коррекцию питания с учетом выявленных дефицитов.
Патологоанатомическая картина. Рак пищевода развивается чаще в мес тах физиологических сужений: устье пищевода, на уровне бифуркации тра хеи, над нижним пищеводным сфинктером. Рак поражает среднегрудной отдел (60 %), затем — нижнегрудной и абдоминальный отделы пищевода (30 %), шейный и верхнегрудной (10 %).
Различают три основные формы рака пищевода: экзофитный (узловой, грибовидный, папилломатозный); эндофитный (язвенный); инфильтративный склерозирующий (циркулярная форма). Бывают смешанные формы роста.
Узловые формы составляют около 60 %, имеют экзофитный рост, пред ставлены разрастаниями, похожими на цветную капусту. Опухоль легко травмируется, распадается и кровоточит. При распаде и изъязвлении узлов макроскопическая картина мало отличается от картины язвенного рака.
Язвенные (эндофитные) формы рака пищевода в начальной стадии пред ставляют узелки в толще слизистой оболочки, быстро изъязвляющиеся. Опухоль растет преимущественно вдоль пищевода, поражая все слои его стенки и распространяясь на окружающие органы и ткани, рано метастазируя в регионарные и отдаленные лимфатические узлы. Местному распро странению рака благоприятствует отсутствие у пищевода серозной оболоч ки. В стенке пищевода на протяжении 5—6 см от края опухоли часто разви вается раковый лимфангит.
Инфильтративные (склерозирующие) формы рака пищевода составляют около 10—15 %. Опухоль развивается в глубоких слоях слизистой оболочки, быстро поражает подслизистую основу и распространяется по окружности пищевода. Разрастаясь, она захватывает все слои стенки пищевода, обтурирует его просвет. В дальнейшем опухоль изъязвляется, возникает перифокальное воспаление.
Супрастенотическое расширение пищевода при раке редко бывает зна чительным, так как опухоль развивается в сравнительно короткий период времени.
Распространение рака пищевода происходит путем непосредственного
213
прорастания в окружающие ткани лимфогенного и гематогенного метастазирования. Сравнительно поздним осложнением является прорастание опу холи в соседние органы с образованием свища между пищеводом и трахеей или бронхом, развитием нагноительных процессов в легких и плевре. При прорастании опухоли в аорту может возникать смертельное кровотечение.
Диссеминация раковых клеток по лимфатическим сосудам в стенке пи щевода может распространяться на 10—15 см от видимой границы опухоли. В связи с этим при резекции пищевода ткань его по линии разреза должна подвергаться срочному гистологическому исследованию. Раковый лимфан гит чаще встречается при локализации процесса в верхней и средней трети пищевода.
Опухоли, расположенные в шейном и верхнегрудном отделах пищевода, метастазируют главным образом в медиастинальные, над- и подключичные лимфатические узлы. Рак нижней трети пищевода метастазирует в лимфа тические узлы, расположенные вокруг пищевода и кардии, забрюшинные лимфатические узлы по ходу чревного ствола и его ветвей. При локализации опухоли в среднегрудном отделе пищевода метастазы распространяются в околотрахеальные, прикорневые и нижнепищеводные лимфатические узлы. Однако при раке среднегрудного отдела пищевода опухоль может метастазировать и в лимфатические узлы в области кардии, по ходу чревного ствола и его ветвей. Поэтому некоторые хирурги рекомендуют операцию при раке пищевода всегда начинать с лапаротомии и ревизии органов брюшной по лости и забрюшинного пространства для того, чтобы произвести лимфаденэктомию узлов вокруг чревного ствола и кардии, определить операбельность. Отдаленные метастазы чаще всего встречаются в печени, реже — в легких, костях и других органах.
Гематогенное распространение рака происходит в поздней стадии забо левания, когда рак из местного заболевания превращается в системное.
В подавляющем большинстве случаев рак пищевода бывает плоскокле точным. Реже (8—10 %) встречаются аденокарциномы, преимущественно при пищеводе Баррета. Аденокарциномы растут также из эктопированной в пищевод слизистой оболочки желудка или из кардиальных желез, имею щихся в нижнем отделе пищевода. Изредка развивается коллоидный рак.
Из других злокачественных опухолей пищевода следует отметить аденоакантому, состоящую из железистых и плоскоклеточных элементов, и карциносаркому (сочетание рака и саркомы).
Международная классификация рака пищевода по системе TNM (1997 г.)
Т — первичная опухоль
Тх — недостаточно данных для оценки первичной опухоли. ТО — первичная опухоль не определяется.
Tis — преинвазивная карцинома (carcinoma in situ).
Tl — опухоль инфильтрирует стенку пищевода до подслизистой основы. Т2 — опухоль инфильтрирует стенку пищевода до мышечного слоя.
ТЗ — опухоль инфильтрирует стенку пищевода до адвентиции. Т4 — опухоль распространяется на соседние структуры.
N — регионарные лимфатические узлы
Nx — недостаточно данных для оценки регионарных лимфатических уз лов.
214
NO — нет признаков метастатического поражения регионарных лимфа тических узлов.
N1 — имеется поражение регионарных лимфатических узлов метаста зами.
М — отдаленные метастазы
Мх — недостаточно данных для определения отдаленных метастазов. МО — нет признаков отдаленных метастазов.
Ml — имеются отдаленные метастазы.
Категории Ml и рМ1 могут быть дополнены в зависимости от локализа ции метастазов в тех или других органах следующими символами: легкие PUL, костный мозг MAR, кости OSS, плевра PLE, печень HEP, брюшина
PER, головной мозг BRA, кожа SKI, лимфатические узлы LYM, другие
отн.
G — гистопатологыческая дифференцировка
Gx — степень дифференцировки не может быть установлена. G1 — высокая степень дифференцировки.
G2 — средняя степень дифференцировки.
G3 — низкая степень дифференцировки.
G4 — недифференцированные опухоли.
В клинической практике иногда удобнее пользоваться делением рака по стадиям по клинико-морфологическим признакам, которые легко можно выразить и по системе TNM.
Стадии рака
I — четко отграниченная небольшая опухоль, прорастающая только сли зистую и подслизистую оболочки, не суживающая просвет и мало затруд няющая прохождение пищи; метастазы отсутствуют.
II — опухоль, прорастающая мышечную оболочку, но не выходящая за пределы стенки пищевода; зачительно нарушает проходимость пищевода; единичные метастазы в регионарных лимфатических узлах.
III — опухоль, циркулярно поражающая пищевод, прорастающая всю его стенку, спаянная с соседними органами; проходимость пищевода значи тельно или полностью нарушена; множественные метастазы в регионарные лимфатические узлы.
IV — опухоль прорастает все оболочки стенки пищевода, выходит за пре делы органа, пенетрирует в близлежащие органы; имеются конгломераты неподвижных, пораженных метастазами лимфатических узлов и метастазы в отдаленные органы.
Клиническая картина и диагностика. Основными симптомами рака пище вода являются ощущение дискомфорта за грудиной при проглатывании пи щи, дисфагия, боль за грудиной, гиперсаливация, похудание.
Начало заболевания бессимптомное (доклиническая фаза). Этот период может длиться 1—2 года. Когда опухоль достигает значительных размеров и начинает суживать пищевод, появляются первые признаки нарушения пас сажа пищи, перерастающие в выраженную дисфагию.
Дисфагия встречается у 70—85 % больных и по существу является позд ним симптомом, возникающим при сужении просвета пищевода опухолью на 2/з и более. Для рака характерно прогрессирующее нарастание дисфагии.
215
Нарушение проходимости пищевода связано не только с сужением его про света опухолью, но и с развитием перифокального воспаления, спазмом пи щевода. В начальном периоде заболевания дисфагия возникает при прогла тывании плотной или недостаточно пережеванной пищи. Больные ощуща ют как бы прилипание ее к стенке пищевода или временную задержку на определенном уровне. Глоток воды обычно устраняет эти явления. В даль нейшем перестает проходить даже хорошо прожеванная пища, в связи с чем больные вынуждены принимать полужидкую и жидкую пищу. Иногда после стойкого периода дисфагии возникает улучшение проходимости пищевода, связанное с распадом опухоли.
Возникновению дисфагии могут предшествовать ощущения инородного тела в пищеводе, чувство царапанья за грудиной, болезненность на уровне поражения, появляющиеся при проглатывании твердой пищи.
Боль отмечается у 33 % больных. Обычно она появляется за грудиной во время приема пищи. Постоянная боль, не зависящая от приема пищи или усиливающаяся после еды, обусловлена прорастанием опухоли в окружаю щие пищевод ткани и органы, сдавлением блуждающих и симпатических нервов, развитием периэзофагита и медиастинита. Причиной боли могут быть метастазы в позвоночник.
Срыгивание пищей и пищеводная рвота (23 % больных) появляются при значительном стенозировании просвета пищевода и скоплении пищи над местом сужения. При раке пищевода, как и при стенозах другой этиологии, развивается усиленное слюнотечение. Обильные кровотечения из пищевода в связи с распадом опухоли бывают редко — при разрушении опухолью стенки крупного сосуда. Общие проявления заболевания (слабость, про грессирующее похудание, анемия) бывают следствием голодания и инток сикации.
При прорастании опухолью возвратных нервов развивается охриплость голоса. Поражение узлов симпатического нерва проявляется синдромом Бернара—Горнера. При прорастании опухоли в трахею и бронхи возникают пищеводно-трахеальный или бронхопищеводный свищи, проявляющиеся кашлем при приеме жидкости, аспирационной пневмонией, абсцессом или гангреной легкого. Вследствие перехода инфекционного процесса с пище вода на окружающие ткани могут развиться периэзофагит, медиастинит, пе рикардит.
Клиническое течение болезни зависит от уровня поражения пищевода. Рак в е р х н е г р у д н о г о и ш е й н о г о о т д е л о в пищевода протека
ет особенно мучительно. Больные жалуются на ощущение инородного тела, царапанье, жжение в пищеводе во время еды. Позднее появляются симпто мы глоточной недостаточности — частые срыгивания, поперхивание, дис фагия, приступы асфиксии.
При р а к е с р е д н е г р у д н о г о отдела на первый план выступают дисфагия, боли за грудиной. Затем появляются симптомы прорастания опу холи в соседние органы и ткани (трахея, бронхи, блуждающий и симпати ческий нервы, позвоночник и др.).
Рак н и ж н е г р у д н о г о отдела проявляется дисфагией, болью в эпигастральной области, иррадиирующей в левую половину грудной клетки и симулирующей стенокардию.
Важнейшими методами диагностики являются рентгенологическое ис следование, эзофагоскопия с биопсией опухоли. В последнее десятилетие появилась возможность эндоскопического ультразвукового исследования, позволяющего определить глубину поражения стенки пищевода и метастазы в лимфатические узлы средостения.
216

Рентгенологическое исследование С контрастированием пищевода взве сью бария выявляет опухоль, ее лока лизацию, длину поражения и степень сужения пищевода, изменения в лег ких и плевральных полостях. Харак терные симптомы рака — дефект на полнения, "изъеденные" контуры его, сужение просвета, ригидность стенок пищевода, обрыв складок слизистой оболочки вблизи опухоли, престенотнческое расширение пищевода (рис. 7.8).
Для определения границ распро странения опухоли на соседние орга ны применяют компьютерную томо графию.
Отсутствие рентгенологических данных при наличии дисфагии или боли при прохождении пищи не по зволяет исключить рак пищевода. Диагноз уточняют с помощью эндо скопического исследования с при цельной биопсией и последующим морфологическим исследованием по лученного материала. Очень ценную информацию при раннем раке может дать эндоскопическое ультразвуковое исследование, позволяющее не толь
ко выявить опухоль, но и определить глубину проникновения ее в стенку пищевода. Эзофагоскопия показана во всех случаях при подозрении на рак пищевода. Начальные формы рака могут выглядеть как плотный белесова тый бугорок или полип. При инфильтративной форме рака отмечают ригид ность стенки пищевода, выявляемую при надавливании на нее концом эзо фагоскопа. При экзофитных опухолях значительных размеров видна бугри стая масса, покрытая сероватым налетом. Поверхность опухоли легко кро воточит при прикосновении. Опухоль вызывает концентрическое или одно стороннее сужение просвета пищевода. Биопсия легко осуществима при эк зофитных опухолях, труднее получить участок ткани для исследования при язвенном и инфильтративном раке. В сомнительных случаях биопсию сле дует повторить.
Цитологическое исследование в сочетании с биопсией в большинстве случаев позволяет подтвердить или отвергнуть диагноз рака.
Дифференциальная диагностика. При раке пищевода следует исключить другие заболевания, сопровождающиеся дисфагией: ахалазию, рубцовые су жения после химических ожогов, доброкачественные стенозы у больных с пептическим эзофагитом, доброкачественные опухоли, туберкулез и др.
Следует исключить также оттеснение пищевода извне опухолями заднего средостения, внутригрудным зобом, аневризмой аорты, увеличенными лим фатическими узлами, заполненным большим дивертикулом. Рентгенологи ческим признаком сдавления пищевода является его смещение. Даже зна чительное увеличение соседних органов длительное время не вызывает дис фагии, так как смешаемость пищевода достаточно велика.
217
Сдавление и нарушение проходимости пищевода могут быть обусловле ны фиброзным медиастинитом (рубцовым изменением клетчатки средосте ния), возникающим после воспалительных заболеваний легких и лимфати ческих узлов средостения.
Эндоскопическое исследование в сочетании с биопсией из разных мест опухоли повышает точность диагностики до 90 %.
Таким образом, план исследования больного при раке пищевода должен включать рентгенологическое исследование с контрастированием пищево да, эзофагоскопию с множественной биопсией, эндоскопическое УЗИ при возможности провести инструмент через суженный участок пищевода, ком пьютерную томографию легких, средостения и печени, ультразвуковое ис следование печени, по показаниям — медиастино- и бронхоскопию.
Лечение. Хирургическое удаление пораженного пищевода является наи более радикальным из имеющихся методов лечения рака.
П о к а з а н и я к операции зависят от распространенности и локализации опухоли, возраста и общего состояния пациента. Операция противопоказа на при отдаленных метастазах, парезе возвратных нервов, прорастании опу холи в трахею или бронхи, тяжелом общем состоянии больного.
Объем хирургического вмешательства — радикальные и паллиативные операции — может быть точно определен только во время операции. Ради кальная операция предусматривает удаление пищевода с одномоментным пластическим замещением его трубкой, выкроенной из большой кривизны мобилизованного желудка, или толстой кишкой. Паллиативные оператив ные вмешательства предпринимают для устранения дисфагии без удаления опухоли.
При л о к а л и з а ц и и р а к а в а б д о м и н а л ь н о м и н и ж н е грудном отделах производят одномоментное оперативное вмешатель ство из левостороннего торакоабдоминального доступа. Он дает возмож ность удаления пищевода, регионарных лимфатических узлов и мобилиза ции желудка. После удаления опухоли призводят пластику пищевода желуд ком, который перемещают в плевральную полость и соединяют пищеводножелудочным анастомозом (рис. 7.9).
При л о к а л и з а ц и и рака в с р е д н е г р у д н о м о т д е л е произ водят правосторонний торакоабдоминальный разрез или отдельно тора кальный, затем абдоминальный разрезы. Этот оперативный доступ дает воз можность мобилизовать пищевод вместе с окружающей клетчаткой и регио нальными лимфатическими узлами. Через абдоминальный разрез создается хороший доступ к желудку и абдоминальному отделу пищевода. Он позво ляет мобилизовать желудок и удалить лимфатические узлы. После удаления пищевода производят одномоментную пластику его мобилизованным же лудком с наложением пищеводно-желудочного анастомоза в плевральной полости (по Lewis) (рис. 7.10).
Недостатком чресплевральных доступов является частота дыхательных осложнений и высокая летальность (15—30 %), опасность расхождения швов анастомоза в плевральной полости и рецидивов рака на уровне ана стомоза, рефлюкс-эзофагит.
В течение последних 20 лет предпочитают производить трансгиатальную резекцию пищевода из абдомииоцервикального доступа без торакотомип (рис. 7.11). Независимо от уровня поражения пищевод удаляют полностью. Для пластики пищевода используют трубку, выкроенную из большой кри визны мобилизованного желудка, или весь желудок, который выводится на шею через заднее средостение и соединяется анастомозом с оставшейся ча стью шейного отдела пищевода. Разрезы делают на шее, кпереди от m.ster-
218
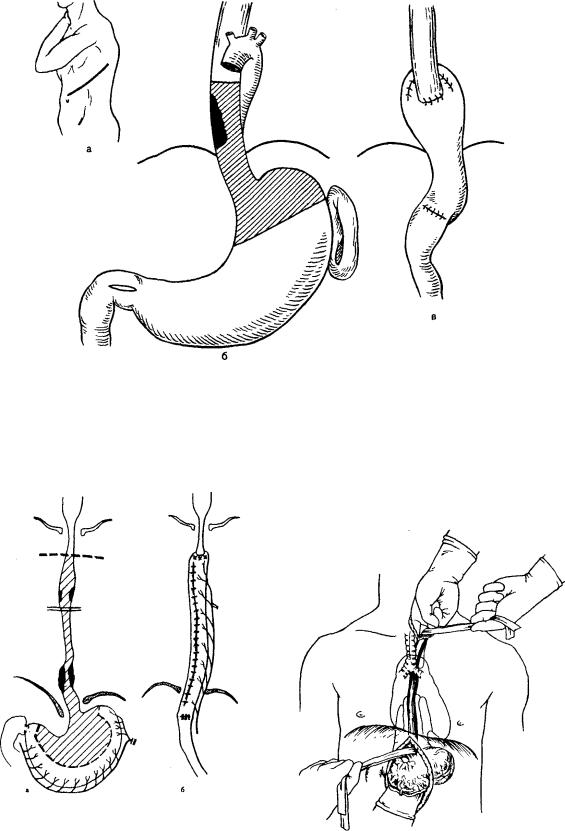
Рис. 7.9. Одномоментная резекция нижней трети пищевода и кардии с эзофагопластикой.
а — операционный доступ; б — уровень резекции пищевода и желудка; в — наложение эзофагогастроанастомоза.
Рис. 7.10. Пластика пищевода изопери стальтической желудочной трубкой.
а — уровень резекции пищевода и выкраива ние из желудка; б — завершение операции эзо фагопластикой.
Рис. 7.11. Цервикально-абдоминальное Уда ление пищевода.
219

|
nocleidomastoideus, а на животе про |
|||
|
изводят верхнюю срединную лапаро- |
|||
|
томию. |
Желудок мобилизуют по |
||
|
обычной методике с перевязкой ле |
|||
|
вой желудочной и желудочно-саль- |
|||
|
никовой артерий и удалением лимфа |
|||
|
тических узлов в области чревного |
|||
|
ствола и кардии. Во избежание спаз |
|||
|
ма привратника производят пилоро- |
|||
|
миотомию. |
Пищевод |
мобилизуют |
|
|
снизу через дифрагмальное отверстие |
|||
|
и сверху — через разрез на шее, затем |
|||
|
пересекают его в шейном отделе и |
|||
|
низводят грудной отдел в брюшную |
|||
|
полость. |
Выкроенную |
из большой |
|
|
кривизны желудка трубку или тол |
|||
|
стую кишку через заднее средостение |
|||
|
перемещают на шею и накладывают |
|||
|
пищеводно-желудочный |
(внеплев- |
||
|
ральный!) анастомоз. Более аккурат |
|||
|
но грудной отдел пищевода может |
|||
|
быть мобилизован с помощью видео- |
|||
|
торакоскопической техники (рис. 7.12). |
|||
|
Для этого в положении больного на |
|||
|
животе в правую плевральную по |
|||
|
лость вводят несколько троакаров, |
|||
|
через которые под визуальным мони- |
|||
Рис. 7Д2. Видеоторакоскопическое удале |
торным контролем с помощью спе |
|||
ние пищевода. |
циальных |
эндоскопических инстру |
||
|
ментов выделяют грудной отдел пи |
|||
|
щевода |
и |
видимые лимфатические |
|
узлы. Пищевод, так же как при трансгиатальном выделении, пересекают на границе с шейным отделом и низводят до диафрагмы. Через разрез на шее мобилизуют и выводят в рану шейный отдел пищевода. Затем поворачивают пациента на спину, производят срединную лапаротомию, мобилизуют абдо минальный отдел пищевода и желудка, удаляют регионарные лимфатиче ские узлы. После удаления пищевода, низведенного до пищеводного отвер стия диафрагмы, производят пластику его трубкой, выкроенной из большой кривизны желудка, или толстой кишкой (см. рис. 7.10). Трансплантат через заднее средостение выводят на шею для наложения анастомоза.
При этом типе операции нет необходимости в травматичной торакотомии, исключается опасность инфицирования плевральных полостей, умень шается частота послеоперационных осложнений. Летальность при этой опе рации составляет 5 %. Пятилетняя выживаемость увеличивается в 2—3 раза и достигает у некоторых хирургов 27 %. Следует заметить, что выживае мость в значительной мере зависит от биологических свойств клеток опухо ли, сопротивляемости организма, тщательности лимфаденэктомии, величи ны кровопотери во время операции.
Двухэтапную операцию Добромыслова—Торека (рис. 7.13) раньше при меняли для удаления рака средиегрудного отдела пищевода. Из правосто роннего чресплеврального доступа удаляли грудной отдел пищевода. Через абдоминальный разрез накладывали гастростому. В последующем (спустя 3—6 мес) создавали искусственный пищевод из толстой или тонкой кишки.
220
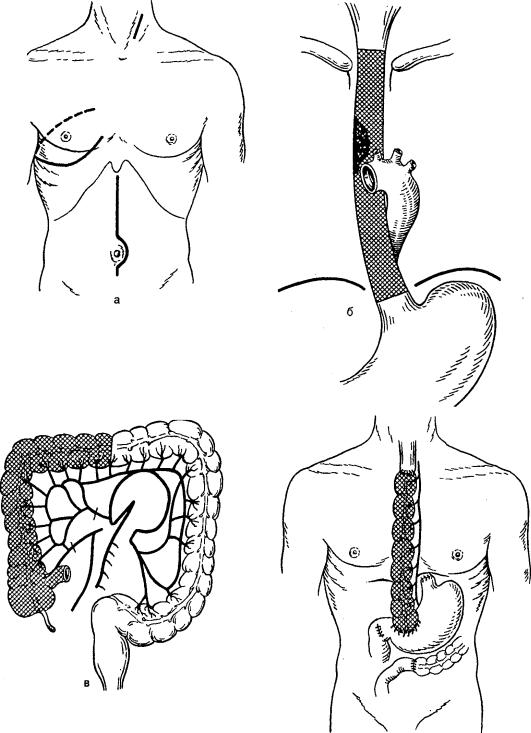
рис. 7.13. Многоэтапная операция Добромыслова—Терека и создание искусственного пище вода из толстой кишки.
а — операционный доступ; б — уровень резекции пищевода; в — выкраивание трансплантата из толстой кишки; г — эзофагопластика.
Трансплантат выводили на шею через подкожный тоннель или ретростернально и накладывали анастомоз с шейным отделом пищевода. В настоящее время эту операцию не применяют, потому что значительная часть больных погибала, не дождавшись второго этапа.
Из числа обратившихся за хирургической помощью лишь 50—60 % под вергаются оперативному вмешательству и только у 30—40 % удается выпол нить резекцию пищевода.
Л е т а л ь н о с т ь после операций на пищеводе колеблется в пределах 3— 15 %. Наиболее частыми причинами смерти при трансторакальных доступах являются расхождение швов анастомоза (36 %), пневмония (37 %), крово течение (9 %), сепсис (6 %) и другие причины (12 %). При удалении пище вода через абдоминоцервикальный доступ с внеплевральным анастомозом на шее послеоперационная летальность и частота осложнений существенно снизились, а пятилетняя выживаемость возросла.
Результаты операций на пищеводе далеко не утешительные. Пятилетняя выживаемость в большинстве статистик и по результатам многоцентрового исследования не превышает 5—10 %. В среднем продолжительность жизни оперированных равна 16,4 мес. Выживаемость зависит от стадии рака. При II стадии она составляет 25 %, при III — только 6 %. Оперативное удаление опухоли нечасто дает излечение больных, но оно улучшает качество жизни оперированных, устраняет один из самых тягостных симптомов — дисфагию.
Разочарование в результатах хирургического лечения рака пищевода за ставило искать комбинированные способы в надежде на улучшение выжи ваемости больных. Для этих целей используют различные комбинации хи рургического лечения с лучевой и химиотерапией. В настоящее время при меняют: 1) предоперационную лучевую терапию; 2) предоперационную и послеоперационную химиотерапию; 3) комбинацию предоперационной лу чевой терапии с химиотерапией в надежде на разный механизм воздействия их на раковые клетки; 4) химиотерапию и лучевую терапию без хирургиче ского вмешательства и 5) только лучевую терапию с использованием раз личных источников облучения, применяя соответствующие схемы и дозы.
П р е д о п е р а ц и о н н о е о б л у ч е н и е проводят с целью уменьшения опухоли, повышения абластичности операции и подавления роста метаста зов в регионарные лимфатические узлы. В известной мере у небольшого числа пациентов это удается. Примерно у 14 % опухоль исчезает, число лимфатических узлов с метастазами сокращается в 3—4 раза, однако, как показали результаты хорошо спланированных рандомизированных исследо ваний, предоперационное облучение в дозе 4000—5000 кГр не улучшает пя тилетнюю выживаемость по сравнению с оперативным лечением без пред операционного облучения.
Х и м и о т е р а п и я . Для химиотерапии до операции и после нее исполь зуют цисплатин, блеомицин, виндезин, 5-фторурацил и другие препараты в различных сочетаниях. Рандомизированное изучение эффективности пред операционной и послеоперационной химиотерапии и сравнение с результа тами только хирургического лечения рака пищевода показали, что предопе рационная химиотерапия дала положительный результат у 47 %, позволила снизить частоту послеоперационных осложнений, однако не оказала ника кого влияния на резектабельность. Пред- и послеоперационная химиотера пия не повлияла на пятилетнюю выживаемость больных.
Указанные виды комбинированной терапии не имеют преимуществ пе ред чисто хирургическим методом лечения. При строгом отборе больных для комбинированной терапии и небольшом числе наблюдений некоторые
222
ШИММИ
авторы показали, что такой подход к лечению рака пищевода оправдан, так как комбинированная терапия рака позволяет угнетать рост раковых клеток за пределами локализации опухоли, повысить 2- и 5-летнюю выживаемость оперированных больных. Поиски новых, более эффективных химиотерапевтических препаратов и способов их применения продолжаются. Возмож но, такие препараты будут найдены. В экспериментальных исследованиях изыскивают возможность применения методов генной инженерии для лече ния рака, однако при клинических испытаниях эффекта от имеющихся ме тодов пока не получено.
П р е д о п е р а ц и о н н а я х и м и о т е р а п и я в с о ч е т а н и и с облу чением не оказалась более эффективной по сравнению с только хирурги ческим методом лечения, хотя у 17 % больных к моменту операции опухоль исчезла, на короткий период уменьшалась или исчезала дисфагия. Резектабельность, послеоперационная летальность и пятилетняя выживаемость в обеих группах больных были практически одинаковыми.
Х и м и о т е р а п и я в с о ч е т а н и и с о б л у ч е н и е м без хирур гического в м е ш а т е л ь с т в а (см. схему) применяется редко, преиму щественно для лечения больных, у которых хирургическое вмешательство невозможно. Более чем у 50 % больных удается получить положительный эффект, опухоль уменьшалась в размерах, в ряде случаев исчезала, пациен ты по критериям TNM переходили в группу ТО. Некоторые из них могли быть оперированы.
Лучевая т е р а п и я без х и р у р г и ч е с к о г о в м е ш а т е л ь с т в а при первой стадии хорошо дифференцированного плоскоклеточного рака, при размерах опухоли менее 5 см и отсутствии циркулярного поражения у 80 % больных дает положительный результат. Опухоль уменьшается в раз мерах, улучшается прохождение пищи по пищеводу у 50—75 % больных. Однако по мере увеличения дозы радиации в процессе лечения у больных развивается лучевой эзофагит с последующим образованием стриктуры. Бо лее чем у половины длительно живущих пациентов возникает необходи мость в дилатации пищевода. Использование источников высоких энергий (тормозного излучения и быстрых электронов), обеспечивающих подведе ние к опухоли пищевода высокой дозы излучения, не дало существенного улучшения результатов. При облучении в дозе 4000—5000 кГр пятилетняя выживаемость колеблется от 3 до 9 %.
Применение лучевой и химиотерапии как дополнение к хирургическому вмешательству оправдано, особенно при соответствующем отборе больных, так как к моменту выявления рака пищевода болезнь принимает системный характер, при котором локальное воздействие на опухоль становится мало эффективным. Хирургическое лечение остается наиболее эффективным ме тодом улучшения качества жизни больных.
К п а л л и а т и в н ы м о п е р а ц и я м относят паллиативные резекции пищевода, обходное шунтирование, реканализацию опухоли (эндопротезирование трубкой, реканализация лучом лазера, фотодинамической терапи ей, дилатацией), наложение гастростомы.
Обходное шунтирование наложением анастомоза между пищеводом (вы ше опухоли) и выключенной по Ру петлей тощей кишки было предложено Киршнером для лечения неудалимых опухолей в 1885 г. Паллиативные ре зекции пищевода стали делать много позже. Обе операции избавляют боль ных от дисфагии, улучшают качество жизни, средняя продолжительность которой не превышает 3—4 мес. Недостатком этих операций является вы сокая летальность (свыше 30 %) и большое число легочных осложнений.
И н т у б а ц и я ( э н д о п р о т е з и р о в а н и е , стент) пищевода произ-
223
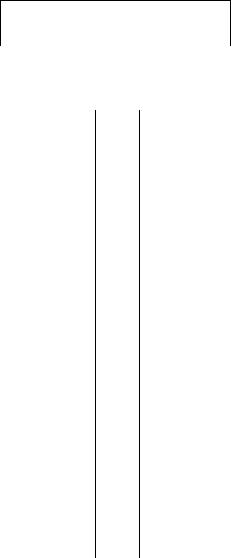
С х е м а . Паллиативное лечение рака пищевода
Неоперабельный рак пищевода IV стадия
|
" |
1 |
w |
|
|
|
|
|
|
|
|
|
Паллиативное лечение |
|
|||
|
|
|
|
|
|
^ |
|
|
ч |
||
Химиотерапия, если: |
|
|
|
|
|
A) Нет дисфагии |
|
|
|
|
|
Б) Высокий риск оперативно |
|
|
Эндоскопический стент |
||
го вмешательства |
|
|
|||
|
|
Лазерное разрушение |
|||
B) Обширное поражение |
|
|
|||
|
|
Фотодинамическая терапия |
|||
Г) Отдаленные метастазы |
|
|
|||
|
|
|
|
||
Д) Удовлетворительное со- |
|
|
|
|
|
стояние |
|
|
|
|
|
|
|
|
|
|
|
Резекция пищевода, если |
|
|
|
имеется: |
|
|
|
A) Дисфагия |
|
|
Радиотерапия |
|
|
|
|
Б) Удовлетворительное со |
^ - |
* |
3000 СБ +/- 5 FY |
|
|||
стояние (good performance) |
|
|
|
B) Резектабельная опухоль |
|
|
|
|
|
|
|
водится трубками различной конструкции (Целестин, Аткинсон, ВильсонКук и др.), которые проводят либо сверху с помощью эндоскопа, либо сни зу через гастротомический разрез. Трубка Аткинсона имеет несомненное преимущество, потому что ее проводят с помощью эндоскопа после дилатации пищевода по проволочному проводнику. При этом отпадает необходи мость в разрезе и общем обезболивании, уменьшается число осложнений и длительность пребывания больного в стационаре. Интубация пищевода не обходима для больных с трахеопищеводным свищом для оттока слюны.
Л а з е р н а я р е к а н а л и з а ц и я обтурированного опухолью пищевода проводится свободным пучком лучей либо специальным инструментом для подведения лазерного излучения наконечником из сапфира. Разрушение опухоли позволяет на 2—3 мес восстановить проходимость пищевода, изба вить больного от дисфагии. Если необходимо, производится повторное вме шательство. При этой процедуре у ряда больных (до 10 %) наблюдалась пер форация пищевода.
224
