
- •СПИСОК СОКРАЩЕНИЙ
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •ПНЕВМОНИИ
- •ХРОНИЧЕСКАЯ ПНЕВМОНИЯ
- •ХРОНИЧЕСКИЙ БРОНХИТ
- •ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ (ХОБЛ)
- •ТЯЖЁЛОЕ ОБОСТРЕНИЕ АСТМЫ (АСТМАТИЧЕСКИЙ СТАТУС)
- •БРОНХОЭКТАТИЧЕСКАЯ БОЛЕЗНЬ
- •ЭМФИЗЕМА ЛЕГКИХ
- •ИНТЕРСТИЦИАЛЬНЫЕ (ДИССЕМИНИРОВАННЫЕ) БОЛЕЗНИ ЛЕГКИХ
- •ФИБРОЗИРУЮЩИЕ АЛЬВЕОЛИТЫ
- •САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ
- •Диагностика
- •РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ
- •МУКОВИСЦИДОЗ
- •ЗАКЛЮЧЕНИЕ
ГЛАВА 13 ФИБРОЗИРУЮЩИЕ АЛЬВЕОЛИТЫ
К группе фиброзирующих альвеолитов отнесены заболевания, характеризующиеся сходной морфологической картиной с развитием распространенного и имеющего тенденцию к прогрессированию пневмофиброза. Фиброзирующий альвеолит может быть не только самостоятельной нозологической формой, но и синдромом других заболеваний, в частности диффузных болезней соединительной ткани. Данная глава посвящена основным нозологическим формам первичных фиброзирующих альвеолитов.
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ
Идиопатический фиброзирующий альвеолит (ИФА) является одним из наиболее часто встречающихся и в то же время плохо изученных заболеваний из группы интерстициальных болезней легких (ИБЛ). ИФА характеризуется воспа-
лением и фиброзом легочного интерстиция и воздухоносных пространств, дезорганизацией структурно-функциональных единиц паренхимы, что приводит к развитию рестриктивных изменений легких, нарушению газообмена, прогрессирующей дыхательной недостаточности и в конечном итоге – к гибели больного.
Синонимами ИФА являются «идиопатический легочный фиброз» – термин, чаще всего используемый в англоязычной (idiopathic pulmonary fibrosis) и немецкоязычной (idiopa-thische Lungenfibrose) литературе, и «криптогенный фиброзирующий альвеолит» (cryptogenic fibrosing alveolitis), получивший большее распространение в Великобритании. Понятия «идиопатический» и «криптогенный», несмотря на небольшое смысловое различие, в настоящее время принято считать синонимами, обозначающими скрытую, неясную природу заболевания [1].
Эпидемиология и предрасполагающие факторы
Данные о распространенности и заболеваемости ИФА значительно варьируют; это, по-видимому, связано с тем, что в прежних эпидемиологических исследованиях учитывались больные не только с ИФА, но и с другими ИИП [1]. Распространенность заболевания составляет среди мужчин 20 случаев на 100 тыс. населения, среди женщин – 13 случаев на 100 тыс. населения. Заболеваемость
501
ИФА составляет 11 случаев на 100 тыс. человек/год у мужчин и 7 случаев на 100 тыс. человек / год – у женщин.
Несмотря на наличие в названии заболевания термина «идиопатический» или «криптогенный», предпринимаются активные попытки поиска причин ИФА. Существует точка зрения, что имеется генетическая предрасположенность к развитию избыточного фиброзообразования в легких в ответ на неспецифическое повреждение эпителия. В пользу данной гипотезы говорит наличие семейных форм заболевания, частое развитие легочного фиброза при некоторых наследственных заболеваниях (болезнь Гоше и др.).
Морфологическая картина
Морфологическая картина при ИФА соответствует гистологически обычной интерстициальной пневмонии (ОИП) [1]. Ключевыми чертами ОИП являют-
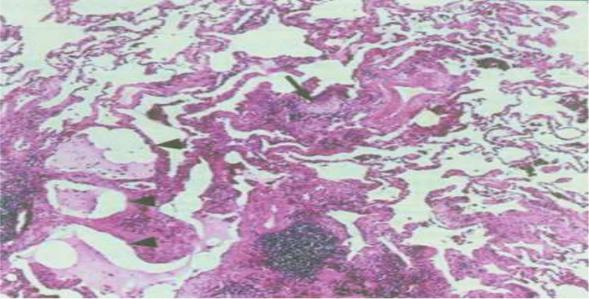
ся: плотный фиброз легочной паренхимы, пятнистый негомогенный тип распределения морфологических изменений и вовлечение в патологический процесс периферической части ацинуса. Пятнистость или гетерогенность поражения паренхимы проявляется чередованием неизмененных легочных единиц, очагов интерстициального воспаления, фиброза и кистозных («сотовых») изменений (рис. 1).
Рис. 1. Гистологическая картина обычной интерстициальной пневмо-
нии. Интерстициальный фиброз, отложение плотного коллагена (снизу), зоны кистозных изменений (короткая стрелка), фокус фибробластов (стрелка) в центре зоны фиброза и воспаления. (Окраска гематоксилином и эозином, ув. 50) (Авдеева О.Е., Авдеев С.Н., Чучалин А.Г., 2005)
502
Изменения особенно выражены в субплевральной области паренхимы легких, заднебазальных сегментах.
Клиническая картина
Заболевание чаще всего встречается у пациентов в возрасте старше 50 лет. Отмечается преобладание заболевания у мужчин, соотношение полов составляет примерно 1,7:1 в пользу мужчин. Основными жалобами больных являются неуклонно прогрессирующая одышка инспираторного характера (невозможность глубоко вдохнуть) и непродуктивный кашель. Одышка определяется у 100 % больных. Степень выраженности одышки является достаточно объективным критерием, позволяющим судить о тяжести заболевания. Как правило, больные отмечают характерную особенность одышки [2, 5]: однажды возникнув, она имеет тенденцию только к прогрессированию. Одышка не зависит (или почти не зависит) от времени суток, температуры окружающего воздуха и др. факторов. Отличительная особенность дыхания больных – укорочение фаз вдоха и выдоха и в связи с этим учащение дыхания в единицу времени, гипервентиляционный синдром. Попытка глубоко вдохнуть вызывает кашель. Следует отметить, что кашель (как самостоятельный признак) встречается не у всех больных при ИФА и
дифференциально-диагностического значения не имеет (в отличие от ХОБЛ, с
которым нередко клиницисты путают ИБЛ, в том числе и ИФА). По мере развития заболевания одышка приводит к полной инвалидизации: больной не способен произнести фразу, предложение, не может ходить, обслуживать себя.
Начало болезни, как правило, незаметное, хотя иногда больные описывают дебют ИФА как острое респираторное заболевание, что предполагает роль вирусной инфекции в генезе заболевания. Так как болезнь прогрессирует довольно медленно, пациенты успевают адаптироваться к своей одышке, постепенно снижая свою активность и переходя к более пассивному образу жизни. Иногда отмечается продуктивный кашель (до 20 %), даже продукция гнойной мокроты, особенно у больных с тяжелыми формами ИФА, что свидетельствует о присоединении бактериальной инфекции. Лихорадка и кровохарканье не характерны для ИФА. Появление кровохарканья должно ориентировать врача на поиск опухоли
503
легких, которая у больных ИФА встречается в 4–12 раз чаще по сравнению с лицами общей популяции, даже с учетом в анамнезе курения. Другими симптомами могут быть общая слабость, артралгия, миалгия, изменение ногтевых фаланг в виде «барабанных палочек» (до 70 %). Характерным аускультативным феноменом при ИФА является крепитация в конце вдоха, которая вначале является нежной, а в дальнейшем, по мере формирования фиброза, становится звучной; её сравнивают с «треском целлофана» или звуком при открывании замка-молнии. Наиболее часто крепитация выслушивается в заднебазальных отделах, хотя при прогрессировании заболевания она может выслушиваться над всей поверхностью легких и в течение всей фазы вдоха. На ранних этапах болезни базальная крепитация может ослабевать или даже полностью исчезать при наклоне больного вперед.
Сухие хрипы могут быть слышны у 5–10 % больных и обычно появляются при сопутствующем бронхите. По мере прогрессирования заболевания появляются признаки дыхательной недостаточности и легочного сердца: диффузный серопепельный цианоз, усиление II тона над легочной артерией, тахикардия, набухание шейных вен, периферические отеки. Снижение массы тела больных, вплоть до развития кахексии, является характерным признаком для ИФА, особенно для терминальной стадии.
Диагностика
Разработаны критерии для определения вероятного диагноза ИФА (табл. 1). Подходы к диагностике ИФА в последнее время претерпели значительные изменения. Несмотря на то, что открытая биопсия легких позволяет установить самый точный диагноз ИФА и считается «золотым стандартом» диагностики, она не является обязательным и единственно верным диагностическим методом при ИФА. Широкое использование открытой биопсии легких при ИФА сдерживают
ее очевидные недостатки: инвазивность, высокая стоимость процедуры, задержка
вназначении терапии, невозможность многократного повторения. Многим больным с предполагаемым ИФА открытая биопсия не показана из-за тяжести их состояния.
504

Таблица 1
Критерии диагноза идиопатического фиброзирующего альвеолита (ATS/ERS, 2000)
Основные критерии
1.Исключение других интерстициальных заболеваний легких, вызванных известными причинами (прием лекарств, экспозиция к вредным факторам внешней среды, системные заболевания соединительной ткани).
2.Рестриктивные изменения функции внешнего дыхания и нарушение газообмена.
3.Двусторонние сетчатые изменения легочного рисунка в базальных отделах легких с минимальными изменениями по типу «матового стекла» по данным компьютерной томографии легких с высокой разрешающей способностью.
4.Отсутствие данных в пользу других заболеваний по данным трансбронхиальной биопсии легкого или бронхоальвеолярного лаважа.
Дополнительные критерии
1.Возраст старше 50 лет.
2.Незаметное, постепенное появление одышки при физической нагрузке.
3.Длительность заболевания более 3 мес.
4.Крепитация в базальных отделах легких.
Для диагностики ИФА необходимо выявить все 4 основных критерия и не менее 3 дополнительных критериев.
По данным исследования Raghu и соавт., только на основании клинических критериев можно поставить диагноз ИФА с очень высокой специфичностью (97 %), однако чувствительность клинических критериев не такая высокая (62 %). Это предполагает, что до одной трети больных с подозрением на ИФА и недавним началом заболевания будут нуждаться в проведении биопсии легких [5]. Введение КТВР в клиническую практику значительно улучшило диагностику ИФА и других ИБЛ. В ряде исследований показана высокая диагностическая ценность КТВР при ИФА (около 90 %). Некоторые эксперты не рекомендуют проведения биопсии легких, если при КТВР-исследовании обнаруживают типичные изменения, в частности картину «сотового» легкого или выраженный фиброз (более 25 % площади доли легкого), так как гистологическое подтверждение фиброза легких практически не изменит подхода к ведению больных.
505
Лабораторные методы исследования обычно не имеют большого значения для диагностики ИФА. У 90 % больных определяют умеренное повышение СОЭ, у большинства обнаруживают циркулирующие иммунные комплексы, у 30-40 % пациентов – повышение общего уровня иммуноглобулинов и криоглобулины. Примерно 20–30 % больных ИФА без сопутствующих системных заболеваний имеют повышенные титры ревматоидного и антинуклеарного факторов. У больных ИФА может быть повышен сывороточный уровень общей ЛДГ, возможным источником которой являются альвеолярные макрофаги и альвеолоциты II типа. У больных с гипоксемией может быть повышено число эритроцитов и уровень гематокрита. Лейкоцитоз периферической крови говорит в пользу инфекции, хотя может быть также и признаком приема больными кортикостероидов. Значительное повышение СОЭ у больных ИФА может являться маркером инфекционного или опухолевого заболевания.
ИФА относится к рестриктивным легочным заболеваниям, поэтому его характерными функциональными особенностями являются снижение статических легочных объемов (ЖЕЛ, общей емкости легких, функциональной остаточной емкости, остаточного объема). Соотношение ОФВ1/ФЖЕЛ (коэффициент Тиффно) находится в пределах нормы или даже повышено. Реже при оценке ИФА используют анализ кривой давление–объем, при заболеваниях данной группы она смещена вправо и вниз, что отражает снижение растяжимости легких и уменьшение объема легких. Данный тест имеет очень высокую чувствительность на начальных этапах развития заболевания, в то время когда другие тесты еще не изменены. На ранних этапах заболевания газовый анализ артериальной крови, выполненный в покое, практически не изменен, хотя при физической нагрузке уже происходит снижение парциального напряжения кислорода артериальной крови (РаО2). По мере прогрессирования заболевания гипоксемия появляется и в покое и сопровождается гипокапнией, отражающей особенности дыхания больных – частого поверхностного дыхания; гиперкапния появляется только на терминальных этапах ИФА. Основным механизмом развития гипоксемии при ИФА является вентиля- ционно-перфузионный дисбаланс.
506
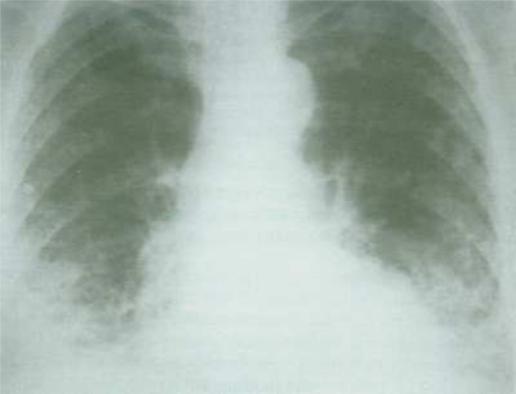
Наиболее частыми рентгенографическими признаками ИФА являются дву-
сторонние изменения ретикулярного или ретикулонодулярного характера, более выраженные в нижних отделах легких (рис. 2).
Рис. 2. Типичная рентгенографическая картина ИФА. Двусторонние из-
менения ретикулярного характера в нижних отделах легких, округлые кистозные просветления («сотовое» легкое) (Авдеева О.Е., Авдеев С.Н., Чучалин А.Г., 2005)
При прогрессировании заболевания ретикулярная ткань становится более грубой, тяжистой, появляются округлые кистозные просветления (0,5–2 см), отражающие формирование «сотового» легкого, могут быть видны линейные тени дисковидных ателектазов. На поздних стадиях ИФА рентгенологическая картина может выявлять девиацию трахеи вправо, трахеомегалию. Необходимо обратить внимание, что до 16 % пациентов с гистологически доказанным диагнозом ИФА могут иметь неизмененную рентгенологическую картину. Вовлечение плевры, внутригрудная аденопатия, локализованные паренхиматозные уплотнения не характерны для ИФА и могут отражать либо другое интерстициальное заболевание легких, либо осложнения заболевания, такие как инфекции или опухоли. При сочетании ИФА и эмфиземы больные могут иметь нормальные или даже повышен-
507
ные легочные объемы, кроме того, может выявляться обеднение сосудистого рисунка в области верхних отделов легких.
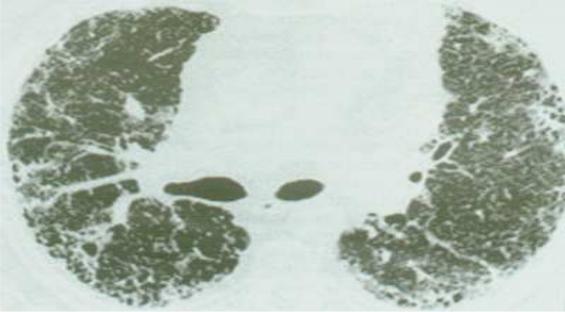
Более ценную информацию можно получить при помощи компьютерной томографии с высокой разрешающей способностью (КТВР). Характерными на-
ходками при КТВР являются нерегулярные линейные тени, кистозные просветления, фокальные очаги снижения прозрачности легочных полей по типу «матового стекла» (не более 30 % от общей площади легких), утолщение и иррегулярность бронхиальных стенок (рис. 3).
Рис. 3. Типичная КТ-картина ИФА. Мелкие кистозные просветления преимущественно в субплевральных отделах (Авдеева О.Е. и соавт., 2005)
Кроме того, в областях с наиболее выраженными изменениями часто выявляют признаки дезорганизации легочной паренхимы и тракционные бронхоэктазы. Наибольшие изменения выявляют в базальных и субплевральных отделах легких. КТВР-признаки и распределение изменений в большинстве случаев являются патогномоничными для ИФА. Достоверность диагноза ИФА по данным КТВР в исследовательских центрах составляет до 90 %.
КТВР позволяет исключить другие ИБЛ, имеющие сходную клиническую картину: хронический гиперчувствительный пневмонит (центролобулярные узелки, отсутствие «сотовых» изменений, преимущественное поражение верхних и средних отделов легких), асбестоз (плевральные бляшки, паренхиматозные ленты
508
фиброза), десквамативная интерстициальная пневмония (протяженные изменения по типу «матового стекла»). КТВР-признаки отражают морфологическую характеристику фиброзирующего альвеолита: ретикулярные изменения соответствуют фиброзу, а синдром «матового стекла» – клеточной инфильтрации. Поэтому КТВР-картина имеет прогностическое значение: лучший прогноз имеют пациенты с синдромом «матового стекла», худший – с ретикулярными изменениями и промежуточный – со смешанными. Больные с синдромом «матового стекла» хорошо отвечали на терапию стероидами, улучшение клинического статуса этих больных сопровождалось улучшением КТВР-картины, в то время как ни в одном случае не наблюдалось уменьшение ретикулярных изменений. Более того, в настоящее время по предсказательной ценности КТВР выходит на первый план, опережая функциональные легочные тесты, бронхоальвеолярный лаваж и даже биопсию легких, так как позволяет дать оценку поражения практически всей паренхимы легких по сравнению с отдельным биопсийным образцом. При сочетании ИФА с эмфиземой легких КТВР является единственным методом, позволяющим оценить выраженность эмфиземы, которая преимущественно локализуется в верхних отделах, и разграничить ее с кистозными изменениями, характеризующими «сотовое» легкое.
Бронхоальвеолярный лаваж (БАЛ) имеет определенное диагностическое значение при ИФА, позволяет оценить течение, прогноз и мониторирование воспаления при терапии заболевания. Характерными находками в лаважной жидкости при ИФА являются повышение общего числа клеток, увеличение числа нейтрофилов и эозинофилов. Однако данные признаки встречаются и при других ИБЛ (асбестоз, лекарственно-обусловленные легочные фиброзы, силикозы), что ограничивает диагностическую ценность БАЛ. Эозинофилия в жидкости БАЛ (ЖБАЛ), как в абсолютном, так и относительном значении, может быть связана с неблагоприятным прогнозом ИФА. Пациенты с повышенным числом эозинофинолов в лаважной жидкости имеют, как правило, плохой ответ на стероидотерапию, причем стероидотерапия способна приводить к снижению числа нейтрофилов в ЖБАЛ, но число эозинофилов не меняется. В некоторых случаях пациенты с
509
ИФА могут иметь лимфоцитарный профиль ЖБАЛ. Лимфоцитоз лаважной жидкости связан с хорошим ответом на терапию стероидами и относится к положительным прогностическим факторам заболевания. Однако не исключено, что ранние наблюдения повышения лимфоцитов в ЖБАЛ включали не только больных ИФА, но и больных с другими формами ИИП.
Трансбронхиальная биопсия (ТББ), как правило, не имеет решающего диагностического значения при ИФА, что связано с малым размером (2–5 мм) получаемого образца и, следовательно, его меньшей информативностью. Учитывая относительную безопасность ТББ, данная процедура часто выполняется на ранних этапах обследования больных для исключения других ИБЛ: гранулематозов (саркоидоз, гиперчувствительный пневмонит), криптогенной организующейся пневмонии, опухолей, инфекционных заболеваний, эозинофильной пневмонии, гистиоцитоза, альвеолярного протеиноза.
Открытая биопсия легких является «золотым» диагностическим стан-
дартом при ИФА и позволяет не только установить диагноз, но и предсказать прогноз заболевания и возможный ответ на терапию. Менее инвазивным методом биопсии, получающим все большую популярность в последнее время, является торакоскопическая биопсия легких (ТСБЛ). ТСБЛ позволяет выполнить забор такого же числа и такого же размера образцов, что и при открытой биопсии. Однако при ТСБЛ по сравнению с открытой биопсией сокращается продолжительность дренажа плевральной полости, длительность пребывания больных в стационаре и число осложнений. Открытая биопсия легких требуется далеко не всем больным. По данным крупных эпидемиологических исследований, она проводится только 11–12 % больных ИФА.
Шифр ИФА в МКБ-10
J 84.9 – Интерстициальная легочная болезнь неуточненная.
Примеры формулировки диагноза
1. Идиопатический фиброзирующий альвеолит, начальная стадия, ДН I.
510
2. Идиопатический фиброзирующий альвеолит, стадия «сотового» легкого. ДН III, легочная гипертензия II степени; хроническое легочное сердце, декомпенсированное, Н II.
Лечение
К сожалению, приходится признать, что современная медицина пока не располагает эффективными методами терапии ИФА. На основании имеющихся ретроспективных исследований очень трудно сделать выводы об эффективности какой-либо терапии при ИФА, тем более что интерпретация результатов исследований затруднена, в связи с отсутствием данных об естественном течении заболевания.
Современная терапия ИФА предусматривает, прежде всего, применение
противовоспалительных средств (кортикостероидов и цитостатиков), т.е.
препаратов, способных воздействовать на воспалительные и иммунологические звенья развития заболевания [1, 2, 5]. В основе такого подхода принято положение, что прогрессирующий фиброз, лежащий в основе ИФА, является следствием хронического персистирующего воспаления, что хроническое воспаление предшествует и неизбежно ведет к фиброзу и подавление воспаления может блокировать последующее формирование фиброзных изменений.
Широко используются три режима противовоспалительной терапии: моно-
терапия глюкокортикостероидами (ГКС), комбинация ГКС с азатиоприном и комбинация ГКС с циклофосфамидом (циклофосфаном). Международный консен-
сус (2000) рекомендует отдавать предпочтение двум последним режимам (табл. 2), хотя веских оснований их преимущества над монотерапией ГКС нет.
Во многих центрах основой медикаментозной терапии ИФА по-прежнему остаются пероральные ГКС. Терапия ГКС приводит к объективному эффекту лишь у 15–20 % больных ИФА. Лучший ответ на стероиды наблюдается у более молодых больных (< 50 лет), женщин, при наличии изменений по типу «матового стекла» на КТВР и повышенной пропорции лимфоцитов (> 25 %) в ЖБАЛ.
511

Таблица 2
Современные рекомендации терапии идиопатического фиброзирующего альвеолита (ATS/ERS, 2000)
1.Кортикостероиды (преднизолон или другие стероидные препараты в дозе эквивалентной преднизолону):
- 0,5 мг/кг фактической массы тела в сутки в течение 4 недель, - 0,25 мг/кг идеальной массы тела в сутки в течение 8 недель. Снижать дозу по 0,125 мг/кг в сутки или 0,25 мг/кг через день
2.Плюс Азатиоприн - 2–3 мг/кг фактической массы тела в сутки. Максимальная доза 150 мг в сутки
Начальная доза составляет 25–50 мг в сутки, дозу повышают на 25 мг каждые 1–2 недели до достижения максимальной дозы
или Циклофосфамид - 2 мг/кг фактической массы тела в сутки. Максимальная доза 150 мг
всутки
Начальная доза составляет 25–50 мг в сутки, дозу повышают на 25 мг каждые 1–2 недели до достижения максимальной дозы.
Терапия проводится как минимум в течение 6 мес. Ответ на терапию определяется динамикой клинических симптомов, данных рентгенографии и функциональных показателей. Обязательно тщательное мониторирование побочных эффектов терапии.
Циклофосфамид является цитостатическим алкилирующим препаратом, его иммуносупрессивное действие опосредуется через уменьшение числа лейкоцитов, особенно лимфоцитов.
Азатиоприн относится к пуриновым аналогам, основным механизмом действия его является блокада синтеза ДНК. Азатиоприн индуцирует лимфопению, снижает число Т- и В-лимфоцитов, подавляет синтез антител, снижает число натуральных киллеров. По сравнению с циклофосфамидом азатиоприн имеет менее выраженный иммуносупрессивный эффект, однако обладает противовоспалительным действием: блокада синтеза простагландинов, снижение проникновения нейтрофилов в очаг воспаления.
Главным аргументом против назначения цитостатиков при ИФА является высокий потенциал развития побочных эффектов, особенно при использовании циклофосфамида. Основным побочным эффектом обоих препаратов является раз-
512
витие панцитопении (при снижении числа лейкоцитов ниже 3 тыс./мл или тромбоцитов ниже 100 тыс./мл доза препаратов должна быть снижена). Кроме лейкопении, на фоне терапии циклофосфамидом могут развиваться такие побочные эффекты, как геморрагический цистит, опухоли мочевого пузыря, стоматит, диарея, повышенная чувствительность организма к инфекциям; к осложнениям терапии азатиоприном относятся желудочно-кишечные нарушения, гонадо- и тератотоксичность. При назначении цитостатиков мониторинг больных должен включать общий анализ крови еженедельно в течение первого месяца, затем 1 раз каждые 2–4 недели, при терапии циклофосфамидом требуется еженедельный анализ мочи для выявления гематурии. Невозможность обеспечить такой строгий мониторинг в амбулаторных условиях часто не позволяет назначать больным ИФА препараты данного класса.
Недостаточная эффективность результатов терапии ИФА противовоспалительными средствами привела к развитию альтернативного подхода – использованию антифиброзных препаратов (D-пеницилламин, колхицин, интерфероны, пирфенидон и др.).
D-пеницилламин является одним из самых первых антифиброзных препаратов, использованных при ИФА. D-пеницилламин блокирует образование поперечных связей коллагена и препятствует дальнейшему фиброзообразованию. Препарат, как правило, более эффективен при лечении фиброзирующих альвеолитов на фоне системных заболеваний соединительной ткани. В настоящее время D- пеницилламин применяют значительно реже, так как препарат обладает серьезными побочными эффектами (в том числе может развиться нефротический синдром). Схема лечения следующая: per os по 0,3 г в сутки в течение 3-5 месяцев, затем по 0,15 г в сутки в течение 1-1,5 лет [2].
Колхицин способен уменьшать продукцию макрофагами фибронектина, инсулиноподобного фактора роста, снижать конверсию проколлагена в коллаген, ингибировать миграцию и пролиферацию фибробластов. Препарат назначается в дозе 0,6–1,2 мг/сут, обычно в комбинации с низкими дозами преднизолона (10 мг/сут). Однако терапия колхицином также не останавливает прогрессирования
513
заболевания. Побочными эффектами при терапии колхицином могут быть диарея, миопатия, но они при лечении колхицином возникают реже, чем при терапии стероидами.
Большие надежды в терапии ИФА связаны с интерферономами, которые подавляют пролиферацию фибробластов и продукцию матричного протеина соединительной ткани.
И, наконец, еще одним перспективным антифиброзным препаратом является пирфенидон. Препарат блокирует митогенные эффекты профибротических цитокинов и снижает синтез экстрацеллюлярного матрикса.
Другим подходом к терапии ИФА является применение антиоксидантной терапии, так как нарушение баланса в системе оксиданты/антиоксиданты играет важную роль в процессах повреждения и воспаления легких. Целесообразно назначение ацетилцистеина в дозе 1,8 г/сут per os в течение 12 недель, витамина Е в дозе 0,2-0,6 г в сутки длительно.
Трансплантация легких является на сегодняшний день наиболее радикальным способом терапии ИФА. Выживаемость больных в течение 3 лет после трансплантации легких по поводу ИФА составляет около 60 %. Ограничивающим фактором для трансплантации часто является пожилой возраст больных и быстрое прогрессирование заболевания. В нашей стране осуществляется подготовительная работа к развертыванию центров трансплантации легких.
Терапия осложнений
При развитии инфекции трахеобронхиального дерева используются антибактериальные и противогрибковые препараты. Всем больным ИФА рекомендована регулярная противогриппозная и антипневмококковая вакцинации. Лечение легочной гипертензии и декомпенсированного хронического легочного сердца отражено в соответствующей главе данного учебного пособия.
При развитии гипоксемии используется терапия кислородом. Показания к длительной оксигенотерапии обычно не отличаются от принятых при хронической обструктивной болезни легких (РаО2 менее 60 мм рт. ст. в покое). Кислоро-
514
дотерапия способна уменьшить диспноэ, повысить интенсивность и длительность физических нагрузок у больных ИФА.
Прогноз и причины смерти больных ИФА
Прогноз как для выздоровления и трудоспособности, так и для жизни не-
благоприятный. Средняя выживаемость больных ИФА составляет всего 2,9 лет. Прогноз несколько лучше у женщин, у более молодых пациентов, при
анамнезе заболевания менее 1 года. Кроме того, к доказанным прогностическим факторам относится ответ больных на терапию ГКС (обычно в течение 3 месяцев).
Наиболее частой причиной смерти больных является развитие дыхательной, а в дальнейшем и легочно-сердечной недостаточности как естественное следствие прогрессирования заболевания. Как уже отмечалось выше, на фоне ИФА существенно возрастает риск развития рака легкого.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ
Экзогенный аллергический альвеолит (ЭАА), или гиперчувствительный пневмонит, включает в себя группу близких по своей сущности интерстициальных заболеваний легких, характеризующихся преимущественно диффузными воспалительными изменениями легочной паренхимы и мелких дыхательных путей, развивающихся в ответ на повторную ингаляцию различных антигенов, являющихся продуктами бактерий, грибов, животных белков, некоторых низкомолекулярных химических соединений.
Заболевание было впервые описано в 1932 г. J. Campbell у пяти фермеров, у которых наблюдалось развитие острых респираторных симптомов после работы с влажным заплесневелым сеном. Эта форма заболевания получила название «легкое фермера». Затем были описаны варианты ЭАА, связанные с другими причинами. Так, вторая по значению форма ЭАА – «легкое любителей птиц» – была впервые описана в 1965 г. С. Reed и соавт. у трех больных, занимавшихся разведением голубей.
Промышленное птицеводство поставило в разряд профессионально значимых факторов сенсибилизацию к перу и пуху птиц, равно как и к комбикормам.
515
Частота встречаемости заболевания составляет до 42 случаев на 100 тыс. населения. Очень трудно определить, у кого из контактирующих с «виновным» агентом разовьется ЭАА. Однако большинство экспертов приходят к соглашению, что примерно от 5 до 15 % лиц, подвергшихся экспозиции высокой концентрации этиологического агента, заболевают гиперчувствительным пневмонитом. Распространенность ЭАА среди людей, имеющих контакт с низкими концентрациями «виновного» агента, пока не определена.
Этиология
Причиной ЭАА является аллерген, попадающий в организм ингаляционным путем с вдыхаемым воздухом. Аллергеном могут быть самые различные вещества, чаще всего споры грибов, которые находятся в прелом сене, кленовой коре, сахарном тростнике и др. Определенную роль играют растительная пыль, белковые антигены, антигены домашней пыли, лекарственные средства (антибиотики, производные нитрофурана и др.), причем последние могут приводить к развитию этого заболевания и при неингаляционном пути введения. Важное значение имеют размер вдыхаемых частиц и их количество; считают, что частицы до 5 мкм могут легко достигать альвеол и вызывать сенсибилизацию. В связи с тем, что постоянное вдыхание тех или иных веществ связано преимущественно с определенной профессией, отдельные виды ЭАА получили название по профессии или по роду занятий заболевших, число этих названий непрерывно увеличивается [4]. Ниже представлены наиболее частые варианты ЭАА (табл. 3).
Наиболее важными из этих агентов являются термофильные актиномицеты и антигены птиц [4, 6]. В сельскохозяйственных районах ведущими причинными агентами являются термофильные актиномицеты – бактерии размером менее 1 мкм, обладающие морфологическими свойствами грибов; они широко распространены в почве, компосте, воде и кондиционерах. Наиболее частыми видами термофильных актиномицетов, ассоциированными с ЭАА, являются Мicropolyspora faeni, Thermoactinomyces vulgaris, Thermoactinomyces viridis, Thermoactinomyces saccharis, Thermoactinomyces candidum. Эти микроорганизмы размножаются при температуре 50-60° С, т. е. в тех условиях, которые достигаются в отопитель-
516
ных системах или при гниении органического материала. Термофильные актиномицеты ответственны за развитие «легкого фермера», багассоза (заболевание легких у работающих с сахарным тростником), «легкого лиц, выращивающих грибы», «легкого лиц, пользующихся кондиционерами» и др.
Таблица 1
Этиологическая классификация экзогенных аллергических альвеолитов (М.М. Илькович, 1998)
Название болезни |
Источник антигена |
Этиологический фактор |
|
|
|
|
|
|
|
Thermophilic Actinomycetes, |
|
Легкое фермера |
Заплесневелое сено |
Mycropolyspora faeni, Ther- |
|
moactinomyces vulgaris, |
|||
|
|
||
|
|
Aspergillus spp. |
|
Легкое любителей птиц |
Экскременты, |
Сывороточные белки птиц |
|
перхоть птиц |
|||
|
|
||
Багассоз |
Сахарный тростник |
Mycropolyspora faeni, |
|
Thermoactinomyces sacchari |
|||
|
|
||
Легкое лиц, |
Компост |
Thermoactinomyces vulgaris, |
|
выращивающих грибы |
Mycropolyspora faeni |
||
|
|||
Легкое лиц, |
Кондиционеры, |
Thermoactinomyces vulgaris, |
|
увлажнители, |
Thermoactinomyces viridis, |
||
использующих кондиционеры |
|||
обогреватели |
Аmeba, Fungi |
||
|
|||
Cубероз |
Кора пробкового |
Penicillum frequentans |
|
дерева |
|||
|
|
||
Легкое варщиков солода |
Заплесневелый ячмень |
Aspergillus clavatus |
|
|
|
|
|
Болезнь сыроваров |
Частицы сыра, плесень |
Penicillum caseii |
|
|
|
|
|
Секвойоз |
Древесная пыль |
Ggaphium spp.,upullaria spp., |
|
секвойи |
Alternaria spp. |
||
|
|||
Легкое производящих |
Детергенты, ферменты |
Bacillus subtitus |
|
детергенты |
|||
|
|
||
Легкое лабораторных |
Моча и перхоть |
Протеины мочи грызунов |
|
работников |
грызунов |
||
|
|||
Легкое нюхающих |
Порошок гипофиза |
Свиные и бычьи протеины |
|
порошок гипофиза |
|||
|
|
||
Легкое занятых |
Диизоцианаты |
Toluene diisocianate, |
|
в производстве пластмасс |
diphenylmethane diisocianate |
||
|
|||
Летний пневмонит |
Пыль влажных жилых |
Trichosporon cutaneum |
|
помещений (Япония) |
|||
|
|
Птичьи антигены представлены в основном сывороточными белками – гамма-глобулином, альбумином. Эти белки содержатся в экскрементах, секретах кожных желез голубей, попугаев, индюшек, канареек и других птиц. Люди, ухаживающие за этими птицами, заболевают чаще всего при хроническом контакте с
517
ними. Протеины свиней и коров также могут вызывать ЭАА, примером является заболевание, развивающееся у больных несахарным диабетом, нюхающих порошок гипофиза – «легкое лиц, нюхающих порошок гипофиза».
Среди грибковых антигенов при ЭАА наибольшее значение имеет Aspergillus spp. Различные виды Aspergillus связаны с развитием таких заболеваний, как «легкое варщиков солода», «легкое сыроваров», субероз (болезнь, развивающаяся у работающих с корой пробкового дерева), а также «легкое фермера», «легкое лиц, пользующихся кондиционерами». Aspergillus fumigatus может стать причиной развития альвеолита у городских жителей, так как является частым обитателем сырых, непроветриваемых теплых помещений.
Примером ЭАА, связанного с реактогенными химическими соединениями, является заболевание у лиц, занятых в производстве пластмасс, полиуретана, смол, красителей. Наибольшее значение имеют диизоцианаты, фталиковый ангидрит.
Причины ЭАА значительно различаются в разных странах и регионах. Так, в Великобритании среди форм ЭАА преобладает «легкое любителей волнистых попугаев», в США – «легкое пользующихся кондиционерами и увлажнителями» (15 – 70 % всех вариантов), в Японии – «летний тип» ЭАА, этиологически связанный с сезонным ростом грибов вида Trichosporon cutaneum (75 % всех вариантов). В крупных промышленных центрах (в Москве) в настоящее время ведущими причинами являются птичьи и грибковые (Аspergillus spp.) антигены.
Патогенез
Органы дыхания являются той системой организма, которая подвергается наиболее интенсивному воздействию пылевых частиц как органической, так и неорганической природы. Следует сказать, что одни и те же аллергенные субстанции могут вызывать у разных лиц различные заболевания органов дыхания — риниты, бронхиальную астму (БА), экзогенный аллергический альвеолит (ЭАА), а также кожи (различные формы аллергодерматозов) и слизистых оболочек глаз (конъюнктивиты). Это зависит от состояния иммунной реактивности организма, характера аллергена, степени его дисперсности, интенсивности воздействия на
518
организм и других факторов.
Необходимым условием развития ЭАА является ингаляция антигенного материала определенных размеров в достаточной дозе и в течение определенного временного периода. Для того чтобы произошла депозиция антигена в мелких дыхательных путях и альвеолах, антиген должен иметь размеры менее 5 мкм, хотя возможно развитие заболевания и при абсорбции растворимых антигенов из частиц больших размеров, осевших в проксимальных отделах бронхиального дерева. Большинство людей, подвергшихся экспозиции антигенного материала, не заболевают ЭАА, что предполагает, кроме внешних факторов, участие в развитии заболевания и эндогенных факторов, которые пока изучены недостаточно полно (генетические факторы, особенности иммунного ответа). ЭАА справедливо считается иммунопатологическим заболеванием, в развитии которого ведущая роль принадлежит аллергическим реакциям 3-го и 4-го типов (по классификации Gell, Coombs), имеет значение и неиммунное воспаление.
Иммунокомплексные реакции (3-й тип) имеют основное значение на ранних этапах развития ЭАА. Образование иммунных комплексов (ИК) происходит in situ в интерстиции при взаимодействии ингалируемого антигена и антитела класса IgG. Локальная депозиция ИК вызывает острое повреждение интерстиция и альвеол, характеризующееся нейтрофильным альвеолитом и повышением сосудистой проницаемости. ИК ведут к активации системы комплемента и альвеолярных макрофагов. Активные компоненты комплемента повышают проницаемость сосудов (С3а) и оказывают хемотаксическое действие на нейтрофилы и макрофаги (С5а). Активированные нейтрофилы и макрофаги вырабатывают и высвобождают провоспалительные и токсические продукты, такие как кислородные радикалы, гидролитические ферменты, продукты арахидоновой кислоты, цитокины (интер- лейкин-1, фактор некроза опухоли - TNF-α). Эти медиаторы приводят к дальнейшему повреждению и некрозу клеток и матричных компонентов интерстиция, усиливают острый воспалительный ответ организма и вызывают приток лимфоцитов и моноцитов, которые в дальнейшем поддерживают реакции гиперчувствительности замедленного типа.
519
Доказательствами развития иммунокомплексных реакций при ЭАА являют-
ся:
сроки воспалительного ответа после контакта с антигеном (4 - 8 ч);
обнаружение высоких концентраций преципитирующих антител класса IgG в сыворотке и в бронхоальвеолярной лаважной жидкости (ЖБАЛ) больных;
выявление в гистологическом материале легочной ткани при остром ЭАА иммуноглобулина, компонентов комплемента и антигенов, т.е. всех составляющих ИК;
классические кожные реакции по типу феномена Артюса у больных ЭАА, вызываемые высокоочищенными препаратами «виновных» антигенов;
повышение числа нейтрофильных лейкоцитов в ЖБАЛ после ингаляционных провокационных тестов.
Иммунные реакции, опосредованные Т-лимфоцитами (4-й тип), включают
CD4+ Т-клеточную гиперчувствительность замедленного типа и CD8+ Т- клеточную цитотоксичность. Реакции замедленного типа развиваются через 24 - 48 ч после экспозиции антигена. Цитокины, высвободившиеся в результате иммунокомплексного повреждения, особенно TNF-α, индуцируют экспрессию адгезивных молекул на клеточных мембранах лейкоцитов и эндотелиальных клеток, что значительно увеличивает последующую миграцию лимфоцитов и моноцитов в очаг воспаления. Отличительной особенностью реакций замедленного типа является активация макрофагов гамма-интерфероном, секретируемым активированными лимфоцитами СD4+. Продолжающаяся антигенная стимуляция поддерживает развитие реакций замедленного типа и ведет к формированию гранулем и активации фибробластов ростовыми факторами, и в итоге, к избыточному синтезу коллагена и интерстициальному фиброзу.
Доказательствами реакций 4-го типа являются:
наличие Т-лимфоцитов памяти как в крови, так и в легких больных ЭАА;
гистологическое подтверждение при подостром и хроническом течении ЭАА в виде гранулем, лимфомоноцитарных инфильтратов и интерстициального фиброза;
520
на моделях животных с экспериментальным ЭАА показано, что для индукции заболевания необходимо присутствие Т-лимфоцитов CD4+.
Гистологическая картина
Частым признаком ЭАА является наличие гранулем без признаков казеоза, которые могут быть обнаружены в 67-90 % случаев. Эти гранулемы отличаются от таковых при саркоидозе: они меньше по размеру, менее четко очерчены, содержат большее количество лимфоцитов, сопровождаются распространенным утолщением альвеолярных стенок и диффузными лимфоцитарными инфильтратами. Наличие гигантских клеток и телец Шаумана является важным признаком, но оно неспецифично для ЭАА. Гранулемы обычно разрешаются в течение 6 месяцев при отсутствии повторного контакта с антигеном.
Другим характерным признаком заболевания является альвеолит, основные воспалительные элементы которого – лимфоциты, плазматические клетки, моноциты и макрофаги. Пенистые альвеолярные макрофаги преобладают в люминальных отделах, т.е. внутри альвеол, в то время как лимфоциты – в интерстиции. На ранних стадиях ЭАА может быть обнаружен интраальвеолярный фибринозный и белковый выпот. Морфологические изменения могут также встречаться и в малых дыхательных путях. Они включают в себя облитерирующий бронхиолит, перибронхиальные воспалительные инфильтраты, лимфатические фолликулы. Гранулематоз, альвеолит и бронхиолит составляют так называемую триаду морфологических признаков при ЭАА, хотя все элементы триады находят не всегда. Васкулит при ЭАА встречается крайне редко и был описан при фатальном исходе заболевания. При развитии легочной гипертензии отмечается гипертрофия медии артерий и артериол.
При хроническом течении ЭАА обнаруживают фиброзные изменения, выраженные в различной степени. Иногда фиброз ассоциирован с умеренной лимфоцитарной инфильтрацией, плохо очерченными гранулемами; в этом случае диагноз ЭАА также можно предположить по данным морфологического исследования. Однако гистологические изменения при хроническом ЭАА часто не отличаются от таковых при других хронических интерстициальных заболеваниях лег-
521
ких. Так называемый неспецифический легочный фиброз может быть конечным проявлением универсальных реакций на повреждающий фактор при различных интерстициальных заболеваниях. В далеко зашедших стадиях отмечаются изменения архитектоники легочной паренхимы по типу «сотового» легкого.
Клиническая картина
Болеют преимущественно люди, не имеющие предрасположенности к атопическим реакциям. Заболевание развивается обычно после длительных контактов с источниками аллергена, в течение которых происходит сенсибилизация организма [4, 6].
Выделяют три типа течения заболевания: острое, подострое и хроническое.
Острый ЭАА обычно развивается после массивной экспозиции известного антигена в домашних, производственных или окружающих условиях. Симптомы появляются через 4 - 12 ч и включают в себя лихорадку, озноб, слабость, тяжесть в грудной клетке, кашель, одышку, боли в мышцах и суставах. Мокрота у пациентов бывает редко, а если присутствует, то скудная, слизистая. Частым симптомом являются также фронтальные головные боли. При осмотре пациента нередко выявляют цианоз, при аускультации легких – крепитацию, более выраженную в базальных отделах; иногда могут присутствовать и свистящие хрипы. Перечисленные симптомы обычно разрешаются в течение 24 - 72 ч, однако часто появляются вновь после очередного контакта с «виновным» антигеном. Одышка при физической нагрузке, слабость и общая вялость могут сохраняться в течение нескольких недель. Типичным примером острого течения ЭАА является «легкое фермера», когда симптомы появляются через несколько часов после контакта с заплесневелым сеном.
Острый ЭАА диагностируется довольно редко, часто предполагается атипичная пневмония вирусной или микоплазменной природы, и правильный диагноз во многом зависит от настороженности врача. У фермеров дифференциальный диагноз острого ЭАА проводится с легочными микотоксикозами (или токсическим синдромом органической пыли), которые возникают при массивной ингаляции спор грибов. В противоположность больным острым ЭАА, почти все паци-
522
енты с микотоксикозами имеют нормальную рентгенограмму, в сыворотке отсутствуют преципитирующие антитела.
Подострая форма развивается при менее интенсивной, но более продолжительной экспозиции «виновных» антигенов, что чаще происходит в домашних условиях. Характерным примером является ЭАА, связанный с контактом с домашними птицами. Основными симптомами являются одышка при физической нагрузке, быстрая утомляемость, кашель со слизистой мокротой, иногда лихорадка в дебюте заболевания. В легких, обычно в базальных отделах, выслушивается нежная крепитация. Дифференциальный диагноз обычно проводится с саркоидозом и другими интерстициальными заболеваниями легких.
Если ингаляция пыли происходит длительное время и доза ингалируемого антигена невысока, может развиться хроническая форма ЭАА. Нераспознанный или нелеченный подострый ЭАА также может перейти в хроническую форму. Характерным симптомом хронического экзогенного аллергического альвеолита является прогрессирующая одышка при физическом напряжении, временами сочетающаяся с анорексией и выраженным снижением массы тела. Впоследствии у пациентов развиваются интерстициальный фиброз, легочное сердце, дыхательная и сердечная недостаточность. Незаметное начало заболевания и отсутствие острых эпизодов часто затрудняют разграничение ЭАА с другими интерстициальными заболеваниями легких. В целом клиническая картина хронической формы ЭАА напоминает таковую при ИФА.
Диагностика
Основное значение имеют рентгенотомографические методы.
Рентгенологическая картина существенно различается при разных вариантах течения и стадиях ЭАА. При острых и подострых формах наиболее частыми находками являются изменения в виде снижения прозрачности легочных полей по типу «матового стекла», распространенных узелково-сетчатых затемнений. Размеры узелков обычно не превышают 3 мм и могут поражать все зоны легких. Часто свободными от узелковых поражений остаются верхушки легких и базальные отделы. Рентгенологическая картина обычно разрешается в течение 4-6 недель
523
при отсутствии повторного контакта с «виновным» аллергеном. Как правило, улучшение рентгенологической картины предшествует нормализации функциональных тестов, в частности диффузионной способности легких.
При хроническом альвеолите чаще выявляют хорошо очерченные линейные тени, выраженные интерстициальные изменения, узелковые затемнения, уменьшение размеров легочных полей, при далеко зашедших стадиях - картину «сотового» легкого.
Компьютерная томография является более чувствительным методом визуализации ЭАА. Она позволяет выявлять невидимые при обычной рентгенографии узелковые затемнения, зоны «матового стекла», «сотовые» изменения.
Во время острых атак ЭАА в лабораторных анализах крови выявляется умеренный лейкоцитоз, в среднем до 12 - 15 × 103 /мл. Иногда лейкоцитоз может достигать 20-30 × 103 /мл. Часто отмечается сдвиг лейкоцитарной формулы влево. Эозинофилия выявляется редко, и если имеется, то часто незначительная. У большинства пациентов отмечаются нормальные значения СОЭ, однако в 31 % случаев этот показатель достигает 20 - 40 мм/ч и в 8 % - более 40 мм/ч. Часто выявляют повышенные уровни IgG и IgM, иногда также повышен уровень IgA .
У некоторых больных обнаруживают также умеренное повышение активности ревматоидного фактора. Довольно часто отмечают увеличение уровня общей ЛДГ, что может отражать активность воспалительного процесса в паренхиме легких.
Особое значение при ЭАА имеет обнаружение специфических преципитирующих антител к «виновному» антигену. Чаще всего для этого используют методы двойной диффузии по Оухтерлони, микро-Оухтерлони, встречного иммуноэлектрофореза и иммуноферментные методы (ELISA, ELIEDA).
Преципитирующие антитела обнаруживаются у большинства пациентов, особенно при остром течении заболевания. После прекращения контакта с антигеном антитела в меньшем титре обнаруживаются в сыворотке в течение 1-3-х лет. При хроническом же течении преципитирующие антитела часто не выявляются. Возможны и ложноположительные результаты; так, у фермеров, не имею-
524
щих симптомов ЭАА, антитела обнаруживают в 9-22 % случаев , а среди любителей птиц – в 51 % . У пациентов с ЭАА уровень преципитирующих антител не коррелирует с активностью заболевания и может зависеть от многих факторов, например у курильщиков он существенно ниже. Таким образом, присутствие специфических антител не всегда подтверждает диагноз ЭАА, а их отсутствие не исключает наличие заболевания. Несмотря на это, обнаружение преципитирующих антител может помочь в диагностике ЭАА, когда имеется предположение о наличии ЭАА, построенное на клинических данных, а природа «виновного» агента неясна.
Функциональные изменения неспецифичны и сходны с таковыми при других интерстициальных заболеваниях легких. Наиболее чувствительным тестом является снижение диффузионной способности легких (ДСЛ). Нарушение газообмена приводит к гипоксемии в покое, усугубляющейся при физической нагрузке. При исследовании ФВД определяется рестриктивный тип нарушения вентиляции. При остром течении и развитии бронхиальной обструкции изменения ФВД протекают двухфазно: немедленные изменения по обструктивному типу, включая снижение ОФВ1 и индекса Тиффно; эти изменения сохраняются около часа, а затем, через 4 - 8 часов, они сменяются на рестриктивный тип нарушения вентиляции (снижение ЖЕЛ, ОЕЛ, ФОЕ, ООЛ). Примерно у 10-25 % больных ЭАА обнаруживают признаки гиперреактивности дыхательных путей.
Ингаляционные тесты для диагностики ЭАА были впервые проведены J. Williams (1963). Аэрозоли для тестов были приготовлены из пыли заплесневелого сена, экстрактов заплесневелого сена и актиномицет, изолированных из заплесневелого сена. В каждом случае болезнь «воспроизводилась» у фермеров, имевших эпизоды ЭАА в анамнезе. Ингаляционные тесты с экстрактами из «хорошего сена» у пациентов с «легким фермера» или с экстрактами заплесневелого сена у здоровых людей не приводили к появлению симптомов заболевания.
В отличие от пациентов с бронхиальной астмой, провокационные тесты при ЭАА не вызывают немедленных симптомов или изменений легочных функций. Однако спустя 4-6 ч у пациентов с положительным ответом появляются диспноэ,
525
слабость, повышение температуры, озноб, крепитация в легких. При исследовании ФВД выявляют значительное снижение ЖЕЛ и ДСЛ. Эти изменения обычно разрешаются в течение 10 - 12 ч. Однако постановка диагноза ЭАА возможна и без провокационных тестов; в связи с этим они в практической работе не используются. Провокационные тесты в настоящее время применяют лишь в экспертной практике с целью уточнения причинного фактора заболевания. Одним из вариантов таких тестов может считаться наблюдение за пациентом в его естественных профессиональных или бытовых условиях.
Бронхоальвеолярный лаваж (БАЛ) отражает клеточный состав дистальных отделов дыхательных путей и альвеол. Наиболее характерными находками в ЖБАЛ при ЭАА являются увеличение числа клеточных элементов (примерно в 5 раз) с преобладанием лимфоцитов, которые могут составлять до 80 % от общего числа всех клеток. Лимфоциты представлены в основном Т-клетками, большинство из которых, в свою очередь, являются CD8+-лимфоцитами. Иммунорегуляторный индекс (CD4+/CD8+) при ЭАА меньше единицы, то есть снижен, в то время как при саркоидозе он составляет 4,0 - 5,0. Подобная картина ЖБАЛ характерна для подострого и хронического течения ЭАА. Если лаваж проведен в период до 3 суток после контакта с «виновным» антигеном, то состав ЖБАЛ может выглядеть иначе: выявляют повышение числа нейтрофилов без сопутствующего лимфоцитоза. Часто в ЖБАЛ при ЭАА также отмечается повышенное содержание тучных клеток. Их число может превышать нормальный уровень в десятки раз. Как правило, тучные клетки выявляются при недавней экспозиции с антигеном (не позже 3 месяцев). Считается, что именно число тучных клеток наиболее точно отражает активность заболевания и степень активации процессов фиброгенеза. При подостром течении ЭАА в ЖБАЛ могут присутствовать плазматические клетки.
Дифференциальный диагноз
Дифференциальный диагноз нужно проводить с другими диссеминированными поражениями легких (альвеолярным и метастатическим раком, милиарным туберкулезом, саркоидозом и другими фиброзирующими альвеолитами и др.) [9].
526
Раковое поражение легких отличается от экзогенного аллергического альвеолита отсутствием связи заболевания с воздействием экзогенного аллергена, неуклонным прогрессированием и большей тяжестью течения заболевания, особенностями рентгенологических признаков поражения легких, отсутствием в сыворотке крови преципитирующих антител к какому-либо аллергену.
Милиарный туберкулез легких отличается от экзогенного аллергического альвеолита отсутствием связи с воздействием аллергенов, более выраженной тяжестью и длительностью течения заболевания, особенностью рентгенологических проявлений, положительными серологическими реакциями с туберкулезным антигеном, отсутствием в сыворотке крови повышенных титров преципитирующих антител к какому-либо экзоаллергену, который может привести к аллергическому альвеолиту.
Отличительными особенностями фиброзирующих альвеолитов при систем-
ных поражениях соединительной ткани являются наличие васкулита и многоор-
ганности поражения. В случаях, когда дифференциальный диагноз особенно труден, например при хроническом течении аллергического альвеолита, производят биопсию легочной ткани с гистологическим иcследованием биоптата.
При саркоидозе нет связи с профессией, поражаются не только легкие, но и другие органы, развивается гиперкальцийурия, рентгенологически в грудной клетке часто выявляется двустороннее увеличение прикорневых лимфоузлов, отмечается слабая или отрицательная реакция на туберкулин, положительная реакция Квейма, имеется гистологическое подтверждение саркоидозного процесса.
Необходимо дифференцировать альвеолит от обычных пневмоний, для которых характерна связь с простудой, рентгенологически — субсегментарное, сегментарное или долевое затемнение за счет инфильтрации.
Cогласно МКБ-10 ЭАА отнесены к классу X «Болезни органов дыхания»:
J 66 Болезнь дыхательных путей, вызванная специфической органической
пылью.
J 66.0 Биссиноз.
J 66.1 Болезнь трепальщиков льна.
527
J 66.2 Каннабиоз.
J66.8 Болезнь дыхательных путей, вызванная другой уточненной органической пылью.
J 67 Гиперсенситивный пневмонит.
J 67.0 Легкое фермера (сельскохозяйственного работника).
J 67.1 Багассоз (от пыли сахарного тростника)
J 67.2 Легкое птицевода.
J 67.3 Субероз.
J 67.4 Легкое работающего с солодом.
J 67.5 Легкое работающего с грибами.
J 67.6 Легкое сборщика коры клена.
J 67.8 Гиперсенситивные пневмониты, вызванные другой органической
пылью.
J 67.9 Гиперсенситивный пневмонит, вызванный другой неуточненной органической пылью.
Примеры формулировки диагноза
1.Экзогенный аллергический альвеолит («легкое фермера»), острая форма.
2.Медикаментозный аллергический альвеолит, вызванный фуразолидоном, подострая форма, ДН I.
3.Экзогенный аллергический альвеолит («легкое птицевода»), хроническая форма. Хронический бронхит, бронхоспастический синдром. ДН III. Легочная гипертензия III степени. Хроническое легочное сердце, декомпенсированное. Н II.
Лечение
Основой лечения ЭАА является исключение контакта с «виновным» агентом. Для достижения адекватного контроля необходимы система производственной гигиены, включающая использование масок, фильтров, вентиляционных систем, изменение окружающей среды и привычек. Распознавание и ранняя диагностика ЭАА очень важны, потому что прогрессирование заболевания можно пре-
528
дотвратить. При сохранении контакта с антигеном возможно развитие серьезного и необратимого хронического заболевания.
При острых, тяжелых и прогрессирующих формах заболевания рекомендовано назначение глюкокортикостероидов [4]. При остром течении ЭАА может быть достаточной доза преднизолона 0,5 мг на 1 кг массы тела больного в течение 2-4 недель с дальнейшим понижением дозировки. Эмпирическая схема при подостром и хроническом течении ЭАА предусматривает назначение преднизолона в дозе 1 мг/кг в течение 1-2 месяцев с последующим постепенным снижением дозы до поддерживающей (5-10 мг/сут). Преднизолон отменяют при достижении клинического улучшения или при отсутствии клинического и функционального ответа на него. Если в период снижения дозы преднизолона происходит ухудшение течения заболевания, то следует вернуться на предшествующую ступень терапии.
В последние годы хорошо зарекомендовал себя ингакорт – дозированный ингаляционный кортикостероидный препарат. Оптимальная суточная доза – по 2 вдоха 2 раза (1 000 мкг/сутки) [4].
При резистентности заболевания к кортикостероидам иногда назначают Д-пеницилламин или колхицин, однако эффективность такой терапии не доказана. У пациентов с гиперреактивностью дыхательных путей показано использование ингаляционных бронходилататоров. При появлении осложнений проводится симптоматическая терапия: кислород при дыхательной недостаточности, антибиотики при бактериальном бронхите, диуретики при застойной сердечной недостаточности и т.д.
Профилактика и прогноз
Первичная профилактика ЭАА определяется характером этиологического фактора. Так, например, профилактика «легкого фермера» достигается высушиванием сена, использованием открытых силосных ям и хорошим проветриванием производственных помещений. Для профилактики некоторых других форм ЭАА необходимо соблюдать гигиенические нормы в помещениях, в которых содержатся животные и птицы; тщательный уход за кондиционерами и увлажнителями воздуха и т.д.
529
Вторичная профилактика экзогенного аллергического альвеолита заключается в прекращении контакта с «виновными» аллергенами. В тех случаях, когда болезнь связана с условиями работы, необходима смена профессии.
Экзогенные аллергические альвеолиты имеют различный прогноз: заболевание может быть полностью обратимым при своевременном, возможно более полном и раннем устранении из окружающей больного среды этиологических факторов. Рецидивы могут приводить к необратимым изменениям в легких, что зависит от многих факторов, включая характер экспозиции антигена, природу ингалируемой пыли и иммунный ответ пациента. В таких случаях прогноз как для выздоровления и трудоспособности, так и для жизни (в отдаленном периоде),
становится неблагоприятным. По осложнениям заболевания и прогнозу хроническая форма ЭАА практически сопоставима с ИФА [4, 6].
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИТ
Экзогенный токсический альвеолит (ЭТА, синоним – токсический фибро-
зирующий альвеолит) представляет собой патологический процесс, обусловленный токсическим влиянием на паренхиму легких лекарственных препаратов и химических веществ.
Встречается преимущественно у взрослых пациентов, однако, поскольку круг веществ, оказывающих пневмотропный эффект, расширяется, его возникновение у детей также возможно.
Несмотря на то, что уже доказана этиологическая роль целого ряда профессиональных факторов в возникновении ЭТА, до настоящего времени в нашей стране это заболевание не включено в список профессиональных. Как правило, профпатологи используют такие термины, как «токсическая пневмония» и «пневмосклероз от воздействия внешних агентов». Отсутствие термина «альвеолит» в практике профпатолога приводит к неадекватной оценке патологического процесса и, соответственно, неправильному и даже противопоказанному лечению, так как ряд назначаемых лекарственных препаратов обладает пневмотропным токсическим действием. Неправильная лечебная тактика приводит к ранней инвалидизации больных и в ряде случаев к преждевременной смерти [8].
530
Этиология
Этиологические факторы ЭТА наиболее полно были систематизированы Н.В.Путовым и М.М. Ильковичем [3, 7]. Авторы выделяют две группы факторов, играющих существенную роль в возникновении ЭТА:
1.Лекарственные препараты;
2.Токсические вещества производственной сферы.
Клекарственным средствам, оказывающим пневмотропное влияние отно-
сятся:
алкилирующие цитостатические и иммунодепрессивные препараты (хлорбутин, сарколизин, циклофосфан, метотрексат, миелосан, меркаптопурин и др.);
противоопухолевые антибиотики (блеомицин, митомицин С и др.);
цитостатики растительного происхождения (винкристин, винбластин и
др.);
другие противоопухолевые препараты (прокарбазин, нитрозометилмоче-
вина),
производные нитрофурана и сульфаниламиды;
нейроактивные и вазоактивные препараты (бензогексоний, анаприлин, апрессин и др.);
пероральные противодиабетические средства (например, хлорпропамид);
анорексигенные препараты (например, меноцил).
Частота возникновения ЭТА при применении цитостатических и противоопухолевых средств достигает 40 %. Кислород при его длительной ингаляции, особенно в высокой концентрации, также может оказывать токсическое действие на легочную ткань. Риск развития ЭТА определяется дозой, длительностью приема пневмотоксичных препаратов и возрастает при сочетанном назначении нескольких таких препаратов.
К производственным этиологическим факторам относятся:
раздражающие газы (сероводород, хлор, аммиак, тетрахлорметан и др.);
531
некоторые металлы (марганец, бериллий, ртуть, никель, кадмий, цинк) и их соединения;
пластмассы (полиуретан, политетрафлюороэтилен);
гербициды (паракват и др.).
Патогенез
Особенностью патогенеза ЭТА является непосредственное токсическое действие на эндотелий легочных капилляров, в результате которого возникают нарушения микроциркуляции, интерстициальный отек и инфильтрация с последующим развитием интерстициального пневмофиброза. Некоторые пневмотропные токсические вещества (например, бериллий), наряду с прямым токсическим действием на легочную ткань, вызывают развитие иммунопатологического процесса.
Морфологические изменения
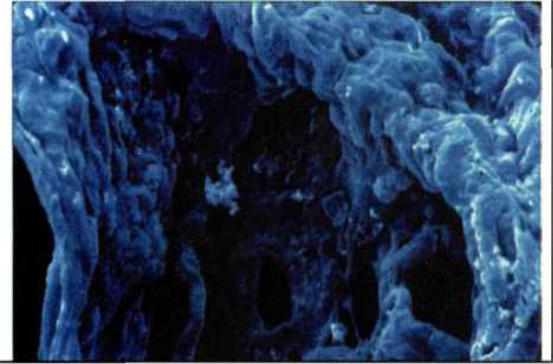
Морфологически выявляются отек межальвеолярных перегородок, поражение капилляров, некроз альвеолоцитов I типа, пролиферация фибробластов с развитием интерстициального фиброза. При хронической форме ЭТА изменения напоминают таковые при ИФА (рис.1).
Рис. 1. Электронно-микроскопическая картина фиброзированной альве-
олы. (Шмелев Е.И., 2003).
532
Клиническая картина
Клинически ЭТА проявляется одышкой, сухим кашлем, повышением температуры тела. Аускультативно могут определяться жесткое дыхание, крепитация в легких.
По течению различают острые, подострые и хронические ЭТА. Острые ЭТА возникают чаще после массивной ингаляции промышленных токсических веществ или при длительном приеме нитрофурановых препаратов. Хронические формы характеризуются постепенным нарастанием симптомов заболевания при продолжающемся действии этиологического фактора. При развитии пневмофиброза ЭТА трудно отличить от ИФА.
Диагностика
При диагностике ЭТА следует учитывать комплекс наиболее информативных признаков [7, 8]:
возникновение заболевания после контакта с токсическими веществами;
преобладание в клинической картине заболевания одышки с затруднением вдоха, сухого кашля, крепитации;
рентгенологические изменения: усиление легочного рисунка с обеих сторон, распространенные очаговоподобные тени, преимущественно в нижних отделах; при развитии фиброза – диффузная двусторонняя ячеистая деформация легочного рисунка (картина «сотового» легкого). В тех случаях, когда при характерной клинической картине изменения легочного рисунка на обычных рентгенограммах отсутствуют, следует проводить КТ легких;
наличие рестриктивного синдрома при исследовании ФВД и снижение диффузионной способности легких;
диффузные нарушения перфузии легких на сцинтиграммах;
формирование легочной гипертензии при хроническом течении заболе-
вания.
В сложных случаях показано проведение открытой или чрезбронхиальной биопсии легких.
ЭТА в МКБ-10 представлены в следующих рубриках:
533
J 68 Респираторные состояния, вызванные вдыханием химических веществ, газов, дымов и паров.
J 69 Пневмонит, вызванный твердыми веществами и жидкостями.
J 70.2 Острые интерстициальные легочные нарушения, вызванные лекарственными препаратами.
J70.3 Хронические интерстициальные легочные нарушения, вызванные лекарственными препаратами.
J70.4 Легочные интерстициальные нарушения, вызванные лекарственными средствами, неуточненные.
Примеры формулировки диагноза
1.Экзогенный токсический альвеолит, вызванный вдыханием хлора (на производстве), острое течение.
2.Экзогенный токсический альвеолит, вызванный приемом циклофосфана, подострое течение, ДН I.
3.Экзогенный токсический альвеолит, вызванный приемом хлорпропамида, хроническое течение. ДН III. Легочная гипертензия II степени. Хроническое легочное сердце, декомпенсированное. Н II.
Профилактика, лечение и прогноз
Первичная профилактика в производственных условиях заключается в соблюдении правил работы с токсичными веществами. При назначении потенциально пневмотоксичных лекарственных препаратов следует избегать введения максимальных доз и неблагоприятных сочетаний препаратов, осуществлять регулярный контроль за состоянием легких для раннего выявления признаков альвеолита.
Лечение ЭТА заключается, в первую очередь, в прекращении действия этиологического фактора, что в свою очередь является и вторичной профилактикой заболевания. На ранней стадии ЭТА эффективны глюкокортикоиды, на поздней – рекомендуется прием антифиброзных препаратов [1, 2].
Прогноз зависит от своевременности диагностики и, как правило, при своевременном лечении благоприятный. В случае развития распространенного пнев-
534
мофиброза прогноз как для выздоровления и трудоспособности, так и для жизни становится неблагоприятным.
Литература
1.Идиопатический фиброзирующий альвеолит. Авдеева О.Е., Авдеев С.Н., Чучалин А.Г. РМЖ, опубликовано в Интернете в 2005 году: http://www.rmj.ru/rmj/t6/n4/4.htm
2.Илькович М.М., Новикова Л.Н. Идиопатический фиброзирующий альвеолит // Заболевания органов дыхания /Под ред. М.М. Ильковича. – СПб: Нордмед-
Издат., 1998, том 2. – С. 161-184.
3.Илькович М.М., Новикова Л.Н. Токсический фиброзирующий альвеолит //Заболевания органов дыхания / Под ред. М.М. Ильковича. – СПб: «Нордмед-
Издат», 1998, том 2. – С. 185-198.
4.Илькович М.М., Новикова Л.Н. Экзогенный аллергический альвеолит //Заболевания органов дыхания / Под ред. М.М. Ильковича. – СПб: «Нордмед-
Издат», 1998, том 2. – С.161-184.
5.Илькович М.М. Идиопатический фиброзирующий альвеолит // Болезни органов дыхания / Под ред. Н.Р.Палеева. – М.: Медицина, 2000. – С. 574-602.
6.Илькович М.М. Интерстициальные заболевания легких (диссеминированные процессы в легких) (продолжение) // Новые Санкт-Петербургские врачеб-
ные ведомости. – 2000. – №1. – С.29-31.
7.Илькович М.М. Токсический фиброзирующий альвеолит //Болезни органов дыхания / Под ред. Н.Р.Палеева. – М.: Медицина, 2000. – С. 603-609.
8.Орлова Г.П. Особенности клинических проявлений и диагностика экзогенного токсического альвеолита // Клиническая медицина. – 2002. – №1. – С.4446.
9.Шмелев Е.И. Дифференциальная диагностика интерстициальных болез-
ней легких // Consilium medicum. – 2003, том 5. – №4. – С. 176-181.
535
