
- •1 Вариант
- •6. 4123 (K2MnO4-зел/MnO серо-зел)
- •2 Вариант
- •3 Вариант
- •4 Вариант
- •22. Силаны: 23578910 23. 3)силиконы
- •5 Вариант
- •6 Вариант
- •7 Вариант
- •11. 15 (Незначительно р-м?)
- •8 Вариант
- •9 Вариант
- •25. Cd(hs)2, SeO3, NaClO4, Cr(oh)(no3)2,ZnPbO2.
- •10 Вариант
- •11 Вариант
- •12 Вариант
- •13.2 Hi возрастает, объясняется ум-м в этом же направлении энергии
1 Вариант
1. 2) тем сильнее окисл форма как окислитель и слабее ..
2. 2) так как цинк покрыт оксидной пленкой. Электроны переходят от цинка к железу, где связываются молекулами кислорода, цинк растворяется, но железо остается защищенным до тех пор, пока не будет разрушен весь слой цинка, на что требуется довольно много времени.
31).
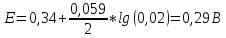
4. 4) MnO2+CaO=CaMnO3 / MnO2+HNO3(raz)=Mn(NO3)3+2H2O/MnO2+2NaOH-t=Na2MnO3+H2O
5. 4) 4NH4OH + CuSO4 = [Cu(NH3)4](OH)2 + 4H2O(уст. Компл. ярко-синего цвета)
6. 4123 (K2MnO4-зел/MnO серо-зел)
7.(3458)
2MnSO4 +
5PbO2 +
6HNO3 ![]() 2HMnO4 +
2PbSO4 +
3Pb(NO3)2 +
2H2O
2HMnO4 +
2PbSO4 +
3Pb(NO3)2 +
2H2O
8.(22) Ок-е Mn2+ +4H2O -5e=MnO4- + 8H+ |2
Вос-е : PbO2 +4H+ +2e=Pb2+ +2H2O |5 2Mn2++5PbO2+4H+=2MnO4- +5Pb2++2H2O 9.1) Cr(OH)2 + 2HCl(разб.) = CrCl2 + 2H2O
10.3) 2Cr+3CuSo4 =Cr2(So4)3+3Cu 11.4) 2Cr+3Br2=2CrBr3
12.1)Cr2O3+6HCl(k) =2CrCl3+3H2O 13. 3)W т.к. у него потенциал(0,05 В)наибольший из представленных.чтобы вытеснить водород из кислот нужно повысить температуру.
при комнатной температуре –реакция идти не будет.
14.1)CuSO3–нейтральная. гидролиз протекает практически полностью,т.к. оба продукта реакции уходят в виде осадка или газа. CuSO3 + H2O → Cu(OH)2↓ + SO2
15 2) К:Zn(2+)+2e = Zn А: 2H2O-4e =O2+4H\ 2ZnSO4 + 2H2O =2Zn+O2+ 2H2SO4
16.4? 17.(356) Cu2(OH)2CO3+2H2SO4 → 2CuSO4 +CO2 + 3H2O
18.5) K2SiO3 + CaCl2 = CaSiO3↓+2KCl 19. 2) 20.3) Mn2O7 + 2NaOH → 2NaMnO4 + H2O\ Mn2O7+14HCl=2MnCl2+7H2O +5Cl2 21.4) 22.5) 23.4)FeO+H2so4=feSO4+H20 FeO+4NaOH=Na4FeO3+2H2O
24. Гипохлорит бария. Оксид кремния (IV)\диоксид кремния Метаборная кислота\бромистая. Дигидрофосфат AL(дигидроортофосфат?). Цинкат Al
25. H3AsO3-ортомыш-я,AlSi3-силицид ал-я, Ba(MnO4)2-перманганат , FeOHCl, KH2SiO4-дигидроортосиликат
2 Вариант
1.1)катод имеет больший потенциал 2. 1)
3.T=273+46 φок/вос= φ0ок/вос +Rt/NF*ln[Pb]=-0.13-(8,31*319)/96485,35*Ln(0.003)=-0.21
4. 5)CoCl2+Mn=MnCl2+Co 5. 9) 1) Mn +4HNO3k= Mn(NO3)2+2NO2+2H2O 2)Mn(NO3)2+2KOH→2Mn(OH)2+2KNO3
3)Mn(OH)2 +H2O2→MnO2+2H2O…4)MnO2+4HCl=MnCl2+Cl2↑+2H2O…6.6)/MnO2+4H+2e=Mn+2+2H2O/2Cl-2e=cl2 7.2)…..8.2)Mn2O7 +2NaOH→2NaMnO4 +H2O…/Mn2O7 +H2O→2HMnO4(амф.)MnO+2HCl=MnCl2 +H2O. Mn2O3+H2SO4=MnO2+MnSO4+H2O / MnO2+CaO=CaMnO3 / 9.3 K2Cr2O7+KOH=K2CrO4 / 10.(3.4.7.10) 6FeSO4+7H2SO4(разб.)+K2Cr2O7=3Fe2(SO4)3+Cr2(SO4)3 + 7H2O + K2SO4 / 11.169) (NH4)2Cr2O7= Cr2O3 +N2 + 4H2O 12. 36306) (KCrO3Cl) +6. Cr(CO)6 0. \ 13.26)
14. 368 15.3) AgNO3+KCl =KNO3+AgCl↓ 16.3) NaHCO3 +NaOH → Na2CO3 + H2O
17. 2) CuOHCl+HCl=CuCl2+H2O 18.4) 2Co(OH)NO3+Ca(OH)2=2Co(OH)2+Ca(NO3)2
19. 3! P2O5+H2O=2HPO3 20. 14567
20.15467 2Zn+O2 =2ZnO; ZnCO3 =ZnO+CO2.2Zn(NO3)2=2ZnO+4NO2↑+O2↑..Zn(OH)2 =ZnO +H2O Zn+H2O = ZnO + H2
21
Г)
PbO2 +
2NaOH + 2H2O ![]() Na2[Pb(OH)6]
22.(1,5,6,7)
2NaOH
+ Cr2O3 = 2NaCrO2 +
H2O
Na2[Pb(OH)6]
22.(1,5,6,7)
2NaOH
+ Cr2O3 = 2NaCrO2 +
H2O
\ 2NaOH
+ CO2 →
Na2CO3 +
H2O
ZnO + 2NaOH ![]() Na2ZnO2 +
H2O
Al2O3 +
2NaOH
Na2ZnO2 +
H2O
Al2O3 +
2NaOH ![]() 2NaAlO2 +
H2
2NaAlO2 +
H2
