
- •Энергия Гиббса и направление протекания реакции
- •Способы выражения константы равновесия
- •Стандартная константа равновесия
- •Константа равновесия реакций в гетерогенных системах
- •Константа равновесия и изменение энергии Гиббса
- •Зависимость константы равновесия от температуры
- •Константа равновесия и константа скорости реакции
- •Методы расчета константы равновесия
- •Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
- •Водородная шкала потенциалов.
Водородная шкала потенциалов.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым — стандартный водородный электрод. Схему такого элемента записывают следующим образом: слева — водородный электрод, справа — измеряемый электрод. Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид
![]()
а схема элемента для измерения потенциала медного электрода
![]()
ЭДС элемента равна разности потенциалов правого и левого электродов:
![]()
А так как потенциал левого электрода условно принимается равным нулю, то ЭДС измеряемого элемента будет равна потенциалу правого электрода. Таким образом, электродный потенциал по водородной шкале Е — это ЭДС электрохимической системы, в которой справа расположен данный электрод, а слева — стандартный водородный электрод.
Обычно индексы «п» и «л» при обозначении потенциалов опускаются, и потенциалы записываются через «фи» с индексами исходных веществ и продуктов реакции.
По отношению к системе Н2/2Н+ некоторые вещества будут вести себя как окислители, другие — как восстановители. В настоящее время получены стандартные потенциалы практически всех металлов и многих неметаллов, которые характеризуют относительную способность восстановителей или окислителей к отдаче или захвату электронов.
Потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак “-“, а знаком “+” отмечены потенциалы электродов, являющихся окислителями.
Если расположить металлы в порядке возрастания их стандартных электродных потенциалов, то образуется так называемый электрохимический ряд напряжений металлов:
Li, Rb, К, Ва, Sr, Са, Nа, Мg, Аl, Мn, Zn, Сr, Fе, Сd, Со, Ni, Sn, Рb, Н, Sb, Вi, Сu, Hg, Аg, Рd, Рt, Аu.
Ряд напряжений характеризует химические свойства металлов.
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него. Исключениями являются лишь щелочные и щелочноземельные металлы, которые не будут восстанавливать ионы других металлов из растворов их солей. Это связано с тем, что в этих случаях с большей скоростью протекают реакции взаимодействия металлов с водой.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах, поскольку потенциалы учитывают особенности взаимодействия того или иного иона с молекулами растворителя. Именно поэтому электрохимический ряд начинается литием, тогда как более активные в химическом отношении рубидий и калий находятся правее лития. Это связано с исключительно высокой энергией процесса гидратации ионов лития по сравнению с ионами других щелочных металлов.
Алгебраическое значение стандартного окислительно-восстановительного потенциала характеризует окислительную активность соответствующей окисленной формы. Поэтому сопоставление значений стандартных окислительно-восстановительных потенциалов позволяет ответить на вопрос: протекает ли та или иная окислительно-восстановительная реакция?
Так, все полуреакции окисления галогенид-ионов до свободных галогенов
2Cl-- 2e = Сl2 Е0= -1,36 В (1)
2Br--2е = Вr2 E0 = -1,07 В (2)
2I--2е = I2 E0 = -0,54 В (3)
могут быть реализованы в стандартных условиях при использовании в качестве окислителя оксида свинца (IV) (Е0 = 1,46 В) или перманганата калия (Е0 = 1,52 В). При использовании дихромата калия (E0 = 1,35 В) удается осуществить только реакции (2) и (3). Наконец, использование в качестве окислителя азотной кислоты (E0 = 0,96 В) позволяет осуществить только полуреакцию с участием иодид-ионов (3).
Таким образом, количественным критерием оценки возможности протекания той или иной окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления.
25. (окислительно-восстановительные) потенциалы и определение направления самопроизвольного протекания ОВР.
Количественной характеристикой окислительно-восстановит. вещ-в, находящихся в растворах или соприкасающихся с ними, являются окислительно-восстановительные/электродные потенциалы.
Величина ОВП зависит от:
- природы вещ-в, участвующих в электродном процессе Men++ne↔Me
- соотношения конц-й окисленной и восстановленной форм этих вещ-в
- от tо
- от природы растворителя
- pH среды
Эта зависимость описывается уравнением Нернста:

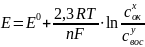
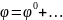
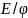 –
электродный потенциал
при данных усл-х
–
электродный потенциал
при данных усл-х
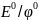 –
стандартный потенциал,
измеренный при Т=298К (25гр.), при давлении
для газообразных вещ-в 101,3кПа и конц-ии
1моль/л
–
стандартный потенциал,
измеренный при Т=298К (25гр.), при давлении
для газообразных вещ-в 101,3кПа и конц-ии
1моль/л
 –
ур-еНернста для
металлич. электрода
–
ур-еНернста для
металлич. электрода
Обычно пользуются относит-ми значениями ОВП, т.к. абсолютныезнач-я определить невозможно.
Пользуясь табл.стандартных электродных потенциалов, можно опред. направление любой ОВР, протекающей в растворе. Окислительная способность проявл. в большей степени у того вещ-ва, которое в роли окислителя при одинак. усл-ях имеет более высокое знач-е электродного потенциала. Восстановительная способность вещ-ва тем выше, чем меньше значение стандартного электродного потенциала.
Для самопроизвольно протекающих реакций окисления-восстановления выполняется критерий ΔG°298 << 0 и, следовательно, (ϕ°Ок - ϕ°Вос) >>0. Такие реакции идут в прямом направлении; степень их протекания тем выше, чем больше разность (ϕ°Ок - ϕ°Вос).При ΔG°298 >> 0 и, следовательно, (ϕ°Ок - ϕ°Вос) « 0 реакции в прямом направлении протекать не будут, но термодинамически возможными становятся обратные реакции. Например, реакция (Mn2+ - восстановитель, I2 - окислитель)
26.
