
- •Первое начало термодинамики
- •Основные термодинамические понятия
- •Применение 1-го начала термодинамики к изопроцессам идеального газа
- •Первый закон термодинамики
- •Формулировка первого закона термодинамики
- •20 Века часть может преобразовать целое радикальным и неожиданным образом.
- •Глава 1
- •III. Основы термодинамики
- •3.1. Теплота и работа
- •Термодинамика, ее основные понятия: внутренняя энергия, температура, теплота, работа. Закон сохранения энергии. Первое начало термодинамики.
Чем отличается обратимый процесс от необратимого? От обратного?
Охарактеризуйте равновесное состояние. Можно ли реализовать равновесный процесс?
Что такое цикл?
При каких условиях должна работать идеальная машина Карно?
Из каких процессов состоит цикл Карно?
Почему в выражении для работы за цикл идеальной машины Карно не входит работа, совершенная при адиабатных процессах?
Чему равен КПД идеальной машины Карно? Что характеризуют температуры
 в
формуле для идеальной машины Карно?
в
формуле для идеальной машины Карно?Как работают холодильная машины и тепловой насос?
Что такое энтропия?
Чему равно приращение энтропии
 при
протекании обратимого процесса?
при
протекании обратимого процесса?Как изменяется энтропия при протекании необратимого процесса в адиабатически изолированной системе?
Что такое термодинамическая вероятность?
Как связана энтропия с термодинамической вероятностью?
Сформулируйте 2-ое начало термодинамики.
Первый закон термодинамики
Существует две формы передачи энергии от одних тел к другим — это совершение работы одних тел над другими и передача теплоты. Энергия механического движения может переходить в энергию теплового движения и наоборот. В таких переходах энергии выполняется закон сохранения энергии. В применении к процессам, рассматриваемым в термодинамике, закон сохранения энергии именуется первым законом (или первым началом) термодинамики. Этот закон является обобщением эмпирических данных.
Формулировка первого закона термодинамики
Первый закон термодинамики формулируют следующим образом:
Количество теплоты, которое подводится к системе, расходуется на совершение данной системой работы (против внешних сил) и изменение ее внутренней энергии. В математическом виде первый закон термодинамики можно записать в интегральном виде:

где
 –
количество теплоты, которое получает
термодинамическая система;
–
количество теплоты, которое получает
термодинамическая система;
 –
изменение внутренней энергии
рассматриваемой системы; A – работа,
которую выполняет система над внешними
телами (против внешних сил).
–
изменение внутренней энергии
рассматриваемой системы; A – работа,
которую выполняет система над внешними
телами (против внешних сил).
В дифференциальном виде первый закон термодинамики записывают как:

где
 –
элемент количества теплоты, который
получает система;
–
элемент количества теплоты, который
получает система;
 –
бесконечно малая работа, которую
выполняет термодинамическая система;
–
бесконечно малая работа, которую
выполняет термодинамическая система;
 –
элементарное изменение внутренней
энергии, рассматриваемой системы.
Следует обратить внимание на то, что в
формуле (2)
–
элементарное изменение внутренней
энергии является полным дифференциалом,
в отличие от
и
.
–
элементарное изменение внутренней
энергии, рассматриваемой системы.
Следует обратить внимание на то, что в
формуле (2)
–
элементарное изменение внутренней
энергии является полным дифференциалом,
в отличие от
и
.
Количество теплоты считают положительным, если система тепло получает и отрицательным, если тепло отводится от термодинамической системы. Работа будет больше нуля, если ее совершает система, и работа будет считаться отрицательной, если она совершается над системой внешними силами.
В то случае, если система вернулась в первоначальное состояние, то изменение ее внутренней энергии будет равно нулю:
1
Предмет технической термодинамики.
Параметры состояния рабочего тела.
Уравнения состояния идеального газа.
Термодинамический процесс.
Теплотехника
– наука, которая изучает методы получения,
преобразования, передачи и использования
теплоты, а также принципы действия и
конструктивные особенности тепловых
машин, аппаратов и устройств. Теплота
используется во всех областях деятельности
человека. Для установления наиболее
рациональных способов его использования,
анализа экономичности рабочих процессов
тепловых установок и создания новых,
наиболее совершенных типов тепловых
агрегатов необходима разработка
теоретических основ теплотехники.
Различают два принципиально различных
направления использования теплоты –
энергетическое и технологическое. При
энергетическом использовании, теплота
преобразуется в механическую работу,
с помощью которой в генераторах создается
электрическая энергия, удобная для
передачи на расстояние. Теплоту при
этом получают сжиганием топлива в
котельных установках или непосредственно
в двигателях внутреннего сгорания. При
технологическом - теплота используется
для направленного изменения свойств
различных тел (расплавления, затвердевания,
изменения структуры, механических,
физических, химических свойств).
^
Термодинамическая система
Техническая
термодинамика (т/д) рассматривает
закономерности взаимного превращения
теплоты в работу. Она устанавливает
взаимосвязь между тепловыми, механическими
и химическими процессами, которые
совершаются в тепловых и холодильных
машинах, изучает процессы, происходящие
в газах и парах, а также свойства этих
тел при различных физических
условиях.
Термодинамика базируется
на двух основных законах (началах)
термодинамики:
I закон термодинамики
- закон превращения и сохранения
энергии;
II закон термодинамики –
устанавливает условия протекания и
направленность макроскопических
процессов в системах, состоящих из
большого количества частиц.
Техническая
т/д, применяя основные законы к процессам
превращения теплоты в механическую
работу и обратно, дает возможность
разрабатывать теории тепловых двигателей,
исследовать процессы, протекающие в
них и т.п.
Объектом исследования
является термодинамическая система,
которой могут быть группа тел, тело или
часть тела. То что находится вне системы
называется окружающей средой. Т/д система
это совокупность макроскопических тел,
обменивающиеся энергией друг с другом
и окружающей средой. Например: т/д система
– газ, находящейся в цилиндре с поршнем,
а окружающая среда – цилиндр, поршень,
воздух, стены помещения.
Изолированная
система - т/д система не взаимодействующая
с окружающей средой.
Адиабатная
(теплоизолированная) система – система
имеет адиабатную оболочку, которая
исключает обмен теплотой (теплообмен)
с окружающей средой.
Однородная
система – система, имеющая во всех своих
частях одинаковый состав и физические
свойства.
Гомогенная система –
однородная система по составу и
физическому строению, внутри которой
нет поверхностей раздела (лед, вода,
газы).
Гетерогенная система –
система, состоящая из нескольких
гомогенных частей (фаз) с различными
физическими свойствами, отделенных
одна от другой видимыми поверхностями
раздела (лед и вода, вода и пар).
В
тепловых машинах (двигателях) механическая
работа совершается с помощью рабочих
тел – газ, пар.
^
Параметры состояния
Величины,
которые характеризуют физическое
состояние тела называются термодинамическими
параметрами состояния. Такими параметрами
являются удельный объем, абсолютное
давление, абсолютная температура,
внутренняя энергия, энтальпия, энтропия,
концентрация, теплоемкость и т.д. При
отсутствии внешних силовых полей
(гравитационного, электромагнитного и
др.) термодинамическое состояние
однофазного тела можно однозначно
определить 3-мя параметрами – уд. объемом
(υ), температурой (Т), давлением (Р).
Удельный объем – величина,
определяемая отношением объема вещества
к его массе.υ = V / m , [м3/кг] , (1.1)Плотность
вещества – величина, определяемая
отношением массы к объему вещества.ρ =
m / V , [кг/м3] , (1.2)
υ = 1 / ρ ; ρ = 1 / υ ; υ
• ρ = 1 . (1.3)Давление – с точки зрения
молекулярно-кинетической теории есть
средний результат ударов молекул газа,
находящихся в непрерывном хаотическом
движении, о стенку сосуда, в котором
заключен газ.Р = F / S ; [Па] = [Н/м2]
(1.4)Внесистемные единицы давления:
1
кгс/м2 = 9,81 Па = 1 мм.водн.ст.
1 ат.
(техн.атмосфера) = 1 кгс/см2 = 98,1 кПа.
1
атм. (физическая атмосфера) = 101,325 кПа =
760 мм.рт.ст.
1 ат. = 0,968 атм.
1 мм.рт.ст.
= 133,32 Па.
1 бар = 0,1 МПа = 100 кПа = 105
Па.
Различают избыточное и абсолютное
давление.
Избыточное давление (Ри)–
разность между давлением жидкости или
газа и давлением окружающей среды.
Абсолютное
давление (Р)– давление отсчитываемое
от абсолютного нуля давления или от
абсолютного вакуума. Это давление
является т/д параметром состояния.
Абсолютное
давление определяется:
1). При давлении
сосуда больше атмосферного:Р = Ри + Ро ;
(1.5)2). При давлении сосуда меньше
атмосферного:Р = Ро + Рв ; (1.6)где Ро –
атмосферное давление;
Рв – давление
вакуума.
Температура – характеризует
степень нагретости тел, представляет
собой меру средней кинетической энергии
поступательного движения его молекул.
Чем больше средняя скорость движения,
тем вышетемпература тела.
За т/д
параметр состояния системы принимают
термодинамическую температуру (Т), т.е.
абсолютную температуру. Она всегда
положительна, При температуре абсолютного
нуля (Т=0) тепловые движения прекращаются
и эта температура является началом
отсчета абсолютной температуры.
^
Уравнение состояния и термодинамический
процесс
Основные
т/д параметры состояния Р, υ, Т однородного
тела зависят друг от друга и взаимно
связаня между собой определенным
математическим уравнением, который
называется уравнением состояния:f (Р,
υ, Т) = 0 . (1.7)
Равновесным состоянием
называется состояние тела, при котором
во всех его точках объема Р, υ и Т и все
другие физические свойства
одинаковы.
Совокупность изменений
состояния т/д системы при переходе из
одного состояния в другое называется
т/д процессом. Т/д процессы бывают
равновесные и неравновесные. Если процес
проходит через равновесные состояния,
то он называется равновесным. В реальных
случаях все процессы являются
неравновесными.
Если при любом т/д
процессе изменение параметра состояния
не зависит от вида процесса, а определяется
начальным и конечным состоянием, то
параметры состояния называются функцией
состояния. Такими параметрами являются
внутренняя энергия, энтальпия, энтропия
и т.д.
Интенсивные параметры – это
параметры не зависящие от массы системы
(давление, температура).
Аддитивные
(экстенсивные) параметры – параметры,
значения которых пропорциональны массе
системы (Объем, энергия, энтропия и
т.д.).
^
2.Первый закон термодинамики. Работа,
теплота, внутренняя энергия,
энтальпия
Теплота
и работа
Тела,
участвующие при протекании т/д процесса
обмениваются энергией. Передача энергии
от одного тела к другому происходит
двумя способами.
1-й способ реализуется
при непосредственном контакте тел,
имеющих различную температуру, путем
обмена кинетической энергией между
молекулами соприкасающихся тел либо
лучистым переносом внутренней энергии
излучающих тел путем э/м волн. При этом
энергия передается от более нагретого
к менее нагретому.
Количество энергии,
переданной 1-м способом от одного тела
к другому, называется количеством
теплоты – Q [Дж], а способ – передача
энергии в форме теплоты.
2-й способ
связан с наличием силовых полей или
внешнего давления. Для передачи энергии
этим способом тело должно либо
передвигаться в силовом поле, либо
изменять свой объем под действием
внешнего давления, То есть передачи
энергии происходит при условии перемещения
всего тела или его части в пространстве.
При этом количество переданной энергии
называется работой – L [Дж], а способ
передача энергии в форме работы.
Количество
энергии, полученное телом в форме работы
называется работой совершенной над
телом, а отданную энергию – затраченной
телом работой.
Количество теплоты,
полученное (отданное) телом и работа,
совершенная (затраченная) над телом,
зависят от условий перехода тела из
начального состояния в конечное, т.е.
зависят от характера т/д процесса.
^
Внутренняя энергия
В
общем случае внутренней энергией
называется совокупность всех видов
энергий, заключенной в теле или системе
тел. Эту энергию можно представить как
сумму отдельных видов энергий: кинетической
энергии молекул (поступательного и
вращательного движения молекул);
колебательного движения атомов в самой
молекуле; энергии электронов; внутриядерной
энергии; энергии взаимодействия между
ядром молекулы и электронами; потенциальной
энергии молекул.
В технической
термодинамике рассматриваются только
такие процессы, в которых изменяются
кинетическая и потенциальная составляющие
внутренней энергии. При этом знание
абсолютных значений внутренней энергии
не требуется. Поэтому внутренней энергией
для идеальных газов называют кинетическую
энергию движения молекул и энергию
колебательных движений атомов в молекуле,
а для реальных газов дополнительно
включают потенциальную энергию
молекул.
Внутренняя энергия (U) является
функцией двух основных параметров
состояния газа, т.е. U = f (P,T), U = f (υ ,T) U= f
(P,υ). Κаждому состоянию рабочего тела
(системы) соответствует вполне определенное
значение параметров состояния, то для
каждого состояния газа будет характерна
своя однозначная, вполне определенная
величина внутренней энергии U. То есть
U является функцией состояния газа. И
разность внутренних энергий для двух
каких-либо состояний рабочего тела или
системы тел не будет зависит от пути
перехода от первого состояния во
второе.
^
Первый закон термодинамики
Первый
закон термодинамики является основой
термодинамической теории и имеет
огромное прикладное значение при
исследовании термодинамических
процессов. Этот закон является законом
сохранения и превращения энергии:
¦"Энергия
не исчезает и не возникает вновь, она
лишь переходит
¦из
одного вида в другой в различных
физических процессах".
^
Для термодинамических процессов закон
устанавливает взаимосвязь между
теплотой, работой и изменением внутренней
энергии т/д системы:
¦"Теплота,
подведенная к системе, расходутся на
изменение энергии ¦системы и совершение
работы".
^
Уравнение первого закона термодинамики
имеет следующий вид: Q = (U2 – U1) + L , (2.1)где
Q - количества теплоты подведенная
(отведенная) к системе;
L
- работа, совершенная системой (над
системой);
(U2
– U1) - изменение внутренней энергии в
данном процессе.
Если:
Q
> 0 – теплота подводится к системе;
Q
< 0 – теплота отводится от системы;
L
> 0 –работа совершается системой;
L
< 0 – работа совершается над системой.
Для
единицы массы вещества уравнение первого
закона термодинамики имеет вид:q = Q /m =
(u2 – u1) + l . (2.2)
В дальнейшем все
формулы и уравнения будут даны в основном
для единицы массы вещества.
1-й
закон т/д указывает, что для получения
полезной работы (L) в непрерывно действующем
тепловом двигателе надо подводить
(затрачивать) теплоту (Q).
Двигатель,
постоянно производящий работу и не
потребляющий никакой энергии называется
вечным двигателем I рода."
Из
этого можно высказать следующее
определение 1-го закона термодинамики:
" Вечный двигатель первого
рода невозможен".
Энтальпия
Рассмотрим
полную энергию газа, находящегося под
давлением Р , создаваемым грузом массой
. В этом случае полная энергия системы
состоит из внутренней энергии газа U и
потенциальной энергии груза, равной ,
![]() где
где
![]() -
площадь поперечного сечения поршня. Т.
е.
-
площадь поперечного сечения поршня. Т.
е.
![]() .
Величина
.
Величина
![]() ,
зависящая от сил, действующих на поршень,
получила название потенциальной энергии
давления.
Таким образом, если газ
находится в среде с давлением P , то с
любым состоянием его связана некоторая
энергия
,
зависящая от сил, действующих на поршень,
получила название потенциальной энергии
давления.
Таким образом, если газ
находится в среде с давлением P , то с
любым состоянием его связана некоторая
энергия![]() , получившая название энтальпии газа в
данном состоянии. Выражение энтальпии
для 1 кг газа (т. е. удельной энтальпии)
имеет вид .
, получившая название энтальпии газа в
данном состоянии. Выражение энтальпии
для 1 кг газа (т. е. удельной энтальпии)
имеет вид .
![]() Следовательно,
удельная энтальпия, будучи зависимой
от параметров состояния u,p , и v , также
является параметром состояния. Поэтому
изменение
Следовательно,
удельная энтальпия, будучи зависимой
от параметров состояния u,p , и v , также
является параметром состояния. Поэтому
изменение![]() , как и изменение
, как и изменение
![]() ,
не зависит от характера процесса, а
определяется только начальным и конечным
состояниями, т. е. .
,
не зависит от характера процесса, а
определяется только начальным и конечным
состояниями, т. е. .
![]() Как
однозначная функция состояния удельная
энтальпия может быть представлена в
виде функции любой пары основных
параметров состояния.
Удельная
энтальпия идеального газа, как и его
удельная внутренняя энергия, является
функцией только температуры. Действительно:
.
Как
однозначная функция состояния удельная
энтальпия может быть представлена в
виде функции любой пары основных
параметров состояния.
Удельная
энтальпия идеального газа, как и его
удельная внутренняя энергия, является
функцией только температуры. Действительно:
.![]() Удельная
энтальпия, как и удельная внутренняя
энергия, выражается в джоулях на килограмм
(Дж/кг).
^
3 Вывод 1закона через энтальпию, через
энтропию
Энтальпия
Ранее
была приведена так называемая интегральная
форма записи первого закона (1), согласно
которой для произвольного количества
вещест
Удельная
энтальпия, как и удельная внутренняя
энергия, выражается в джоулях на килограмм
(Дж/кг).
^
3 Вывод 1закона через энтальпию, через
энтропию
Энтальпия
Ранее
была приведена так называемая интегральная
форма записи первого закона (1), согласно
которой для произвольного количества
вещест![]() Для
1 кг вещества:
Для
1 кг вещества:
![]() Дифференциальная
форма записи уравнения первого закона
при анализе термодинамических процессов
часто оказывается более удобной.
Уравнение первого закона термодинамики
можно представить в другом виде. К
выражению
Дифференциальная
форма записи уравнения первого закона
при анализе термодинамических процессов
часто оказывается более удобной.
Уравнение первого закона термодинамики
можно представить в другом виде. К
выражению
![]() прибавим
и вычтем слагаемое Vdp:
прибавим
и вычтем слагаемое Vdp:
![]() Последнее
слагаемое представляет собой элементарную
располагаемую работу. Функцию
Последнее
слагаемое представляет собой элементарную
располагаемую работу. Функцию
![]() измеряемую
в Дж, в термодинамике называют энтальпией.
Энтальпия, отнесенная к 1 кг
измеряемую
в Дж, в термодинамике называют энтальпией.
Энтальпия, отнесенная к 1 кг
![]() называется
удельной энтальпией. Входящие в выражение
(19) величины u, p, υ являются параметрами
состояния, поэтому и сама энтальпия
также будет параметром (функцией)
состояния. Тогда аналитические выражения
для первого закона примут вид:
называется
удельной энтальпией. Входящие в выражение
(19) величины u, p, υ являются параметрами
состояния, поэтому и сама энтальпия
также будет параметром (функцией)
состояния. Тогда аналитические выражения
для первого закона примут вид:
![]()
![]()
![]() Записывая
последнее выражение для изобарного
процесса p=const, получаем:
Записывая
последнее выражение для изобарного
процесса p=const, получаем:
![]() т.е.
изменение энтальпии численно равно
количеству теплоты, подводимому к
системе в изобарном процессе. Тогда
можно записать:
т.е.
изменение энтальпии численно равно
количеству теплоты, подводимому к
системе в изобарном процессе. Тогда
можно записать:
![]() В
заключение следует отметить, что общее
уравнение первого закона термодинамики
В
заключение следует отметить, что общее
уравнение первого закона термодинамики
![]()
1-й закон термодинамики, внутренняя энергия, тепло, работа, энтальпия, энтропия.
Первый закон термодинамики гласит, (4 разные формулировки) что :
Энергия не может быть создана или уничтожена (закон сохранения энергии), она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы против внешних сил.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе и не зависит от способа, которым осуществляется этот переход.
Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Первый закон термодинами гласит, что энергия не может быть создана или уничтожена. Таким образом, энергия системы (замкнутой) - постоянна. Тем не менее, энергия может быть передана от одного элемента системы другому. Рассмотрим замкнутую систему, изолированную от остальных.
Передача энергии между различными подсистемами в ней может быть описана как :
E1 = E2
где
E1 = начальная энергия
E2 = конечная энергия
Внутрення энергия включает :
Кинетическую энергию движения атомов
Потенциальную энергию хранящуюся в химических связях
Гравитационную энергию системы
Первый закон является основой для термодинамической науки и инженерного анализа.
Базируется на возможных типах обмена (энергии), ниже приведены 3 типа систем:
пред - изолированные системы (isolated systems): отсутствует обмен элементами системы или энергией
закрытые системы (closed systems): отсутствует обмен элементами системы, но присутствует некоторый обмен энергией
открытые системы (open systems): возможен обмен как элементами системы, так и энергией
Первый закон термодинамики помогает использовать ключевые концепции внутренней энергии (internal energy), тепла (heat), и работы системы (system work). которые широко используются в описании тепловых систем (heat engines).
Внутренняя энергия ( Internal Energy) - Внутренняя энергия определяется как энергия случайных, находящихся в неупорядченном движении молекул. Энергия молекул находится в диапазоне от высокой, необходимой для движения, до заметной лишь с помощью микроскопа энергии на молекулярном или атомном уровне. Например, у стакана с водой комнатной температы, стоящего на столе нет, на первый взгляд, никакой энергии: ни кинетической, ни потенциальной относительно стола. Но, с помощью микроскопа становится заметна "бурлящая" масса быстро двигающихся молекул. Если выплеснуть воду из стакана, эта микроскопическая энергия не обязательно заметно изменится, когда мы усредним добавленную кинетическую энергию на все молекулы воды.
Тепло - Тепло может быть определено, как энергия, передаваемая от объекта с более высокой температурой к объекту с менее высокой температурой. Сам по себе объект не обладает "теплом"; соответствующий термин для микроскопической энергии объекта - внутренняя энергия. Внутренняя энергия может увеличиваться путем переноса энергии к объекту от объекта, имеющего температуру выше - этот процесс называется нагревом.
Работа - Когда работа совершается термодинамической системой (чаще всего это газ, который совершает работу), то работа совершенная газом при постоянном давлении определяется как : W = p dV, где W - работа, p - давление, а dV -изменение объема. В случаях когда давление не является постоянным, работа может быть представлена интегральным образом, как площадь поверхности под кривой в координатах давление, объем, которые представляют происходящий процесс.
Изменение внутренней энергии системы равно теплу (добавленному системе) минус работа, совершенная системой
dE = Q - W
где
dE = изменение внутренней энергии
Q = добавленное тепло
W =работа системы
1й закон не дает информации о характере процесса и не определяет конечного состояния равновесия. Интуитивно мы понимаем, что энергия переходит от объекта с более высокой температурой к объекту с менее высокой температурой. Таким образом, 2й закон нам нужен для получения информации о характере процесса.
Энтальпия -
это "термодинамический потенциал " используемый в химической термодинамике реакций и не циклических процессов.
однозначная функция состояния термодинамической системы при независимых параметрах энтропии и давления, связана с внутренней энергией соотношением, приведенным ниже.
это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Энтальпия определяется как:
H = U + PV
где
H = энтальпия
U = внутренняя энергия
P = давление
V = объем системы
При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе, поэтому энтальпию часто называют тепловой функцией или теплосодержанием. В состоянии термодинамического равновесия энтальпия системы минимальна.
Энтальпия является точно измеряемым параметром, когда определены способы выражения трех других поддающихся точному определению параметров формулы выше.
Энтропия.
Термин "энтропия" - величина, характеризующая степень неопределенности системы.
Однако, в термодинамике это понятие используется для определения связанной энергии системы. Энтропия определяет способность одной системы влиять на другую. Когда объекты пересекают нижнюю границу энергетического уровня необходимого для воздействия на окружающую среду, энтропия возрастает.Энтропия связана со вторым законом термодинамики.
Энтропия (обычно обозначается S), функция состояния термодинамической системы, изменение которой dS в равновесном процессе равно отношению количества теплоты dQ, сообщенного системе или отведенного от нее, к термодинамической температуре Т системы.
в символьном виде записывается, как
dS=(dQ)/T
где
dS - изменение термодинамической системы
dQ - количество теплоты, сообщенное системе
T - термодинамическая температура системы
Неравновесные процессы в изолированной системе сопровождаются ростом энтропии, они приближают систему к состоянию равновесия, в котором S максимальна (закон неубывания энтропии).
Для вселенной в целом энтропия возрастает.
Закон сохранения энергии Закон сохранения энергии для количества теплоты как формы энергии может быть записан в виде: δQ=dU+δA (1). или CdT=dU+δA (2), где C -- теплоемкость системы. В термодинамике уравнение (1) является крайне важным и называется первым началом. В отличие от закона сохранения их механики, первое начало термодинамики содержит бесконечно малое количество теплоты δQ. Мы знаем, что изучение разного рода переходов именно этой формы энергии -- предмет термодинамики. Очень часто уравнение (1) записывается в виде: δQ=dU+pdV (3). Уравнения (1), (2) и (3) записаны в дифференциальной форме. В связи с тем, что теплота и работа не являются функциями состояния, то для бесконечно малого количества теплоты и элементарной работы используют обозначение δQ, а не dQ и δA, а не dA. Этим подчёркивается, что δQ и δA не рассматриваются как полные дифференциалы, т.е. невсегда могут быть представлены как бесконечно малые приращения функций состояния (только в частных случаях). Первое начало термодинамики не может предсказать направление развития процесса. Этот закон лишь констатирует факт изменения величин в процессе и говорит о величине их изменения. Забегая вперед, скажем, что второе начало термодинамики определяет направление процесса. В том случае, если рассматривается круговой процесс (система возвращается в исходное состояние), изменение внутренней энергии системы dU=0, то первое начало термодинамики говорит о том, что все тепло, которое получила система, идет на совершение этой системой работы. Интегральная форма первого начала термодинамики Первое начало термодинамики можно записать и в интегральной форме: Q=△U+A (4). На словах уравнение (4) означает, что подводимая к системе теплота идет на изменение внутренней энергии системы и совершение этой системой работы. Обратимся опять к круговому процессу (△U). Если в круговом процессе тоQ=0, то A=0. Это означает, что невозможен процесс производства работы без какого-то ни было изменения во внешних к системе телах. Или говорят по-другому: не возможен вечный двигатель первого рода. Рассмотрим изохорный процесс. При постоянном объеме система работу не совершает. В таком случае: Q=△U(5) говорят, что все подводимое к системе тепло идет на изменение (увеличение) внутренней энергии системы. В изотермическом процессе внутренняя энергия системы неизменна, следовательно: Q=A (6) все подводимое системе тепло идет на совершение системой работы. Информация взята с сайта биржи Автор24: https://avtor24.ru/spravochniki/fizika/termodinamika/pervoe_nachalo_termodinamiki/ .
Внутренняя
энергия газа (и другой термодинамической
системы) может изменяться в основном
за счет двух процессов: совершения над
газом работы
![]() и
сообщением ему количества тепла Q
.
Так как состояние газа может одинаково
изменяться от совершенной над ним работы
и
сообщенного ему количества тепла Q
,
то работа и теплота являются эквивалентными
формами передачи энергии. Теплота
- это форма передачи энергии на уровне
микроскопических процессов, когда,
например, молекулы газа, соударяясь с
разогретыми стенками (молекулами)
сосуда, получают от них дополнительную
кинетическую энергию. Работа
над газом - это передача энергии в форме
макропроцессов. Когда поршень, перемещаясь
в некотором цилиндре, сжимает газ, то
молекулам газа за счет движения поршня
передается дополнительная энергия и
газ нагревается.
и
сообщением ему количества тепла Q
.
Так как состояние газа может одинаково
изменяться от совершенной над ним работы
и
сообщенного ему количества тепла Q
,
то работа и теплота являются эквивалентными
формами передачи энергии. Теплота
- это форма передачи энергии на уровне
микроскопических процессов, когда,
например, молекулы газа, соударяясь с
разогретыми стенками (молекулами)
сосуда, получают от них дополнительную
кинетическую энергию. Работа
над газом - это передача энергии в форме
макропроцессов. Когда поршень, перемещаясь
в некотором цилиндре, сжимает газ, то
молекулам газа за счет движения поршня
передается дополнительная энергия и
газ нагревается.
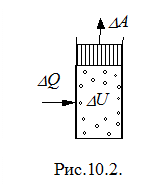 Исторически
развитие термодинамики было связано с
необходимостью теоретического объяснения
работы теплового двигателя. При сжигании
топлива выделялось определенное
количество тепла, и некоторая часть его
DQ
(рис.10.2) передавалась рабочему телу
(обычно газу). Газ нагревался, и его
внутренняя энергия увеличивалась на
величину DU.
Расширяясь, газ совершал работу DA.
Отсюда принято считать DQ
>
0, когда термодинамическая система
получает тепло, иDA
> 0 , когда эта система совершает работу.
Огромная совокупность опытных фактов
с учетом законов сохранения показывала,
что в термодинамической системе, в
которой протекают тепловые и механические
процессы, всегда должно выполняться
равенство
Исторически
развитие термодинамики было связано с
необходимостью теоретического объяснения
работы теплового двигателя. При сжигании
топлива выделялось определенное
количество тепла, и некоторая часть его
DQ
(рис.10.2) передавалась рабочему телу
(обычно газу). Газ нагревался, и его
внутренняя энергия увеличивалась на
величину DU.
Расширяясь, газ совершал работу DA.
Отсюда принято считать DQ
>
0, когда термодинамическая система
получает тепло, иDA
> 0 , когда эта система совершает работу.
Огромная совокупность опытных фактов
с учетом законов сохранения показывала,
что в термодинамической системе, в
которой протекают тепловые и механические
процессы, всегда должно выполняться
равенство
DQ = DU + DA . (10.3)
Уравнение (10.3) представляет собой содержание первого начала(закона) термодинамики. Словами его можно выразить следующим образом: количество тепла DQ , сообщенное системе, идет на приращение внутренней энергии системы DU и на совершение системой работы DA над внешними телами.
Следует отметить, что в равенстве (10.3) величина U является функцией состояния и однозначно определяется термодинамическими параметрами состояния. Величины Q и A не есть функции состояния. Они зависят не только от начального и конечного состояния системы, но и от пути изменения ее состояния.
Из равенства (10.3) следует, что единицей измерения тепла служит джоуль
ВВЕДЕНИЕ.
Наука зародилась очень давно, на Древнем Востоке, и затем интенсивно развивалась в Европе. В научных традициях долгое время оставался недостаточно изученным вопрос о
взаимоотношениях целого и части. Как стало ясно в середине
