
- •Курс лекций по общей химии
- •Содержание тем:
- •1. Химия и экология
- •Охрана воздушного бассейна
- •2.Строение атома
- •2.1. Квантовые числа
- •2.2. Принцип Паули
- •2.3. Принцип наименьшей энергии
- •2.4. Правило Хунда
- •2.5. Изображение электронного строения атома
- •Контрольные варианты
- •3. Периодическая система элементов д. И. Менделеева
- •Периодические свойства элементов
- •4. Химическая связь
- •4.1. Свойства ковалентной связи
- •4.2. Гибридизация атомных орбиталей
- •4.3. Полярные и неполярные молекулы
- •4.4. Металлическая связь
- •5.Энергетика химических процессов
- •6.Химическая кинетика.
- •7.Химическое равновесие.
- •Вопросы для самоконтроля по теме: «Закономерности протекания химических реакций»
- •Задачи по теме:
- •8.1. Способы выражения концентрации растворов
- •8.2. Примеры решения задач
- •8.2.1. Вычисления количеств компонентов раствора
- •322 Г Na2so4 × 10 h2o содержат - 142 г Na2so4
- •8.2.2. Вычисления при приготовлении разбавленных растворов из концентрированных
- •8.2.3. Вычисления при смешивании растворов
- •8.2.4. Пересчет концентрации из одной формы выражения в другую
- •8.2.5. Вычисления при химических реакциях
- •Контрольные вопросы и задачи
- •9.Свойства разбавленных растворов неэлектролитов
- •I закон Рауля:
- •II закон Рауля:
- •10. Растворы электролитов
- •11. Ионномолекулярные уравнения
- •12. Произведение растворимости
- •13. Ионное произведение воды. Водородный показатель.
- •14. Гидролиз солей
- •15. Дисперсные системы
- •16.1.Классификация дисперсных систем. Получение. Свойства и структура коллоидных систем
- •Методы получения дисперсных систем.
- •16. Химическая идентификация и анализ вещества
- •16.1. Химическая идентификация и анализ вещества
- •Вопросы и задачи для самоконтроля
- •16.2. Количественный анализ. Химические методы анализа
- •Вопросы и задачи для самоконтроля
- •16.3. Инструментальные методы анализа
- •Вопросы и задачи для самоконтроля
- •17. Окислительно-восстановительные реакции (овр)
- •Порядок нахождения степени окисления:
- •Ионно-электронный метод
- •18. Электрохимические процессы
- •18.1. Электродный потенциал
- •18.2. Гальванический элемент Даниэля – Якоби
- •18.3. Электродвижущая сила элемента (эдс)
- •18.4. Потенциалы металлических и газовых электродов
- •Ряд напряжений металлов:
- •19.Электролиз
- •Примеры
- •Электролиз с нерастворимым анодом водного раствора Na2so4:
- •20. Коррозия и защита металлов
- •20.1. Защита от коррозии. Металлические покрытия
- •21. Общие свойства металлов
- •21.1. Физические свойства металлов
- •21.2. Химические свойства металлов Отношение металлов к кислороду воздуха
- •Отношение металлов к воде
- •Это обусловлено наличием на поверхности алюминия очень плотного тонкого слоя химически инертной оксидной пленки, которая ни при каких условиях не взаимодействует с водой.
- •Отношение металлов к растворам кислот
- •А потенциал электродного процесса
- •Отношение некоторых металлов к кислотам
- •Отношение металлов к растворам щелочей
- •Электронные процессы
- •Отношение некоторых металлов к водным растворам щелочей
- •Отношение металлов к растворам солей
- •21.3. Природные соединения металлов
- •Контрольные вопросы
- •22.Жесткость и умягчение воды
- •Контрольные вопросы и задачи
- •23.Определение качественного состава природных вод
- •Общее содержание меди в земной коре сравнительно невелико, однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины.
- •Некоторые свойства меди и ее аналогов
- •25. Ощая характеристика металлов 2 группы побочной подгруппы. Цинк
- •Некоторые свойства элементов побочной подгруппы
- •Контрольные вопросы
- •26. Общая характеристика металлов побочной подгруппы VI группы. Хром.
- •Хром 5224 Сr
- •27. Общая характеристика металлов побочной подгруппы
- •VII группы.Марганец.
- •Марганец 55 25Мп
- •Соединения марганца
- •Вопросы и задачи:
- •28. Железо 56 26Fe.
- •Соединения железа
- •29. Общая характеристика р-металлов
- •111 Группы побочной подгруппы. Алюминий.
- •Контрольные вопросы.
- •30. Общая характеристика р-металлов 4 группы побочной подгруппы. Олово, свинец.
- •Контрольные вопросы
- •31.Комплексные соединения.
- •31.1.Основные положения координационной теории
- •31.2 Номенклатура комплексных соединений
- •31.3.Устойчивость комплексных соединений
- •Классификация неорганических соединений
- •Классификация неорганических соединений
- •32.1. Оксиды. Номенклатура, классификация оксидов
- •32.2. Получение оксидов и их свойства. Основные, кислотные и амфотерные оксиды
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.3. Гидроксиды (основания). Номенклатура, классификация гидроксидов
- •32.4. Свойства оснований
- •32.5. Понятие об амфотерных гидроксидах
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •Кислоты. Классификация, номенклатура кислот
- •32.7. Свойства кислот
- •Формулы и названия важнейших кислот и их солей
- •Контрольные вопросы
- •Упражнения для самостоятельной работы
- •32.8.Соли. Классификация солей
- •33. Органические полимерные материалы
- •33.1. Методы получения полимеров
- •2Nh2-(сн2)5-соон →
- •Вопросы для самоконтроля
- •33.2. Строение полимеров
- •Вопросы для самоконтроля
- •33.3. Свойства полимеров
- •Вопросы для самоконтроля
- •33.4. Применение полимеров
- •Вопросы для самоконтроля
20.1. Защита от коррозии. Металлические покрытия
Анодное покрытие – это металлы, стандартный потенциал которых меньше, чем у защищаемого металла.
Для Fe: Zn, Al.
При нарушении целостности покрытия на границе железо-цинк возникает и начинает работать гальванический элемент:
-2℮


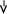
(-) Zn |H2O| Fe (+)
joZn2+/Zn = -0,763В joFe2+/Fe = -0,44В
(-) Анод: Zn0 – 2℮ ® Zn2+
(+) Катод: 2H2O + 2℮ ® H2 + 2OH- (на поверхности железа).
Вторичные процессы: Zn2+ + 2OH- = Zn(OH)2.
Железо само не разрушается. Анодное покрытие продолжает играть защитную роль по отношению к основному металлу, являясь протектором.
Катодное покрытие – это металлы, стандартный потенциал которых имеет более высокое значение, чем у защищаемого металла.
Для Fe: Sn,Pb,Cu.
При нарушении целостности покрытия на границе Sn – Fe возникает и начинает работать гальванический элемент
-2℮
(-) Fe |H2O| Sn (+)
joFe2+/Fe = -0,44В joSn2+/Sn = -0,13В
(-) Анод: Fe0 – 2℮ ® Fe2+
(+) Катод: 2H2O + 2℮ ® H2 + 2OH- (на поверхности олова).
Вторичные процессы: Fe2+ + 2OH- = Fe(OH)2
4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
Катодное покрытие выполняет защитную функцию до тех пор, пока целостность его не нарушена. При нарушении ее катодное покрытие ускоряет коррозию железа.
21. Общие свойства металлов
21.1. Физические свойства металлов
Все металлы (кроме ртути) при обычных условиях – твердые кристаллические вещества, обладающие характерными свойствами: высокой электро- и теплопроводностью, ковкостью, способностью хорошо отражать электромагнитные волны (блеск и непрозрачность). Эти типичные для металлов свойства обусловлены их электронным строением. В кристаллической решетке металла не все электроны связаны со своими атомами, некоторая их часть подвижна, потому они являются общими для всего кристалла. Электроны непрерывно перемещаются внутри кристаллической решетки, переходят от одного атома к другому, связывая их. Эти электроны, осуществляющие связь, получили название электронного газа, а сама связь – металлической. Металл можно представить себе в виде остова из положительных ионов, погруженного в электронный газ. Существование свободных электронов в металле и определяет его хорошие электрические и тепловые свойства. Лучшими проводниками теплоты и электричества являются серебро, медь, золото, алюминий.
Многие металлы обладают комплексом механических свойств, обеспечивающим их широкое применение в качестве конструкционных материалов. Это, в первую очередь, сочетание высокой пластичности со значительной прочностью и сопротивлением деформации, причем соотношение этих свойств может регулироваться в большом диапазоне с помощью механической и термической обработки металлов, а также получением сплавов различного состава.
Металлам присущи магнитные свойства. Так, переходные металлы с недостроенными f- и d- электронными облачками являются парамагнетиками. Некоторые из них при определенных температурах переходят в магнитоупорядоченное состояние.
В зависимости от плотности металлы условно делятся на две группы:
Легкие (плотность меньше 5 г/см3) и тяжелые (плотность больше 5 г/см3).
Самый легкий металл – литий (плотность равна 0,534 г/см3), самый тяжелый металл – осмий (22,5 г/см3).
Металлы, имеющие температуру плавления выше температуры плавления хрома (1890о С), считаются тугоплавкими. Самый тугоплавкий металл – вольфрам (3380оС).
В промышленности принято деление металлов на черные и цветные. К первым относят железо и его сплавы, а все остальные металлы – к цветным.
