
Лабы (механика) / Лабы / 1-14 / FIZ-1-~1
.DOC
Цель работы: изучение метода Клемана-Дезорма, позволяющего экспериментально определить
показатель адиабаты для воздуха .
Теоретическая часть работы.
Первое начало термодинамики. Уравнения газовых процессов.
Первый закон термодинамики - один из наиболее общих законов природы и отражает закон сохранения энергии для термодинамических процессов:
![]() или
или
![]() .
.
При рассмотрении термодинамических процессов используется понятие идеального газа - газа, молекулы которого не взаимодействуют друг с другом и их размеры пренебрежимо малы.
Реальные газы при нормальных (и близких
к ним) условиях описываются уравнением
состояния идеального газа:
![]() где R - универсальная
газовая постоянная,
где R - универсальная
газовая постоянная,
- молярная масса газа .
Внутренняя энергия U идеального газа определяется кинетической энергией движения его молекул.
Средняя энергия каждой молекулы:
![]() где К - постоянная Больцмана,
где К - постоянная Больцмана,
Т - абсолютная температура,
i - число степеней свободы.
Внутренняя энергия идеального газа
складывается из энергии всех его молекул:
![]()
Для одного моля газа:
![]()
Если количество газа не равно одному молю, то его внутренняя энергия равна:
![]() где N - число молекул газа,
N0 - число Авогадро.
где N - число молекул газа,
N0 - число Авогадро.
Теплоемкость.
Теплоемкость молярная и удельная.
Отношение теплоемкостей
![]()
Теплоемкость вещества - величина, численно равная количеству теплоты, необходимой для нагревания
его на один градус: ![]()
Теплоемкость единицы массы вещества - удельная теплоемкость, теплоемкость одного моля - молярная теплоемкость.
Связь между ними:
![]()
Теплоемкость при:
-
Изохорном процессе:
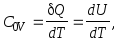 для одного моля:
для одного моля:

-
Изобарном процессе:
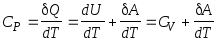 ;
поскольку
;
поскольку
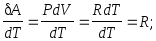 то
то
![]() ,
следовательно:
,
следовательно:
![]() .
.
![]() .
.
Отношение теплоемкостей
![]() входит в виде показателя степени
уравнении адиабаты (уравнение Пауссона):
входит в виде показателя степени
уравнении адиабаты (уравнение Пауссона):
![]()
C учетом вышеприведенных соотношений можно записать:
![]()
![]() .
.
Экспериментальная часть работы.
Описание экспериментальной установки.
-
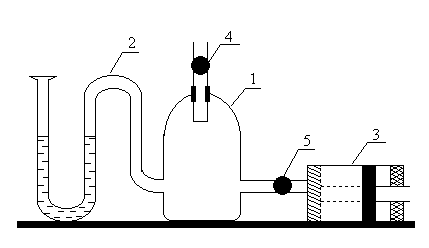
сосуд с воздухом -
манометр
-
насос
-
кран
-
кран
Вывод рабочих формул.
Запишем для адиабаты CD уравнение Пуассона:
![]() ,
или
,
или
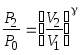 .
.
Точки
С и Е лежат на одной изотерме ( Т=Т0),
тогда можно записать:
![]() ,
или
,
или
![]() .
.
Получаем
: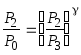 ,
логарифмируя это выражение, найдем
,
логарифмируя это выражение, найдем
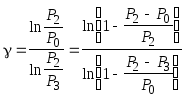 ,
ограничиваясь первым приближением
получим
,
ограничиваясь первым приближением
получим
![]() ,
преобразуем
,
преобразуем
![]() .
.
![]() разность
уровней манометра, соответствующая
точке С;
разность
уровней манометра, соответствующая
точке С;
![]() точке
Е, выраженные в миллиметрах водяного
столба.
точке
Е, выраженные в миллиметрах водяного
столба.
Расчеты основных величин.
Таблица №1.
|
№ опыта |
|
|
|
|
|
|
|
|
|
196 |
57 |
139 |
142 |
110 |
32 |
1,29 |
|
|
200 |
50 |
150 |
145 |
108 |
37 |
1,33 |
|
|
197 |
56 |
141 |
144 |
108 |
36 |
1,34 |
|
|
198 |
55 |
143 |
145 |
109 |
36 |
1,34 |
|
|
199 |
54 |
145 |
143 |
108 |
35 |
1,32 |
|
|
196 |
57 |
141 |
144 |
107 |
37 |
1,36 |
|
|
192 |
60 |
132 |
143 |
110 |
33 |
1,33 |
|
|
193 |
59 |
134 |
145 |
107 |
38 |
1,39 |
|
|
195 |
56 |
139 |
148 |
115 |
33 |
1,31 |
|
|
197 |
55 |
142 |
146 |
115 |
41 |
1,39 |
1.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
2. Пусть воздух - двухатомный газ (считаем связь между атомами жесткой), т.е. i=5, откуда
![]()
![]()
Расчет погрешностей.
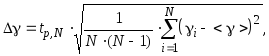
![]()
Количество повторений - 10.
Коэффициент
Стьюдента:
![]() при P=95%.
при P=95%.
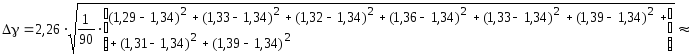 0,02
0,02
![]()
![]()
![]()
Вывод: в ходе работы был изучен метод Клемана-Дезорма, позволяющий экспериментальным путем определять показатель адиабаты воздуха. Полученный показатель адиабаты (эксп=1,38) незначительно отличается от теоретического (теор=1,4), т.к. в состав воздуха входят газы, молекулы которых состоят из различного количества атомов, а показатель теор был рассчитан для воздуха как для двухатомного газа. Другой причиной различия между полученным результатом и теоретическим является то, что при расчете теор воздух считали двухатомным идеальным газом, размерами молекул и их взаимодействиями мы пренебрегали. В реальной жизни воздух - смесь различных газов (O2, N2, CO2 и др.) и водяного пара.

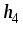 ,
мм
,
мм