
Лабы (механика) / Лабы / 1-14 / FIZ-1-~2
.DOC
Нижегородский государственный технический университет
Отчет по лабораторной работе №1-14.
Тема: “Изучение законов идеального газа и определение показателя адиабаты”.
Выполнил студент: Костерин Н.В.
Группа: 02-ЭС-2
г. Нижний Новгород
2003 почти г.
Цель работы: изучение метода Клемана-дезорма, позволяющего эксперементально определить показатель адиабаты для воздуха.
Теоретическая часть.
Первое начало термодинамики:
Q = U + A или A = dU + A
Идеальный газ – газ, молекулы которого не взаимодеиствуют друг сдругом и их размеры пренебрежимо малы.
Уравнение состояния идеального газа:
PV = RT m/, где
R – универсальная газовая постоянная;
– молярная масса данного газа.
Теплоемкость: C0 = Q/dT
Эксперементальная часть:

1 – сосуд;
2 – колена манометра;
3 – насос;
4,5 – краны.
Расчеты основных величин.
Таблица измерений:
|
№ опыта |
|
|
|
|
|
|
|
|
|
240 |
60 |
180 |
175 |
125 |
50 |
1,38 |
|
|
230 |
70 |
160 |
170 |
130 |
40 |
1,34 |
|
|
225 |
75 |
150 |
170 |
130 |
40 |
1,36 |
|
|
280 |
20 |
260 |
185 |
115 |
70 |
1,37 |
|
|
255 |
45 |
210 |
180 |
120 |
60 |
1,40 |
|
|
250 |
50 |
200 |
175 |
125 |
50 |
1,34 |
|
|
235 |
65 |
170 |
175 |
125 |
50 |
1,42 |
|
|
220 |
80 |
140 |
170 |
130 |
40 |
1,40 |
|
|
235 |
65 |
170 |
175 |
125 |
50 |
1,42 |
|
|
225 |
75 |
150 |
170 |
130 |
40 |
1,36 |
1.
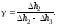
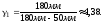
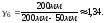

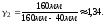
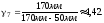
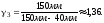
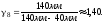
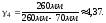
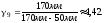
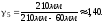
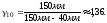
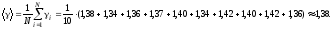
2. Пусть воздух - двухатомный газ (считаем связь между атомами жесткой), т.е. i=5, откуда
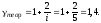
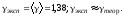
Расчет погрешностей.
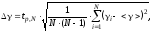

Количество повторений – 10.
Коэффициент
Стьюдента:
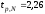 при
P=95%.
при
P=95%.
 0,02
0,02
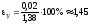
Результат
: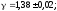
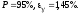
Вывод: в ходе работы был изучен метод Клемана-Дезорма, позволяющий экспериментальным путем определять показатель адиабаты воздуха. Полученный показатель адиабаты (эксп=1,38) незначительно отличается от теоретического (теор=1,4), т.к. в состав воздуха входят газы, молекулы которых состоят из различного количества атомов, а показатель теор был рассчитан для воздуха как для двухатомного газа. Другой причиной различия между полученным результатом и теоретическим является то, что при расчете теор воздух считали двухатомным идеальным газом, размерами молекул и их взаимодействиями мы пренебрегали. В реальной жизни воздух - смесь различных газов (O2, N2, CO2 и др. ) и водяного пара.
