
Готовые отчеты по лабораторным работам / Fiz-1-22a
.doc
Лабораторная работа по физике №1-22.
Изучение фазовых превращений первого рода на примере
нагревания и плавления олова.
Цель работы: изучение метода , позволяющего экспериментально определить изменение энтропии
и энергию связи атомов олова.
Теоретическая часть работы.
Равновесное состояние системы - состояние, при котором все параметр системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго.
Равновесный процесс - процесс перехода термодинамической системы из одного равновесного состояния в другое, настолько медленный, что все промежуточные состояния можно рассматривать как равновесные.
Обратимый процесс - процесс перехода термодинамической системы из одного состояния в другое, допускающий возвращение ее в первоначальное состояние через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимых в обратном порядке.
Всякий равновесный процесс является обратимым.
Качественной особенностью любого состояния термодинамической системы и любого термодинамического процесса является хаотичность движения частиц, составляющих систему. Хаотичность приводит к тому, что система стремится перейти в такое состояние, где больше беспорядок среди молекул. Увеличение молекулярного беспорядка - главная особенность любого самопроизвольно протекающего необратимого процесса.
Термодинамическая вероятность W - число микроскопических способов, которыми может быть осуществлено тепловое состояние макроскопической физической системы, стремящейся переходить в другие состояния. Термодинамическая вероятность является количественной характеристикой теплового состояния макроскопической физической системы.
Энтропия
системы:
![]() где к - постоянная Больцмана (1,38 ×
10-23
Дж/К).
где к - постоянная Больцмана (1,38 ×
10-23
Дж/К).
Т.к.
энтропия - величина аддитивная, то можно
записать
![]()
Количественная
формулировка второго закона термодинамики
-
при всех происходящих в замкнутой
системе необратимых процессах энтропия
этой системы возрастает;
максимальное возможное значение
энтропии замкнутой системы достигается
в тепловом равновесии, т.е.
![]() Идеальному обратимому процессу
соответствует постоянство энтропии
замкнутой системы -
Идеальному обратимому процессу
соответствует постоянство энтропии
замкнутой системы -
![]() .
.
Связь
между приращением энтропии dS
системы при бесконечно малом
обратимом сообщении ей теплоты dQ
:
![]() , где Т - температура системы.
, где Т - температура системы.
Разность
энтропии системы в 2-х произвольных
состояниях 1 и 2:
![]()
Фаза (в термодинамике) - равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний.
Фазовый переход - переход из одной фазы в другую. Фазовые переходы бывают двух родов:
1). Скачком изменяются термодинамические характеристики вещества : плотность, концентрация компонентов; в единице массы выделяется или поглощается определенное количество теплоты - теплоты фазового перехода. Примеры: плавление, кристаллизация, испарение, сублимация и т.д.
2). Непрерывный переход (т.е. состояние тела изменяется непрерывно), не сопровождается выделением или поглощением тепла.
Плавление - переход вещества из кристаллического (твердого) состояния в жидкое с поглощением тепла (фазовый переход первого рода) . Главные характеристики - температура плавления Тпл и теплота плавления Qпл . Плавление протекает при постоянной температуре, несмотря на приток теплоты. Плавление сопровождается изменением энтропии, ростом теплоемкости и электрического сопротивления; падает сопротивление сдвигу, уменьшается скорость распространения звука и т.д.
Координационное число - число ближайших к данному атому соседних атомов в кристаллической решетке. Для олова это число равно 12.
Вывод рабочих формул.
1). Количество теплоты, необходимое для плавления куска олова:
![]() - количество
теплоты, которое в среднем необходимо
затратить на один атом.
- количество
теплоты, которое в среднем необходимо
затратить на один атом.
Если масса одного атома Sn равна m0, то полное количество тепла для всего куска олова:
![]() где m - молярная масса
олова.
где m - молярная масса
олова.
2).
Удельная теплота плавления:
![]() откуда получаем
откуда получаем
![]()
3). Изменение энтропии олова на участке 1-3 ( 1-2 -разогрев олова, 2-3 -плавление олова):
![]() на участке (1-2)
на участке (1-2)
![]() а на участке (2-3)
а на участке (2-3)
![]()
Т.к. ,
![]() то
то
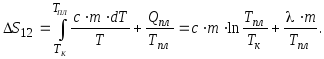
Полагаем, что для процесса разогрева и плавления выполнены условия обратимости.
Экспериментальная часть работы.
Таблица №1.
|
t, c |
T , oC |
t, c |
T , oC |
t, c |
T , oC |
|
0 |
20 |
1120 |
232 |
2200 |
229 |
|
60 |
23 |
1140 |
232 |
2220 |
228 |
|
120 |
28 |
1160 |
232 |
2240 |
227 |
|
180 |
34 |
1180 |
232 |
2260 |
225 |
|
240 |
50 |
1200 |
232 |
2280 |
224 |
|
300 |
60 |
1220 |
234 |
2300 |
224 |
|
360 |
80 |
1240 |
235 |
2320 |
223 |
|
420 |
97 |
1260 |
236 |
2340 |
221 |
|
480 |
115 |
1280 |
237 |
2360 |
220 |
|
540 |
134 |
1300 |
239 |
2380 |
219 |
|
600 |
151 |
1320 |
250 |
2400 |
218 |
|
660 |
170 |
1340 |
264 |
2420 |
217 |
|
720 |
187 |
1400 |
281 |
2440 |
215 |
|
750 |
189 |
1460 |
290 |
2460 |
213 |
|
780 |
194 |
1520 |
295 |
2480 |
211 |
|
810 |
199 |
1580 |
294 |
2500 |
209 |
|
840 |
207 |
1640 |
289 |
2530 |
207 |
|
860 |
208 |
1700 |
284 |
2560 |
202 |
|
880 |
210 |
1760 |
276 |
2620 |
195 |
|
900 |
214 |
1820 |
269 |
2680 |
188 |
|
920 |
216 |
1880 |
260 |
2740 |
184 |
|
940 |
218 |
1940 |
252 |
2800 |
174 |
|
960 |
220 |
2000 |
242 |
2860 |
156 |
|
980 |
221 |
2060 |
237 |
2920 |
150 |
|
1000 |
222 |
2080 |
235 |
2980 |
141 |
|
1020 |
224 |
2100 |
232 |
3040 |
136 |
|
1040 |
226 |
2120 |
232 |
3100 |
129 |
|
1060 |
227 |
2140 |
232 |
3160 |
123 |
|
1080 |
228 |
2160 |
232 |
3220 |
119 |
|
1100 |
229 |
2180 |
232 |
3280 |
114 |
Начало плавления - через 1120 с от начала отсчета (Т = 232 С),
Конец плавления - через 1220 с от начала отсчета
Начало кристаллизации - через 2110 с от начала отсчета (Т = 232 С),
Конец кристаллизации - через 2180 с от начала отсчета.
Время выключения нагревателя - 1400 с, Т = 281 К.
Комнатная температура ТК = 20 С ( 293 К).
Расчеты.
1. TПЛ = ТКР = 232 0С = 505 К
С=230 Дж/К * кг
l = 58600 Дж/кг
m = 0,047 кг.
ТК = 293К
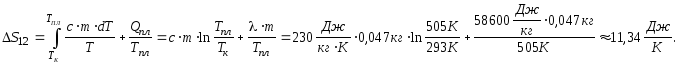
2.Пусть e0 -энергия связи атомов Sn, E- средняя кинетическая энергия теплового движения атомов Sn:
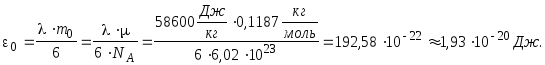
![]() - при комнатной температуре;
- при комнатной температуре;
![]() - при температуре плавления Sn.
- при температуре плавления Sn.
Т.е.
![]() и
и
![]() .
.
Вывод: в ходе работы изучили метод, позволяющий экспериментально определить изменение энтропии
и энергию связи атомов олова. Процесс охлаждения олова является более равновесным, чем процесс нагревания и плавления олова, т.к. охлаждение - более длительный по времени процесс, а, по определению, равновесный процесс - бесконечно долгий процесс. Это видно по графику зависимости температуры от времени: участок кривой, соответствующий охлаждению олова, более пологий по отношению к участку кривой, соответствующему нагреванию олова.
Была выяснена зависимость средней кинетической энергии теплового движения атомов Sn от температуры. При нормальной температуре она много меньше энергии связи атомов, поэтому атомы олова совершают колебания с относительно небольшой амплитудой; при температуре плавления увеличивается средняя амплитуда колебаний атомов, происходит интенсивный разрыв связей с последующим воссоединением их в другой комбинации, т.е. олово плавится и превращается в жидкость. При охлаждении и кристаллизации олова процесс происходит в обратном порядке, только более продолжительно по времени, т.к. охлаждение происходит без внешнего воздействия.
