
- •1.Основные параметры состояния рабочего вещества.
- •4. Уравнение состояния реального газа.
- •6.Газовые смеси. Закон Дальтона для газовых смесей.
- •7.Метод задания газовых смесей
- •9.Первый закон термодинамики.Энтальпия.
- •10.Второй закон термодинамики.Энтрапия.
- •11. Энтальпия, как параметр состояния.
- •12. Циклы и устройства для превращения теплоты в работу.
- •13. Какие процессы называются равновесными.
- •17.Цикл Карно.Термический кпд цикла Карно.
- •18. Математическое выражение второго начала классической термодинамики:
- •20. Формула термического кпд.
- •24. Адиабатный процесс, изобарный процесс.
- •30. Диаграмма t-s для водяного пара.
- •31. Диаграмма h. S для водяного пара.
- •32. Физический смысл теплоты фазового перехода.
- •33. Процессы течения газов и жидкостей.
- •34. Уравнение неразрывности.
- •36. Показатель для оценки эффективности теплового двигателя.
- •38. Цикл двс с подводом теплоты при постоянном объеме.
- •39. Схема гту с подводом теплоты при постоянном давлении.
- •40. Цикл Карно для парового двигателя.
- •42. Термический кпд цикла паросиловой установки.
- •43. Регенеративный цикл паросиловой установки.
- •44. Показатель оценки эффективности теплового двигателя.
- •45. Влажный воздух.
- •46. Основные параметры характеризующие влажность воздуха.
- •47. Диаграмма h-d для влажного воздуха.
- •48. Принцип работы теплового насоса.
- •49. Основные определения и понятия, стационарная теплопроводность плоских и цилиндрических стенок.
- •50. Перенос теплоты.
- •52. Физический смысл коэффициента теплопроводности.
- •53. Характер изменения температуры в однородной стенке.
- •54. Характер изменения температуры в многослойной цилиндрической стенке
- •55. Характер изменения температуры в однородной цилиндрической стенке.
- •57. Основные положения теории подобия.
- •58. Условия подобия физических процессов.
- •59. Конвективный теплообмен.
- •62. Свободное движение воздуха вдоль нагретой вертикальной стенки
- •63. Теплоотдача в ограниченном пространстве
- •65. Особенности теплоотдачи при поперечном омывании пучка труб.
- •67. Основные законы теплового излучения.
6.Газовые смеси. Закон Дальтона для газовых смесей.
Для газовых смесей справедливы следующие положения.
1. Каждый газ, входящий в смесь, имеет температуру, равную температуре смеси.
2. Любой из газов, входящих в смесь, распространяется по всему объему смеси и поэтому объем каждого газа равен объему всей смеси.
3. Каждый из газов, входящих в смесь, подчиняется своему уравнению состояния.
4. Смесь в целом является как бы новым газом и подчиняется своему уравнению состояния.
В основе изучения газовых смесей лежит закон Дальтона, согласно которому при постоянной температуре давление смеси равно сумме парциальных давлений газов, входящих в смесь:
 где pсм
- давление смеси;
где pсм
- давление смеси;
pi - парциальное давление i-го газа, входящего в смесь;
n - число газов, входящих в смесь.
Парциальным
называют давление, которое окажет газ,
входящий в смесь, если он один будет
занимать весь объем смеси при той же
температуре. Массовые доли. Массовой
долей любого газа, входящего в смесь,
называется отношение массы этого газа
к массе смеси. и
и
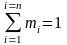 (100%).
(100%).
Объемные доли. Объемной долей любого газа, входящего в смесь, называется отношение приведенного (парциального) объема этого газа к объему смеси. Приведенный объем - это объем газа при условиях смеси (при температуре и давлении смеси). Мольные доли. Мольной долей любого газа, входящего в смесь, называется отношение числа киломолей этого газа к числу киломолей смеси. Задание смеси мольными долями тождественно заданию смеси объемными долями, т.е. мольные и объемные доли имеют для каждого газа, входящего в смесь, одинаковые численные значения.
7.Метод задания газовых смесей
Газовая
смесь определяется составом и количеством
каждого из компонентов газа, входящего
в смесь, и может быть задана массовыми
или объемными долями. Массовая доля
mi определяется
отношением массы i-того компонента газа
к массе всего газа mi=Mi/M
где Мi – масса i-того компонента, кг; М –
масса всей смеси, кг. Объемная доля ri –
это отношение объема i-того компонента,
входящего в смесь, к объему всей смеси
при условии, что объем каждого компонента
отнесен к давлению и температуре смеси
(приведенный объем) ri=Vi/V где Vi – приведенный
объем i-того компонента смеси газа, м3;
V – общий объем газовой смеси, м3. Плотность
смеси ρсм, кг/м3, определяется через
объемные или массовые доли
![]()
![]() Газовую постоянную данной смеси Rсм,
Дж/(кг·К), можно выразить через газовые
постоянные отдельных ее компонентов
Газовую постоянную данной смеси Rсм,
Дж/(кг·К), можно выразить через газовые
постоянные отдельных ее компонентов![]() Давление газовой смеси рсм, Па, по закону
Дальтона равно сумме парциальных
давлений отдельных компонентов смеси
Давление газовой смеси рсм, Па, по закону
Дальтона равно сумме парциальных
давлений отдельных компонентов смеси
![]() где
рсм – давление газовой смеси, Па; рi –
парциальное давление (при объеме газовой
смеси) от-дельного компонента, Па.
где
рсм – давление газовой смеси, Па; рi –
парциальное давление (при объеме газовой
смеси) от-дельного компонента, Па.
8.
Физический смысл теплоемкости.
Теплоемкость
тела —
это физическая величина, определяемая
отношением количества теплоты, поглощенной
телом при нагревании, к изменению его
температуры: ![]()
Физический
смысл теплоемкости тела: теплоемкость
тела равна количеству теплоты, поглощенному
телом при нагревании или выделенному
при его охлаждении на 1К. Теплоемкость
тела —
это произведение удельной теплоемкости
вещества, из которого оно изготовлено,
и массы этого тела: C = cт. Удельная
теплоемкость — это способность разных
веществ к поглощению теплоты при их
нагревании.
Удельная теплоемкость
вещества определяется отношением
количества теплоты, полученной им при
нагревании, к массе вещества и изменению
его температуры, если ![]() :
:![]()
Молярная
теплоемкость —
это физическая величина, равная отношению
количества теплоты, поглощенного
веществом при нагревании или выделенного
при охлаждении, к количеству мо- лей нем
и изменению температуры: ![]()
Физический
смысл молярной теплоемкости: молярная
теплоемкость вещества, определяемая
количеством теплоты, которое поглощается
при нагревании или выделяется при
охлаждении 1 моля вещества на 1
К.
Следовательно, молярную теплоемкость
можно определить другим способом: ![]()
что
говорит о том, что молярная теплоемкость
не зависит от его химического состава
и температуры. Уравнение
Роберта Майера:
молярная теплоемкость идеально- го газа
при постоянном давлении равна сумме
молярной теплоемкости этого газа при
постоянном объеме и молярной газовой
постоянной: ![]()
