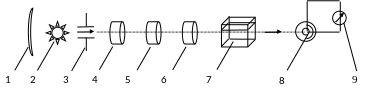Устройство фотоэлектроколориметра
Фотоэлектроколориметр необходимо включить в сеть за 10 – 15 мин до выполнения измерений.
Общий принцип работы. Световой поток от источника 2, отражаемый рефлектором 1, проходит через диафрагму 3 и попадает на систему светофильтров (рисунок 2). Теплозащитный светофильтр 4 поглощает инфракрасные (тепловые) лучи, нейтральный светофильтр 5 поглощает ультрафиолетовое излучение. Цветной светофильтр 6 преобразует полихроматический свет в монохроматический и выделяет узкий участок спектра с определенной длиной волны. Монохроматический свет попадает в кювету 7 с раствором, при этом часть света поглощается. Прошедший через раствор свет поступает на фотоэлемент 8, где энергия света преобразуется в электрическую. Аналитический сигнал измеряют микроамперметром 9.
Отклонение стрелки микроамперметра пропорционально интенсивности прошедшего через анализируемый раствор света.
|
Рисунок 2. Схема фотоэлектроколориметра КФК-2ПМ: 1 – рефлектор, 2 – источник света, 3 – диафрагма, 4, 5 и 6 – теплозащитный, нейтральный и цветной светофильтры, 7 – кювета с анализируемым раствором, 8 – фотоэлемент, 9 – микроамперметр. |
В ячейке кюветодержателей не должны проливаться растворы из кювет. После окончания работы кюветы следует вымыть, прибор выключить, ячейки кюветодержателей протереть насухо.
По нижней шкале прибора измеряют оптическую плотность (А = 0 – 2), по верхней – светопропускание раствора (Т = 0 - 100 %).
Потенциометрия (л.Р. №3 и №2, опыт 2) Основы метода
Потенциометрический метод основан на измерении электродвижущих сил обратимых гальванических элементов и применяется для определения концентрации ионов в растворе. Зависимость потенциала электрода от активности ионов описывается уравнением Нернста, которое применяют в следующей форме:
 , (9)
, (9)
где Е0 – стандартный электродный потенциал, В; 0,059 – константа, включающая универсальную газовую постоянную (R), абсолютную температуру и постоянную Фарадея (F); n – число электронов, принимающих участие в электродной реакции; а(Ох) и a(Red) - активность окисленной и восстановленной форм вещества соответственно.
Для измерения электродвижущей силы применяют систему двух электродов – индикаторного и электрода сравнения.
|
Рисунок 6. Классификация индикаторных электродов |
В соответствии с механизмом возникновения или изменения потенциала электроды классифицируются на металлические, электроды II рода и ионоселективные (мембранные) электроды (рисунок 6). Металлические электроды делятся на активные I рода и индифферентные.
Активные металлические электроды I рода – это металлическая пластинка или проволока, погруженная в раствор хорошо растворимой соли данного металла. Например, серебряная проволока, погруженная в раствор нитрата серебра. На поверхности электрода возникает двойной электрический слой, и устанавливается равновесный потенциал Е, который зависит от активности ионов Ag+ в растворе:
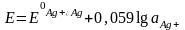 . (10)
. (10)
Металлические индифферентные электроды не участвуют в электрохимической реакции, а только обеспечивают перенос электронов для окислительно–восстановительной реакции, протекающей в растворе. Такие электроды представляют собой проволоку, пластину или сетку, изготовленную из инертных металлов (платина, золото, палладий), а также графит, погруженные в раствор, содержащий сопряженную редокс-пару. Потенциал такого электрода зависит от активности окисленной и восстановленной форм данной редокс-пары. Например, редокс – потенциал платинового электрода, погруженного в раствор, содержащий Ре+3 и Fe+2:
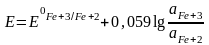 . (10)
. (10)
|
Рисунок 7. Хлоридсеребряный электрод: 1 – серебряная проволока, 2 – AgCl, 3 – насыщенный раствор КС1, 4 – дренаж (асбестовое волокно). |
К электродам II рода относится хлоридсеребряный электрод. Он представляет собой серебряную проволоку, покрытую труднорастворимой солью AgCl и погруженную в насыщенный раствор хорошо растворимой соли с одноименным анионом – КСl (рисунок 7).
Потенциал электрода зависит от активности (концентрации) хлорид-ионов в растворе:
 , (12)
, (12)
где
КS0(AgCl)
– произведение растворимости хлорида
серебра,
 .
.
Потенциал электрода при измерениях остается постоянным и не зависит от состава анализируемого раствора, т. к. внутренний раствор КСl насыщен, и концентрация Сl- не изменяется. Если внутренний раствор КСl ненасыщен, электрод применяется как индикаторный для определения концентрации Сl.
Ионоселективные электроды (ИСЭ) – сенсоры (чувствительные элементы, датчики), потенциал которых линейно зависит от lgа определяемого иона в растворе. Важнейшей составной частью ИСЭ является полупроницаемая мембрана, способная пропускать только определенные ионы. Мембраны изготавливаются из специальных сортов стекла, монокристаллов, органических полимеров, пленок ферментов, жидких ионообменников. На границе мембрана – раствор устанавливается равновесие обмена ионами и возникает разность потенциалов. Потенциал ИСЭ зависит от активности определяемого иона в анализируемом растворе a1 и во внутреннем растворе электрода a2:
 . (13)
. (13)
|
Рисунок 8 – Стеклянный электрод: 1 – мембрана; 2 – стандартный раствор HCl; 3 – хлоридсеребряный электрод. |
Высокое содержание Na+ в мембране способствует обмену ионами Na+ мембраны и H+ из раствора; на поверхности электрода устанавливается равновесие. Потенциал стеклянного электрода зависит от активности (концентрации) ионов Н+ в растворе:
 , (14)
, (14)
где К константа, зависящая от сорта стекла и устройства электрода.
Преимущества рН-стеклянного электрода: электрохимическое равновесие устанавливается мгновенно, не адсорбирует поверхностно-активные вещества, применим в широком диапазоне рН, отсутствует влияние окислителей и восстановителей на работу электрода. Недостатки электрода: не рекомендуется применение при рН > 10 (нарушаются функции электрода), в присутствии плавиковой кислоты (стекло растворяется), кроме того, такой электрод весьма хрупок, что создает известные затруднения при его использовании.
С другим составом стекла электроды селективны на другие ионы. Например, в аналитической практике применяются pNa–, рК–, pLi–, рАg–, рСа–, pMg–, pBa–, pNH4–, pNO3–, pCl– стеклянные электроды.
По способу выполнения и расчета результатов анализа различают прямую потенциометрию (ионометрия) и косвенную (потенциометрическое титрование).
Прямая потенциометрия основана на непосредственном применении уравнения Нернста для определения активности или концентрации ионов по экспериментально измеренному потенциалу электрода.
Концентрацию определяемых ионов находят одним из методов количественного анализа:
метод градуировки электрода по растворам с точно известной концентрацией определяемых ионов (буферные растворы);
метод градуировочного графика Е = f(pC); график строят при постоянной ионной силе раствора в присутствии индифферентных электролитов;
метод добавок (анализ сложных по составу или сильноразбавленных растворов).
В ионометрии в качестве индикаторных применяют, как правило, мембранные ионоселективные электроды, потенциал которых зависит от концентрации определенного вида ионов. Электродами сравнения служат насыщенные электроды II рода.
Потенциометрическое титрование относится к косвенным методам анализа, основано на установлении точки эквивалентности по резкому изменению потенциала индикаторного электрода при титровании. Титрант добавляют точно известными порциями и записывают показания прибора (Е). По результатам титрования строят интегральную и (или) дифференциальную кривые титрования (рисунок 9). По графикам находят точку эквивалентности и выполняют расчет.
|
Рисунок 9. Интегральная (а) и дифференциальная (б) кривые титрования смеси двух веществ |
Выбор индикаторных электродов зависит от природы определяемых ионов и типа химической реакции. В методе косвенной потенциометрии применяют реакции кислотно-основного и окислительно-восстановительного взаимодействия, комплексообразования и осаждения. В таблице 2 приведены некоторые варианты выбора электродов при потенциометрическом титровании. В качестве электродов сравнения, как правило, применяют насыщенные электроды II рода.
Таблица 2. Варианты потенциометрического титрования
Тип реакции |
Измеряемая величина |
Электроды |
Определяемые вещества |
||
Индикаторный |
Сравнения |
||||
Протоли-тометрия |
рН |
рН-стеклянный, хингидронный |
Насыщенные электроды II рода (хлорид-серебряный, каломельный)
|
Кислоты, основания, соли |
|
Редокси-метрия |
Е |
Индифферентные I рода (платиновый) |
Окислители, восстановители |
||
Комплек-сонометрия |
рМе |
Ме-селективные |
Men+; n > 1 |
||
Осаждение |
pAg, pCl, pI, pBr |
Ионоселективные, ненасыщенные II рода, серебряный |
Ионы, образующие осадки |
||