
- •Оглавление
- •Введение
- •Краткие указания к практическим занятиям Правила работы в лаборатории органической химии
- •Первая помощь при несчастных случаях в лаборатории
- •I. Методы выделения и очистки органических веществ
- •Опыт № 1. Перекристаллизация бензойной кислоты
- •Опыт №2. Возгонка (сублимация) бензойной кислоты
- •Опыт №4. Определение температуры плавления бензойной кислоты
- •Опыт №5. Разделение смеси веществ простой перегонкой
- •II. Качественный элементный анализ органических соединений
- •Опыт № 8. Обнаружение углерода и водорода
- •Опыт № 9. Обнаружение азота
- •Опыт № 10. Обнаружение галогенов (проба Бейльштейна)
- •Опыт № 11. Обнаружение серы
- •Опыт № 13. Получение и свойства этилена
- •Опыт №14. Получение и свойства бензола
- •IV. Галогенопроизводные углеводородов (галогеноуглеводороды)
- •Опыт № 15. Получение хлорэтана
- •V. Спирты. Простые эфиры
- •Опыт № 16. Обнаружение воды в спирте-ректификате
- •Опыт № 18. Окисление этилового спирта перманганатом калия
- •Опыт № 19. Получение простого (диэтилового) эфира
- •Опыт № 20. Получение сложного (уксусноэтилового) эфира
- •VI. Фенолы. Нафтолы
- •Опыт № 21. Получение фенолята натрия
- •Опыт № 24. Взаимодействие α- и β-нафтолов с хлоридом железа (III)
- •VII. Альдегиды и кетоны
- •Опыт № 25. Получение уксусного альдегида из этанола
- •Опыт № 26. Окисление альдегида. Образование серебряного зеркала
- •Опыт № 27. Реакция диспропорционирования формальдегида (реакция Канницаро)
- •Опыт № 28. Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •Опыт № 29. Цветные реакции на альдегиды
- •Опыт № 30. Образование альдегидами и кетонами гидросульфитных производных
- •Опыт № 31. Йодоформная проба на ацетон
- •Опыт № 32. Окисление бензойного альдегида кислородом воздуха
- •VIII. Карбоновые кислоты и их производные
- •Опыт № 33. Получение уксусной кислоты из ацетата натрия
- •Опыт № 34. Получение и гидролиз ацетата железа (III)
- •Опыт № 35. Устойчивость уксусной кислоты к действию окислителей
- •Опыт № 36. Окисление муравьиной кислоты
- •Опыт № 37. Разложение муравьиной кислоты
- •Опыт № 38. Окисление олеиновой кислоты перманганатом калия (реакция Вагнера)
- •Опыт № 39. Разложение щавелевой кислоты при нагревании
- •Опыт № 40. Окисление щавелевой кислоты
- •IX. Гидроксикислоты
- •Опыт № 42. Разложение молочной кислоты при нагревании с концентрированной серной кислотой
- •Опыт № 43. Разложение молочной кислоты при нагревании с разбавленной серной кислотой
- •Опыт № 44. Окисление молочной кислоты в пировиноградную кислоту
- •Опыт № 45. Получение реактива Фелинга
- •Опыт № 46. Разложение лимонной кислоты при нагревании
- •Опыт № 47. Получение ацетилсалициловой кислоты (аспирин)
- •Опыт № 48. Доказательство отсутствия фенольного гидроксила в ацетилсалициловой кислоте (аспирине) и её гидролиз
- •Опыт № 49. Термическое декарбоксилирование салициловой кислоты
- •Опыт № 50. Взаимодействие салициловой и бензойной кислот с хлоридом железа (III)
- •Опыт № 52. Доказательство наличия гидроксильных групп в винной кислоте
- •Опыт № 53. Взаимодействие галловой кислоты и танина с хлоридом железа (III)
- •Опыт № 54. Обнаружение кислотных свойств ацетоуксусного эфира
- •Опыт № 55. Кетонное расщепление ацетоуксусного эфира
- •X. Углеводы
- •Опыт № 56. Реакция на обнаружение углеводов с -нафтолом (реакция Молиша)
- •Опыт № 57. Доказательство наличия гидроксильных групп в глюкозе
- •Опыт № 58. Восстановление гидроксида меди (II) глюкозой в присутствии щелочи (реакция Троммера)
- •Глюкоза глюконовая кислота
- •Опыт № 59. Взаимодействие глюкозы с реактивом Фелинга
- •Опыт № 60. Восстановление аммиачного раствора оксида серебра (реакция серебряного зеркала)
- •Опыт № 61. Реакция Селиванова на кетогексозы
- •Опыт № 62. Взаимодействие глюкозы со щелочным раствором глицерата меди (реактив Гайнеса)
- •Опыт № 63. Реакция фуксинсернистой кислоты с глюкозой и формальдегидом
- •Опыт № 64. Образование фурфурола и конденсация его с анилином (качественная реакция на пентозаны)
- •Опыт № 65. Доказательство наличия гидроксильных групп у сахарозы
- •Опыт № 66. Восстанавливающая способность дисахаридов
- •Опыт № 67. Инверсия сахарозы при гидролизе
- •Опыт № 68. Приготовление крахмального клейстера
- •Опыт № 69. Реакция крахмала с йодом
- •Опыт № 70. Отсутствие восстанавливающей способности у крахмала
- •XI. Азотсодержащие органические соединения
- •Нитросоединения
- •Опыт № 71. Получение нитрометана
- •Опыт № 72. Разложение мочевины при гидролизе
- •Опыт № 73. Взаимодействие мочевины с азотной кислотой
- •Опыт № 74. Взаимодействие мочевины с азотистой кислотой
- •Опыт № 75. Взаимодействие мочевины со щавелевой кислотой
- •Опыт № 76. Образование биурета
- •Опыт № 77. Определение кислотности аминоэтановой кислоты (глицина)
- •Опыт № 78. Получение медной соли глицина
- •Опыт № 79. Реакции аминокислот с нингидрином
- •Опыт № 80. Реакции аминокислот с формальдегидом
- •Опыт № 81. Реакции аминокислот с азотистой кислотой (дезаминирование)
- •Опыт № 82. Реакция глицина с хлоридом железа (III)
- •Заказ №
Опыт № 24. Взаимодействие α- и β-нафтолов с хлоридом железа (III)
Реактивы:
-нафтол
β-нафтол
Этанол
Раствор хлорида железа (III)
Ход работы:
В одну пробирку помещают 0,5 г (0,0035 моль) -нафтола, а в другую 0,5 г (0,0035 моль) β-нафтола. В обе пробирки приливают по 1 мл (0,0017 моль) этанола и 1 мл (0,056 моль) воды. К полученным растворам добавляют по 2 капли раствора хлорида железа (III). -нафтол даёт фиолетовое окрашивание, а β-нафтол – зеленое, что обусловлено разным положением ОН-группы в нафталиновом кольце.
VII. Альдегиды и кетоны
Альдегиды
и кетоны –
производные углеводородов, содержащие
карбонильную группу
![]() ,
поэтому оба класса этих родственных
веществ относятся к карбонильным
соединениям.
,
поэтому оба класса этих родственных
веществ относятся к карбонильным
соединениям.


альдегиды кетоны
Альдегидами называют соединения, в которых карбонильная группа соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами. По систематической номенклатуре называются от соответствующего алкана с добавлением суффикса –аль для альдегидов или –он для кетонов с указанием в последних положения карбонильной группы цифрой:
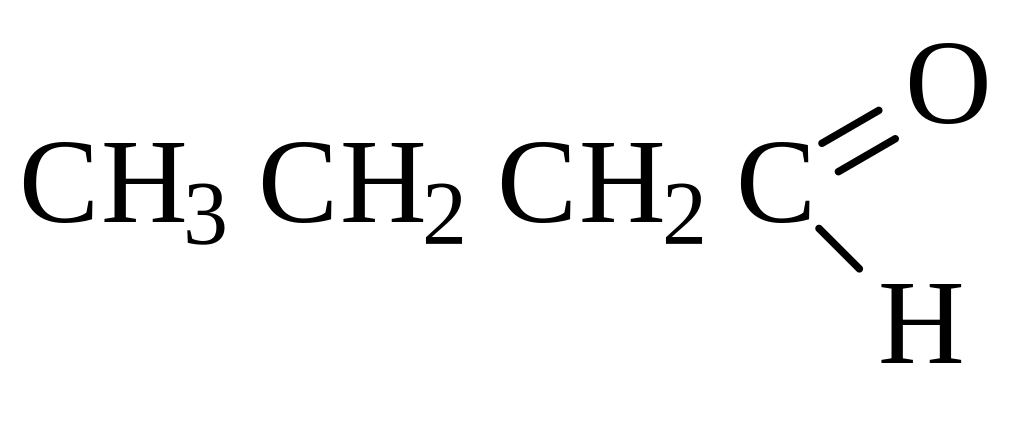
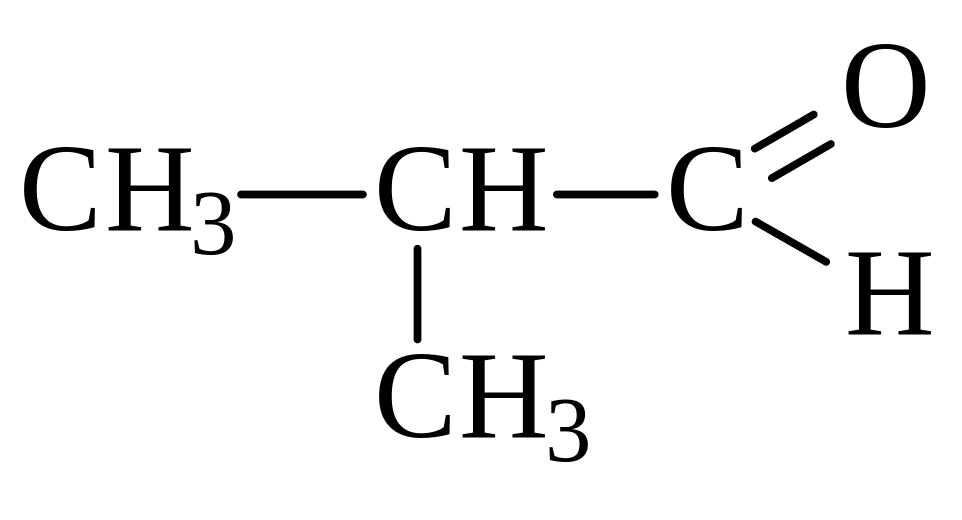
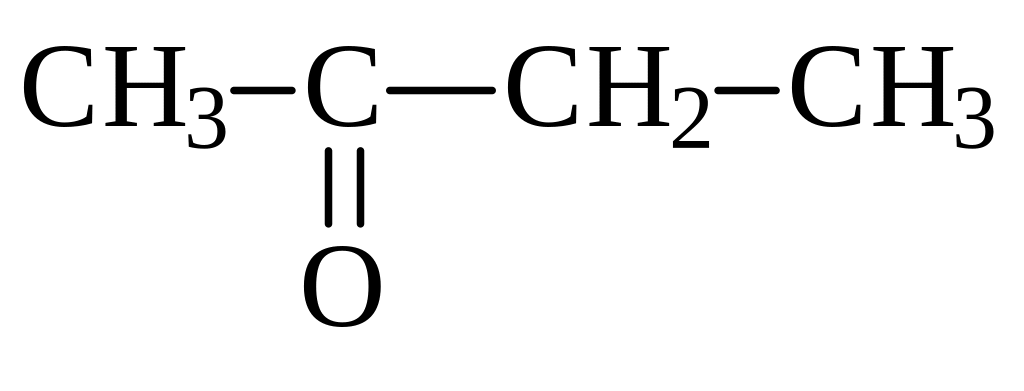
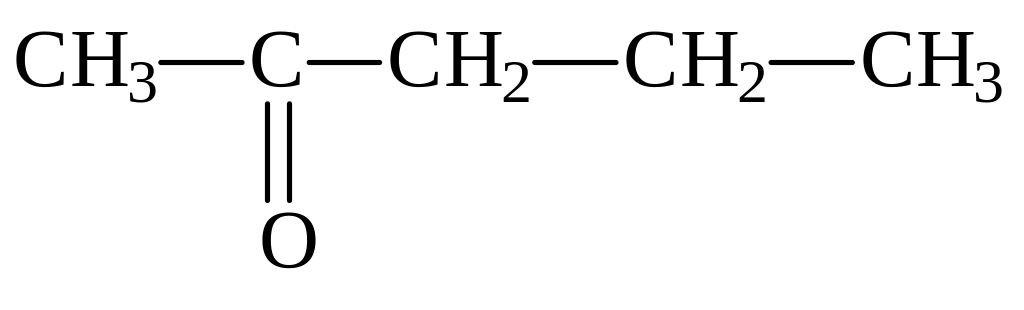
бутаналь 2-метилпропаналь бутанон пентанон-2
У альдегидов положение -CHO группы цифрой не указывается, т.к. она находится всегда в начале молекулы, и нумерация углеродной цепи ведётся с её атома углерода.
Альдегиды являются продуктами окисления первичных спиртов; кетоны – вторичных.
Кетоны менее реакционноспособны, чем альдегиды. Для альдегидов и кетонов характерны реакции нуклеофильного присоединения по карбонильной группе (с разрывом связи С=О). Продукты присоединения в ряде случаев могут отщеплять воду и результат реакции выглядит как замещение.
Альдегиды очень легко окисляются до соответствующих кислот. Кетоны окисляются очень трудно, с разрывом углерод-углеродной связи.
Опыт № 25. Получение уксусного альдегида из этанола
Реактивы:
Хромовая смесь (K2Cr2O7 H2SO4)
Этанол
Фуксинсернистая кислота
Ход работы:
В сухую пробирку наливают 2 мл хромовой смеси, помещают кипятильный камешек и добавляют 2 мл (0,0034 моль) этанола. Пробирку закрывают газоотводной трубкой, свободный конец трубки помещают в другую пробирку с бесцветной фуксинсернистой кислотой. Пробирку со смесью зажимают держателем и осторожно нагревают. Хромовая смесь изменяет свою окраску и из оранжево-красной становится зеленой. Спирт за счет кислорода хромовой смеси окисляется в альдегид, а альдегид вместе с парами воды уходит через газоотводную трубку в пробирку, в которой находится фуксинсернистая кислота, окрашивая её в малиновый цвет.
Эта реакция (с реактивом Моллера) используется в спиртовом производстве для количественного определения альдегидов при контроле качества получаемого этилового спирта.
Окисление спирта происходит по следующей схеме:
3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 3CH3-CHO + Cr2(SO4)3 + K2SO4 + 7H2O
Опыт № 26. Окисление альдегида. Образование серебряного зеркала
Реактивы:
Формальдегид (40% водный раствор)
10% раствор гидроксида натрия
Аммиачный раствор гидроксида серебра (реактив Толленса)
Ход работы:
В чистую пробирку наливают 4 мл 10% раствора гидроксида натрия и осторожно нагревают на пламени горелки до кипения. Затем содержимое выливают, пробирку охлаждают и несколько раз ополаскивают водой. В подготовленную таким образом пробирку наливают 2 мл формалина (раствор, содержащий 40 % формальдегида, 8 % метилового спирта и 52 % воды), 2 мл свежеприготовленного аммиачного раствора оксида серебра, и смесь слегка встряхивают. Затем содержимое очень осторожно нагревают, вращая пробирку так, чтобы жидкость распределялась по стенкам. Через 1 минуту стенки пробирки покрываются блестящим слоем выделившегося металлического серебра, образуется серебряное зеркало. Формальдегид окисляется в муравьиную кислоту, а серебро восстанавливается (окислительно-восстановительная реакция):
H-COH + 2Ag(NH3)2OH H-COOH + 2Ag + 4NH3 + H2O
