
Факторы
- Чем больше количества компонентов кислотно-основной пары: основание/сопряженная кислота в растворе, тем выше буферная емкость этого раствора.
- Буферная емкость зависит от соотношения концентраций компонентов буферного раствора. Чем ближе это соотношение к единице, тем выше буферная емкость. Следовательно, буферная емкость зависит от рН раствора.
2. Броуновское движение проявляется хаотическим непрерывным движением частиц дисперсной фазы под действием ударов молекул растворителя (дисперсионной среды), находящихся в состоянии интенсивного молекулярно-теплового движения. Перемещаться частицы могут в различных направлениях. Траектория их движения представляет собой ломаную линию неопределенной конфигурации.
Диффузия – это самопроизвольно протекающий процесс выравнивания концентраций ионов, молекул или коллоидных частиц вследствие их беспорядочного теплового (для истинных растворов) или броуновского (для дисперсных систем) движения. Диффузия заканчивается с достижением равномерного распределения частиц по всему объему. Следовательно, диффузия возможна лишь в системах с неодинаковыми концентрациями.
Осмотическое
давление – одно
из коллигативных свойств растворов,
т.е. зависит только от количества свободно
движущихся частиц. Следовательно, оно
характерно, как для коллоидных растворов,
так и для истинных, и для расчета величины
осмотического давления коллоидных
растворов также можно применить уравнение
Вант-Гоффа:
Росм. = 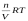 ,
где Росм. –
осмотическое давление золя, Па; n –
количество частиц, моль; V–
объем золя, м3; R–
газовая постоянная; Т–
температура, К.
,
где Росм. –
осмотическое давление золя, Па; n –
количество частиц, моль; V–
объем золя, м3; R–
газовая постоянная; Т–
температура, К.
БИЛЕТ №6
Буферные системы крови. Механизм действия. Значение
буферных систем для фармации и медицины.
Методы определения размеров коллоидных частиц.
Седиментационный анализ.
Бикарбонатная буферная система – одна из важнейших буферных систем крови. Бикарбонатный буфер поддерживает постоянным кислотно-щелочное равновесие.
Фосфатная буферная система – содержится в плазме крови, моче, спинно-мозговой жидкости, тканевой жидкости.
Оксигемоглобиновая и гемоглобиновая буферные системы – содержатся в эритроцитах. Системы выводят из организма избыток угольной кислоты, поддерживая кислотно-щелочное равновесие.
Белковая буферная система – белки способны проявлять свойства, как слабой кислоты, так и слабого основания, поэтому они связывают избыток ионов Н и ОН.
Механизм действия
Рассмотрим на примере ацетатного буфера СН3СООН/СН3СООNa. В ацетатном буферном растворе осуществляются реакция кислотной ионизации и реакция гидролиза. Концентрация ионов Н3О и ОН постоянны. При увеличении концентрации ионов ОН ионное равновесие реакции смещается влево и концентрация ОН снижается до прежней величины за счет взаимодействия с неионизированными молекулами кислоты, концентрация которых снижается. При введении в раствор небольшого количества сильной кислоты в растворе увеличивается концентрация ионов Н3О. Равновесие смещается влево до восстановления первоначальной концентрации ионов Н3О. Соотношение кислота/соль будет изменяться очень незначительно и рН буферного раствора будет постоянным. 2. СЕДИМЕНТАЦИОННЫЙ АНАЛИЗ — совокупность методов дисперсионного анализа, в основе которых лежит зависимость между размером и скоростью движения тела в вязкой среде (газе или жидкости) под действием гравитационных или центробежных сил. Седиментационный анализ включает наиболее распространённые косвенные методы определения величины частиц, или дисперсности, порошкообразных материалов, аэрозолей, различных грубодисперсных и коллоидных систем.
Методы: отмучивание; дробное оседание; метод отбора массовых проб;
электрофотоседиментометрия; накопление осадка на чашечке весов.
БИЛЕТ №7
Фазовые превращения и равновесия. Основные понятия: фаза, число
компонентов и число степеней свободы. Правило фаз Гиббса.
Оптические свойства коллоидных систем. Уравнение Релея.
Ультрамикроскопия.
1.В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам частей системы. Поясним понятие фазы на следующих примерах. В закрытом сосуде находится вода и над ней смесь воздуха и паров воды. В этом случае мы имеем дело с системой, состоящей из двух фаз: одну фазу образует вода, вторую – смесь воздуха и паров воды. Если в воду добавить несколько кусочков льда, то все эти кусочки образуют третью фазу. Различные кристаллические модификации какого-либо вещества также представляют собой разные фазы.
Равновесие
двух фаз может иметь место лишь в
определенном интервале температур,
причем каждому значению
температуры соответствует
вполне определенное давление ,
при котором возможно равновесие. Таким
образом, состояние равновесия двух фаз
изобразится на диаграмме (Р,Т)
линией
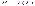 Переход
из одной фазы в другую обычно сопровождается
поглощением или выделением некоторого
количества теплоты, которое называется
скрытой теплотой перехода, или просто
теплотой перехода. Такие переходы
называются фазовыми
переходами первого рода.
Существуют переходы из одной кристаллической
модификации в другую, которые не связаны
с поглощением или выделением теплоты.
Такие переходы называются фазовыми
переходами второго рода.
Фазовые переходы второго рода не
исчерпываются переходами между различными
кристаллическими модификациями.
Классификацию фазовых переходов первого
рода удобно провести с помощью следующей
блок схемы:
Переход
из одной фазы в другую обычно сопровождается
поглощением или выделением некоторого
количества теплоты, которое называется
скрытой теплотой перехода, или просто
теплотой перехода. Такие переходы
называются фазовыми
переходами первого рода.
Существуют переходы из одной кристаллической
модификации в другую, которые не связаны
с поглощением или выделением теплоты.
Такие переходы называются фазовыми
переходами второго рода.
Фазовые переходы второго рода не
исчерпываются переходами между различными
кристаллическими модификациями.
Классификацию фазовых переходов первого
рода удобно провести с помощью следующей
блок схемы:

плавление;
кристаллизация;
испарение;
конденсация;
конденсация;
сублимация.
Фаза – часть системы, при отсутствии внешних полей одинаковая во всех точках по химическому составу, физическим свойствам и отдаленная от других однородных частей системы поверхностью раздела.
Число компонентов – наименьшее число составляющих, с помощью которых можно описать состав каждой фазы системы в отдельности.
Числом степеней свободы называется число независимых параметров (температура, давление и концентрации компонентов), задание которых полностью определяет состояние системы при равновесии.
