
- •Методические рекомендации по выполнению самостоятельной работы
- •Содержание
- •Раздел I. Неорганическая химия…………………………………………………………5
- •1.9. Химия s-элементов…………………………………………………………………….. 115
- •Раздел II. Аналитическая химия………………………………………………………….133
- •Введение
- •Раздел I. Неорганическая химия
- •1.1. Основные законы химии. Газовые законы. Классы неорганических соединений
- •Основные понятия химии и единицы их измерения
- •Основные законы химии
- •Примеры решения типовых задач
- •Газовые законы
- •Основные газовые процессы
- •Примеры решения типовых задач Газовые законы
- •Vэ(н2) –это мольный объём водорода при н.У. , равный 11,2 л (11200мл)
- •Основные классы неорганических соединении
- •Вопросы для самоконтроля
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •1.2. Строение атома. Периодический закон и периодическая система д. И. Менделеева. Химическая связь
- •Вопросы для самоконтроля
- •Примеры решения типовых задач
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •1.3. Энергетика химических процессов
- •Вопросы для самоконтроля
- •Примеры решения типовых задач
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Скорость химических реакций
- •Влияние катализаторов на скорость реакции
- •Химическое равновесие
- •Вопросы для самоконтроля
- •Примеры решения типовых задач
- •Варианты контрольных заданий Вариант 1
- •Вариант 8
- •Вариант 9
- •Вариант 15
- •Вариант 16
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •1.5. Растворы неэлектролитов. Концентрация. Коллигативные свойства растворов
- •Растворы
- •Растворимость
- •Факторы, влияющие на растворимость
- •Способы выражения состава растворов
- •Примеры решения типовых задач Способы выражения концентраций растворов
- •Коллигативные свойства растворов
- •Примеры решения типовых задач Свойства разбавленных растворов неэлектролитов
- •Вопросы для самоконтроля
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •1.6. Растворы электролитов. Ионные равновесия и обменные реакции в растворах электролитов
- •Растворыэлектролитов. Теория электролитической диссоциации
- •Произведение растворимости
- •Водородный показатель
- •Смещение ионных равновесий
- •Гидролизсолей
- •Жесткость воды и методы её устранения
- •Вопросы для самоконтроля
- •Примеры решения типовых задач
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •1.7. Окислительно-восстановительные реакции и электродные потенциалы. Электролиз
- •Окислительно-восстановительные реакции
- •Электродные потенциалы
- •Закон электролиза
- •Вопросы для самоконтроля
- •Примеры решения типовых задач Составление уравнений окислительно-восстановительных реакций (метод полуреакций)
- •Переходим к молекулярной форме уравнения:
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •1.8. Комплексные соединения
- •Номенклатура комплексных соединений
- •Вопросы для самоконтроля
- •Примеры решения типовых задач
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •1.9. Химия s- элементов
- •Общая характеристика элементовI- а группы
- •Общая характеристика элементов II - а группы
- •Вопросы для самоконтроля
- •Литература:
- •1.10.Химия p- элементов
- •Применение соединений хлора в сельском хозяйстве (по направлению «Агрономия»)
- •Краткая характеристика p – элементов IV - a группы
- •Краткая характеристика p – элементовVi-а группы
- •Краткая характеристика p – элементов VII -а группы (Галогены)
- •Литература:
- •Вопросы для самоконтроля
- •1.11.Химия d-элементов
- •Краткая характеристика d – элементов
- •Литература:
- •Примеры решения типовых задач По s, p, d– элементам периодической системы д. И. Менделеева
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант20
- •Вариант26
- •Вариант27
- •Вариант28
- •Вариант29
- •Вариант30
- •Раздел II. Аналитическая химия
- •2.1. Теоретические основы аналитической химии
- •Способы выполнения аналитических реакций
- •Реакции, используемые в аналитической химии
- •Сигналы методов качественного анализа
- •Требования к аналитическим реакциям
- •Реактивы
- •Метрология в химическом анализе
- •1. Группы методов анализа (по способу выполнения).
- •Классификация катионов по кислотно-основному методу
- •Классификация анионов
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Гравиметрический анализ (весовой)
- •Вопросы для самоконтроля
- •2. Механизм образования осадка и условия осаждения.
- •Примеры решения типовых задач
- •1. Механизм образования осадка и условия осаждения.
- •1. Механизм образования осадка и условия осаждения.
- •Сущность титриметрического анализа
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа
- •I. По характеру химической реакции методы классифицируются как:
- •3.Окислительно-восстановительное титрование (редоксиметрия):
- •II. По способу титровани
- •Приготовление титрованных растворов
- •Вычисление результатов определений в титриметрическом анализе
- •Основные уравнения для титриметрического анализа
- •Вопросы для самоконтроля
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Тема 2.5. Теоретические основы и классификация физико-химических методов анализа
- •Рекомендуемая литература
- •Дополнительная литература:
- •ПриложениЕ
- •Константы устойчивости некоторых комплексов
Жесткость воды и методы её устранения
В природе чистая вода не встречается: она всегда содержит примеси каких – либо веществ. Взаимодействуя с солями, содержащимися в земной коре, вода приобретает определённую жёсткость.
Жёсткость воды – совокупность свойств, обусловленных содержанием в ней катионов кальция Са2+ и катионов магния Mg2+.
Катионы кальция Са2+ обуславливают кальциевую жёсткость, а катионы магния Mg2+ -магниевую жёсткость воды.
Общая жёсткость складывается из кальциевой и магниевой, т.е. из суммарной концентрации в воде этих катионов.
Различают карбонатную (временную) и некарбонатную (постоянную) жёсткость.
Карбонатная жёсткость вызвана присутствием гидрокарбонатов кальция и магния. При кипячении гидрокарбонаты разрушаются, а образующиеся малорастворимые карбонаты выпадают в осадок, и общая жёсткость воды уменьшается на значение карбонатной жёсткости. При кипячении катионы кальция Са2+ осаждаются в виде карбоната кальция:
Са2+ + 2НСО3− = СаСО3↓ + Н2О + СО2
Катионы магния Mg2+ осаждаются в виде основного карбоната или в виде гидроксида магния (при рН > 10,3):
2Mg2+ + 2НСО3− + 2OH− = (MgOH)2CO3↓ + Н2О + СО2
(гидроксид –ионы OH− образуются за счёт взаимодействия ионов НСО3− с водой: НСО3− + Н2О ↔ Н2СО3 + ОН−).
Некарбонатная жёсткость определяется содержанием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов. При кипячении эти соли не удаляются.
По величине жёсткости воду делят на 6 классов.
Таблица 1.3.1.
Классы |
Жёсткость воды (ммоль экв/л) |
1 (очень мягкая) 2 (мягкая) 3 (средней жёсткости) 4 (довольно жёсткая) 5 (жёсткая) 6 (очень жёсткая) |
0 – 1,5 1,5 – 3,0 3,0 – 4,5 4,5 – 6,0 6,0 – 10,0 свыше 10,0
|
Жёсткая вода оказывает вредное действие на технологические процессы и вызывает неприятные явления при использовании её в быту.
Обработка воды, приводящая к снижению жесткости воды, называется умягчением воды.
Существующие способы умягчения можно разделить на 3 группы:
1. реагентные (химические) методы умягчения воды. Химическая обработка воды основана на переводе растворимых солей кальция и магния в труднорастворимыее соли; В качестве реагентов–осадителей применяют известь, соду, едкий натр, фосфаты натрия и др. Чаще применяется сода в смеси с известью или едким натром;
2. умягчение воды методом ионного обмена (пропускание воды через ионообменные смолы);
3. термическое умягчение воды (кипячение).
Для устранения временной жёсткости воды применяют:
– термическое умягчение (кипячение):

– реагентное умягчение гашёной известью:

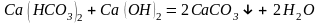
Известь нейтрализует углекислоту, которая является одной из причин коррозии металлов, осаждает железо и способствует коагуляции коллоидов, например, кремниевой кислоты.
Для устранения общей жёсткости методом осаждения используют:
– карбонат натрия (соду):




– фосфат натрия (тринатрийфосфат):

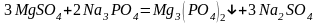
В последнее время для очистки воды стали широко применять иониты (ионообменные смолы). Метод ионного обмена – катионирование основан на фильтровании через слой катионита, при котором происходит замещение ионов Ca2 и Mg2+, содержащихся в воде, на катионы Na+, K+ или NH+4, содержащиеся в твёрдой фазе катионита. В качестве катионитов в основном применяют иониты КУ-I и КУ-2.
В некоторых случаях требуется удалить из воды не только катионы Ca2+ и Mg2+, но и другие катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н+-катионит) и анионит, содержащий гидроксильные ионы (ОН––анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка воды называется обессоливанием:

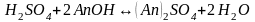
Обменная
ёмкость
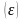 катионита определяется из соотношения:
катионита определяется из соотношения:
 (ммоль
экв/г),
(ммоль
экв/г),
где: V- объём воды, пропущенный через катионит, л;
m – масса катионита, г.
Общая жёсткость воды может быть рассчитана по формуле:
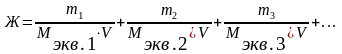 (ммоль
экв/л)
(ммоль
экв/л)
где: m1, m2, m3 – массы содержащихся в воде катионов кальция, магния (или соответствующих им солей), мг;
Мэкв.1 , Мэкв.2 , Мэкв.3 – молярные массы эквивалентов металлов (или соответствующих им солей), г/моль экв;
V– объём воды, л.
Для
расчётов можно также применять формулу,
которая выражается суммой миллиэквивалентов
(мэкв) катионов кальция и магния,
содержащихся в 1 л воды (моль/л). Один
миллимоль жёсткости отвечает содержанию
20,04 мг/л катионов кальция Са2+
или 12,16 мг/л катионов магния Mg2+,
то согласно определению, общую жёсткость
воды Ж (в ммоль/л) можно вычислить по
формуле:
 ,
где [Са2+]
и [Mg2+]
– концентрация соответствующих ионов
в мг/л.
,
где [Са2+]
и [Mg2+]
– концентрация соответствующих ионов
в мг/л.
