
- •Міністерство освіти і науки україни
- •Плани подачі матеріалу
- •Лекція 1 Кінематика матеріальної точки
- •1.2 Основні кінематичні характеристики руху: траєкторія, переміщення, шлях, швидкість, прискорення. Зв’язок між ними.
- •1.3 Поступальний рух тіла. Рівномірний та рівноприскорений рухи. Рівномірний прямолінійний рух
- •1 . Визначення. Рівномірний прямолінійний рух - це такий рух, при якому тіло за рівні проміжки часу здійснює однакові переміщення.
- •1. Рівноприскорений прямолінійний рух - це такий рух при якому тіло за рівні проміжки часу змінює свою швидкість на однакову величину.
- •1.4 Вільний рух тіла в полі тяжіння Землі.
- •Прискорення вільного падіння g (ф.В.)
- •Переміщення при вільному падінні тіл
- •Звернути увагу!!!
- •Лекція 2 Основні поняття динамики
- •2.1. Взаємодія між тілами. Фундаментальні взаємодії. Поняття сили та маси. Сили у природі.
- •2.2 Сила пружності. Закон Гука. Механічна напруга Модуль пружності. Діаграма розтягу. Запас міцності. Крихкість. Пластичність
- •Механічна напруга (ф.В.)
- •Закон Гука
- •Діаграма розтягу тіл
- •2 .3 Сили тертя. Коефіцієнт тертя. Сила опору середовища. Сила тертя кочення
- •2.4 Закони Ньютона. Інерціальні системи відліку
- •2.5. Імпульс матеріальної точки. Імпульс сили. Закон збереження імпульсу. Центр мас системи. Рух центра мас.
- •Л екція 3. Робота та енергія
- •3.1 Механічна робота. Визначення роботи змінної сили через лінійний інтеграл. Потужність. Зв’язок між роботою та потужністю.
- •3.3 Кінетична енергія матеріальної точки. Теорема про зміну кінетичної енергії системи. Повна механічна енергія системи тіл. Закон збереження механічної енергії.
- •3.6 Пружні та не пружні зіткнення тіл
- •4.1 Обертання твердого тіла навколо нерухомої осі. Момент сили.
- •4.2 Момент інерції тіла. Теорема Штейнера.
- •4.3 Основний закон динаміки обертального руху. Умови рівноваги тіл
- •4.4 Момент імпульсу тіла, що здійснює обертання. Закон збереження моменту імпульсу
- •4.5 Робота й потужність моменту сили. Кінетична енергія обертального руху твердого тіла.
- •Лекція 5. Елементи механіки рідин
- •5.1 Гідростатика. Тиск в рідині. Закон Паскаля. Закон Архімеда
- •5.2 Гідроаеродинаміка. Ламінарна й турбулентна течія. Число Рейнольдса
- •5.3 Рівняння неперервності струменя рідини. Рівняння Бернуллі
- •5.4 Сила внутрішнього тертя. Закон Стокса. Динамічна в'язкість. Формула Пуазейля
- •Лекція 6. Фізичні основи молекулярно – кінетичної теорії
- •6.1. Поняття про статистичні й термодинамічні методи досліджень. Основні поняття мкт. Основні положення мкт й докази їх справедливості. Ідеальний газ
- •6.2 Мікроскопічні та термодинамічні параметри газу. Основне рівняння молекулярно-кінетичної теорії ідеального газу. Середня кінетична енергія молекул.
- •6.3 Молекулярно-кінетичне тлумачення абсолютної температури. Рівняння Клапейрона-Менделєєва.
- •6.4 Розподіл швидкостей молекул за Максвелом
- •6 .5 Ефективний діаметр молекул. Середня довжина вільного пробігу молекул.
- •7.1 Явища переносу в газах. Теплопровідність. Закон Фур'є. Коефіцієнт теплопровідності газів.
- •7.2 Явище самодифузії. Закон Фіка. Коефіцієнт самодифузії
- •7.3 Внутрішнє тертя (в'язкість). Закон Ньютона для внутрішнього тертя. Коефіцієнт внутрішнього тертя. Зв'язок між коефіцієнтами для явища переносу
- •7.4 Внутрішня енергія. Внутрішня енергія ідеального газу. Ступені свободи молекул. Розподіл енергії молекул по ступенях свободи.
- •7.5 Теплота й робота. Перший закон термодинаміки.
- •7.6 Теплоємність ідеального газу в різних процесах. Рівняння Майєра
- •Лекція 8. Другий закон термодинаміки. Теплові двигуни
- •8.1 Оборотні процеси. Кругові процеси (цикли). Призначення і принцип дії теплових двигунів. Коефіцієнт корисної дії теплового двигуна.
- •8.2 Ентропія. Властивості ентропії. Ентропія ізольованої системи. Ентропія та ймовірність.
- •8.3 Другий закон термодинаміки. Теорема Карно. Цикл Карно. Наслідки теореми Карно.
- •Лекція 9. Реальні гази. Рідини. Тверді тіла
- •9.1 Особливості молекулярної будови газів, рідин, твердих тіл
- •Особливості молекулярної будови рідини
- •Особливості молекулярної будови твердих тіл
- •9.2 Критична температура. Пароутворення. Явище випаровування й конденсації. Явище кипіння.
- •9.3 Насичена пара. Властивості насиченої пари
- •9.4 Абсолютна та відносна вологість повітря
- •9.5 Явище поверхневого натягу рідин. Сили поверхневого натягу. Коефіцієнт поверхневого натягу. Явище змочування. Капілярні явища
- •Лекція 10. Електростатичне поле у вакуумі
- •10.1 Електричний заряд. Дискретність заряду. Електризація тіл. Закон збереження електричного заряду. Закон Кулона
- •Властивості електричних зарядів
- •Закон збереження заряду
- •Закон Кулона (1785р.)
- •10.2 Електричне поле. Напруженість електричного поля. Принцип суперпозиції. Поле системи зарядів
- •10.3. Потік вектора е. Теорема Остроградського-Гауса для потоку вектора е.
- •10.4 Напруженість електростатичного поля заряджених тіл
- •10.5 Робота сил поля. Потенціальність електростатичного поля. Потенціальна енергія заряду в полі.
- •10.6 Циркуляція вектора е. Властивості циркуляції вектора е електростатичного поля
- •10.7 Потенціал електричного поля. Робота по переміщенню заряду в електричному полі. Різниця потенціалів.
- •10.8 Принцип суперпозиції полів для потенціалу. Напруженість як градієнт потенціалу. Еквіпотенціальні поверхні
- •Лекція 11. Електричне поле в речовині
- •1 1.1 Електричний диполь. Напруженість і потенціал поля диполя. Диполь у зовнішньому електричному полі
- •11.2 Вільні та зв’язані електричні заряди. Поверхневі зв’язані заряди. Полярні та неполярні молекули. Поляризація діелектриків. Вектор поляризації.
- •11.3 Вектор поляризації. Зв'язок між p і е. Діелектрична сприйнятливість речовини
- •11.4 Умови рівноваги зарядів у провіднику. Потенціал провідника. Поле поблизу поверхні провідника. Розподіл зарядів по поверхні провідника. Електростатичний захист.
- •11.5 Електроємність провідника. Конденсатори. Ємність конденсатора. Енергія системи зарядів.
- •11.6 Енергія конденсатора. Енергія й об’ємна густина енергії електричного поля.
- •Лекція 12. Постійний електричний струм
- •12.1 Електричний струм, умови його існування. Сила та густина струму. Рівняння нерозривності. Закон Ома для ділянки кола в інтегральній та диференціальній формах.
- •12.2 Робота електричного струму. Закон Джоуля-Ленца в інтегральній та диференціальній формах. Потужність і к.К.Д. В колі постійного струму.
- •12.3 Узагальнений закон Ома в інтегральній формі. Електрорушійна сила. Закон Ома для повного кола
- •Лекція 13. Електричний струм у різних середовищах
- •13.1 Електричний струм у металах. Основні положення класичної електронної теорії. Швидкість упорядкованого руху електронів у металі.
- •13.2 Залежність опору провідника від температури. Температурний коефіцієнт електричного опору провідника. Явище надпровідності. Властивості провідників у надпровідному стані
- •Температурний коефіцієнт електричного опору провідника α (ф.В.)
- •13.3 Електричний струм у газах. Явище іонізації газу. Явище ударної іонізації газу. Електронна емісія. Плазма. Властивості плазми
- •Властивості плазми
- •13.4 Види самостійних електричних розрядів у газах. Тліючий розряд. Дуговий розряд. Іскровий розряд. Коронний розряд
- •Лекція 14. Магнітне поле. Магнітна індукція
- •14.1 Магнітна взаємодія струмів. Магнітне поле. Магнітна індукція
- •14.2 Магнітний момент. Вектор напруженості магнітного поля. Магнітна проникність речовини. Силові лінії магнітного поля (Лінії індукції магнітного поля)
- •1 4.3. Закон Біо-Савара-Лапласа. Напруженості магнітного поля окремих елементів зі струмом. Взаємодія паралельних струмів. Принцип суперпозиції. Закон Ампера.
- •14.4 Сила Лоренца. Дія магнітного поля на заряди, що рухаються. Ефект Холла.
- •14.5. Циркуляція вектора магнітної індукції. Теорема про циркуляцію вектора магнітної індукції в інтегральній формі. Магнітний потік. Теорема Гауса для вектора в.
- •14.6 Робота з переміщення провідника зі струмом у магнітному полі. Індуктивність контуру (статична)
- •Лекція 15. Електромагнітна індукція
- •15.1 Явище електромагнітної індукції. Закон електромагнітної індукції. Ерс провідника, що рухається в магнітному полі. Ерс індукції в нерухомих провідниках. Правило Ленца.
- •15.2 Явище самоіндукції. Індуктивність (динамічна) контуру. Перехідні процеси в колі з індуктивністю. Час релаксації.
- •15.3 Енергія контуру зі струмом. Енергія магнітного поля. Об’ємна густина енергії магнітного поля.
- •16.1 Гармонічні коливання. Представлення гармонічних коливань у тригонометричній формі. Представлення гармонічних коливань у вигляді векторної діаграми
- •16.2 Математичний маятник. Пружинний маятник. Основні характеристики коливань. Фаза коливань. Початкова фаза коливань. Циклічна частота коливань. Амплітуда коливань. Період коливань. Частота коливань
- •Фаза коливань j (ф.В.)
- •Початкова фаза коливань j0 (ф.В.)
- •Циклічна частота коливань ω (ф.В.)
- •Амплітуда коливань a (ф.В.)
- •Період коливань t (ф.В.)
- •Частота коливань (ню) (ф.В.)
- •16.2 Диференціальне рівняння вільних коливань лінійного гармонічного осцилятора. Затухаючі вільні коливання. Диференціальне рівняння затухаючих коливань
- •16.3 Логарифмічний декремент загасання. Енергія коливального руху. Добротність коливальної системи
- •1 6.4 Вимушені коливання. Диференціальне рівняння вимушених механічних коливань, аналіз його розв’язку. Амплітуда і фаза вимушених коливань.
- •16.5 Механічний резонанс. Добротність коливальної системи при резонансі
- •Лекція 17. Електромагнітні коливання
- •1 7.1. Електричний коливальний контур. Власні електромагнітні коливання.
- •17.2 Перетворення енергії в коливальному контурі. Виведення диференціального рівняння власних коливань. Формула Томсона
- •17.3 Диференціальне рівняння затухаючих електричних коливань та його розв’язок. Вимушені електричні коливання, їх диференціальне рівняння
- •17.4 Резонансні криві коливального контуру. Характеристичний (хвилевий) опір контуру. Добротність коливального контуру
- •Лекція 18. Механічні хвилі
- •18.1 Механічні хвилі. Рівняння плоскої хвилі. Хвильове число
- •18.2 Види хвиль. Характеристики хвиль. Властивості хвиль
- •18.3 Властивості механічних хвиль. Хвильовий вектор. Фазова швидкість. Групова швидкість хвилі
- •18.4 Енергія хвильового руху. Вектор Умова
- •18.5 Когерентність. Інтерференція хвиль. Стояча хвиля.
- •Л екція 19. Електромагнітні хвилі
- •19.1 Електромагнітні хвилі у вакуумі. Основні властивості електромагнітної хвилі.
- •Властивості електромагнітних хвиль
- •19.2 Шкала електромагнітних хвиль
- •1. Низькочастотні хвилі (змінний струм).
- •2. Радіохвилі
- •3. Інфрачервоне випромінювання
- •4. Видиме світло
- •5. Ультрафіолетове випромінювання
- •6. Рентгенівське випромінювання
- •7. Гамма випромінювання й космічні промені
- •19.2 Перенесення енергії електромагнітними хвилями. Вектор Пойнтінга
- •20.1 Фотометрія. Основні фотометричні величини і їх одиниці. Світлові величини.
- •Лекція 21. Хвильова оптика. Інтерференція світла
- •21.1 Світлові хвилі. Монохроматичність. Оптична різниця ходу. Когерентність хвиль
- •21.2 Явище інтерференції світла
- •21.3 Інтерференція від двох точкових джерел (дослід Юнга). Методи одержання інтерференційних картин: бідзеркало та біпризма Френеля, дзеркало Ллойда
- •21.4 Інтерференція на тонких плівках
- •21.5 Просвітлення оптики. Смуги рівної товщини і рівного нахилу. Інтерферометри. Кільця Ньютона
- •2 2.1 Явище дисперсії світла. Світло й кольори тіл
- •22.2 Явище поляризації світла. Поляризатори. Кут Брюстера
- •22.3 Закон Малюса. Оптично-активні середовища. Закон Біо
- •2 3.1 Явище дифракції світла. Зони Френеля
- •2 3.2 Дифракція Фраунгофера. Дифракція Фраунгофера на двох щілинах
- •2 3.3 Дифракція на отворі. Зони Френеля. Дифракція Фраунгофера на одній щілині
- •23.3 Дифракційна решітка. Дифракційний спектр. Роздільна здатність дифракційної решітки
- •23.4 Дифракція на просторовій решітці. Формула Вульфа-Брегга. Рентгеноструктурний аналіз
- •Лекція 24. Теплове випромінювання
- •24.1 Теплове випромінювання. Властивості теплового випромінювання
- •24.2 Основні характеристики теплового випромінювання. Енергетична світність тіла. Спектральна густина енергетичної світності. Коефіцієнт поглинання
- •24.3 Закон Стефана-Больцмана. Закон зміщення Віна
- •2 4.4 Ультрафіолетова катастрофа. Квантова гіпотеза випромінювання м. Планка
- •24.5 Оптична пірометрія. Радіаційна температура. Колірна температура. Температура яскравості
- •25.1 Енергія, маса та імпульс фотона
- •25.2 Фотоелектричний ефект. Явище внутрішнього фотоефекту
- •25.3 Явище зовнішнього фотоефекту. Рівняння а. Ейнштейна для фотоефекту. Робота виходу. Максимальна кінетична енергія фотоелектрона.
- •25.4 Закони фотоефекту
- •25.5 Ефект Комптона. Тиск світла. Досліди Лебедєва
- •25.6 Досліди Резерфорда. Ядерна модель атома Резерфорда. Труднощі ядерної моделі атома
- •25.7 Постулати Бора. Досліди Франка і Герца
- •25.8 Походження лінійчатих спектрів випромінювання атомів. Спектри випромінювання воднеподібних атомів. Формула Бальмера-Рідберга. Спектральні серії.
- •Література
6.4 Розподіл швидкостей молекул за Максвелом
У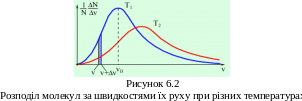 наслідок
багаторазових зіткнень молекул газу
між собою та зі стінками посудини, у
якій міститься велика кількість молекул,
встановлюється деякий статистичний
розподіл молекул за швидкостями. Дж.
Максвелл у 1859 році, застосовуючи методи
теорії ймовірності, вивів закон розподілу
молекул за швидкостями, використавши
основні положення молекулярно-кінетичної
теорії:
наслідок
багаторазових зіткнень молекул газу
між собою та зі стінками посудини, у
якій міститься велика кількість молекул,
встановлюється деякий статистичний
розподіл молекул за швидкостями. Дж.
Максвелл у 1859 році, застосовуючи методи
теорії ймовірності, вивів закон розподілу
молекул за швидкостями, використавши
основні положення молекулярно-кінетичної
теорії: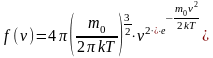
Як видно з наведеної формули, функція розподілу Максвелла залежить від температури газу, маси частинок і їхньої швидкості. На рисунку 6.2 представлені типові криві розподілу молекул за швидкостями. По осі абсцис відкладено модуль швидкості, а по осі ординат – відносне число молекул, швидкості яких лежать в інтервалі від v до v + Δv. Це число дорівнює площі виділеного стовпця. З графіку розподілу молекул за швидкостями можемо зробити наступні висновки.
1. Крива розподілу не проходить через початок координат, що свідчить про те, що немає молекул, які б не рухались.
2. Крива має максимум, після якого асимптотично наближається до осі абсцис. Отже, дуже великі швидкості малоймовірні.
3. Крива розподілу швидкостей не симетрична - один бік кривої крутіший, ніж другий.
4. З підвищенням температури максимум на кривій розподілу зміщується вздовж осі абсцис вправо.
5. Криві розподілу молекул за швидкостями для різних газів мають однаковий характер, хоча їх координати й положення максимумів різні, оскільки швидкості молекул залежать не лише від температури, а й від маси.
Найбільш
ймовірна швидкість
хаотичного руху молекул відповідає
максимуму функції розподілу:
 .
.
Формула
Максвелла також дає змогу визначити
середню арифметичну швидкість молекул:
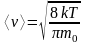 .
.
Для
середньої квадратичної швидкості
розподіл Максвела дає наступний вираз: .
.
Уперше швидкість теплового руху атомів експериментально визначив німецький вчений-фізик Отто Штерн 1920 року. Результати експерименту повністю узгоджувалися із теорією роподілу Максвела, тим самим підтверджуючи її правильність.
6 .5 Ефективний діаметр молекул. Середня довжина вільного пробігу молекул.
Ефективний діаметр молекул
Визначення. Мінімальна відстань d, на яку зближаються при зіткненні центри двох молекул, називається ефективним діаметром молекули. (рисунок 6.3)
Ефективний діаметр молекул залежить від швидкості молекул, що зустрічаються, тобто від температури (зі збільшенням T ефективний діаметр зменшується).
Середня довжина вільного пробігу молекул λ
1. Між двома послідовними зіткненнями молекули рухаються рівномірно прямолінійно, проходячи при цьому деякий шлях, який називається довжиною вільного пробігу. У загальному випадку довжина шляху між послідовними зіткненнями різна (λ1≠ λ2≠ λ3≠… λn) але, тому що ми маємо справу з величезною кількістю молекул і вони перебувають у хаотичному русі, можна говорити про середню довжину вільного пробігу λ:
2. Визначення. Довжина вільного пробігу λ - це середня віддаль, яку долає частинка за проміжок часу між зіткненнями з іншими частинками.
3. Це скалярна величина.
4.
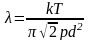 ,
де k -
постійна Больцмана, T
- абсолютна температура, p
- тиск газу, d
- ефективний діаметр
молекули.
,
де k -
постійна Больцмана, T
- абсолютна температура, p
- тиск газу, d
- ефективний діаметр
молекули.
5. [λ] = м.
Запитання до лекції № 6
1. У чому полягає поняття «моль»?
2. Що визначає число Авогадро?
3. Який газ називають ідеальним?
4. Напишіть основне рівняння молекулярно-кінетичної теорії, назвіть величини, що входять у формулу.
5. Напишіть рівняння стану ідеального газу.
7. Дайте кількісну характеристику параметрів газу при нормальних умовах.
8. Назвіть види швидкостей для молекул ідеального газу, напишіть відповідні формули.
9. Напишіть формулу для визначення середньої довжини вільного пробігу молекули ідеального газу.
Лекція 7 Термодинаміка
