
- •Гвоздева н.А. Курс лекций для студентов специальностей
- •Часть II «Неорганическая химия»
- •Лекция 1 Тема: s - Элементы I группы
- •1. Общая характеристика элементов I а группы. Особенности лития и его соединений.
- •Оксиды и гидроксиды
- •Свойства гидроксидов
- •Электролиз
- •Расплав
- •2. Водород (Hydrogenium – воду рождающий)
- •Электролиз
- •3. Вода и ее свойства. Экологическое и биологическое значение н2о
- •4. Пероксид водорода. Окислительно-восстановительная двойственость н2о2
- •Соль пероксида водорода
- •5. Биогенные свойства элементов iа группы
- •Лекция 2 Тема: s - элементы II группы
- •1. Общая характеристика элементов II а группы. Физические и химические свойства щелочноземельных металлов Ca, Sr, Ba ), их бинарных соединений, гидроксидов и солей
- •Способы получения
- •2. Особенности бериллия и его соединений
- •3 Жесткость воды, ее влияние на живые организмы
- •4 Важнейшие соединения элементов II-а группы
- •5 Биогенная роль элементов II-а группы
- •Лекция 3 Тема: p – Элементы III группы
- •1. Общая характеристика элементов III -a группы.
- •2. Бор. Получение. Химические свойства
- •Получение бора
- •Галогениды бора
- •3 Алюминий
- •Получение алюминия
- •Химические свойства алюминия
- •4 Биогенная роль элементов III a группы
- •Лекция 4 Тема: р - Элементы IV группы
- •1. Общая характеристика группы
- •2 Химия углерода
- •Химическая связь в молекуле со
- •Химическая связь в молекуле со2
- •Угольная кислота и ее соли
- •I ступень
- •Сероуглерод (cs2)
- •3 Химия кремния
- •Кремниевые кислоты.
- •4 Химия германия, олова, свинца (Ge, Sn, Pb)
- •5 Биогенная роль р-элементов IV группы
- •Лекция 5 Тема: р - Элементы V группы
- •Общая характеристика элементов V-а группы
- •Nh3 аммиак ph3 фосфин
- •BiH3 висмутин
- •2 Химия азота
- •Получение n2
- •Водородные соединения азота
- •Реагирует с более сильными окислителями
- •Гидразин и гидроксиламин
- •Кислородные соединения азота
- •Важнейшее соединение азота – hno3
- •Свойства концентрированной и разбавленной hno3
- •Нитраты аммония разлагаются
- •Получение азотной кислоты
- •Соли азотной кислоты. Азотные удобрения
- •Наиболее важные азотные удобрения:
- •3 Химия фосфора
- •Получение:
- •Химические свойства:
- •Иодид фосфония
- •Кислородные соединения фосфора
- •Получение удобрений
- •Биогенная роль азота, фосфора и мышьяка
- •2. Химические свойства кислорода и его соединений
- •Лабораторные способы получения о2
- •Промышленные способы получения о2
- •Химические свойства о2
- •Молекула озона о3.
- •Химичесие свойства о3
- •Окислительно-восстановительная двойственность пероксида водорода н2о2
- •Химические свойства серы и ее соединений
- •Сульфаны (полисульфиды водорода)
- •П 2500c олучение so2
- •Химические свойства so2
- •Триоксид серы (серный ангидрид) so3
- •Получение h2so4
- •Химические свойства h2so4
- •Применение солей
- •4. Биогенная роль р-элементов VI группы
- •Лекция 7 Тема: р - Элементы VII группы (галогены)
- •1. Общая характеристика элементов
- •2.Особые свойства фтора, как наиболее электроотрицательного элемента
- •Нахождение в природе
- •Способы получения
- •Химические свойства галогенов
- •IСlO4 – перхлорат йода, йод в катионной форме неустойчив
- •Способы получения галогеноводородов и их свойства
- •Свойства нCl, нBr, нi
- •4 Кислородсодержащие соединения галогенов
- •Кислородсодержащие кислоты хлора
- •Схемы разложения hСlO (зависят от условий протекания процесса)
- •Получение белильной извести
- •Кислородсодержащие кислоты брома и йода
- •5. Биогенная роль (фтор и йод как микроэлементы)
- •Перечень рекомендуемой литературы
3 Химия кремния
Отличие химии кремния от углерода обусловлено большими размерами его атома и возможностью использования 3d-орбиталей. Из-за этого связи Si – O - Si, Si - F более прочны, чем у углерода.
Для кремния известны оксиды состава SiO и SiO2.Монооксид кремния существует только в газовой фазе при высоких температурах в инертной атмосфере; он легко окисляется кислородом с образованием более стабильного оксида SiO2.
2SiO + О2 t 2SiO2
SiO2 – кремнезем, имеет несколько кристаллических модификаций. Низкотемпературная – кварц, обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидности кремнезема – халцедон, опал, агат, песок.
Известно большое разнообразие силикатов (точнее оксосиликатов). В строении их общая закономерность: все состоят из тетраэдров SiO44- которые через атом кислорода соединены друг с другом.
![]()
![]()
![]()
Сочетания тетраэдров могут соединяться в цепочки, ленты, сетки и каркасы.
Важные природные силикаты 3MgOH2O4SiO2 тальк, 3MgO2H2O2SiO2 асбест.
Как и для SiO2 для силикатов характерно (аморфное) стеклообразное состояние. При управляемой кристаллизации можно получить мелкокристаллическое состояние – ситаллы – материалы повышенной прочности. В природе распространены алюмосиликаты – каркасные ортосиликаты, часть атомов Si заменены на Al, например Na12[(Si,Al)O4]12.
Наиболее прочный галогенид SiF4 разлагается только под действием электрического разряда.
![]() гексафторокремниевая
кислота (по силе близка к H2SO4).
гексафторокремниевая
кислота (по силе близка к H2SO4).
(SiS2)n – полимерное вещество, разлагается водой:
![]()
Кремниевые кислоты.
Соответствующие SiO2 кремниевые кислоты не имеют определенного состава, обычно их записывают в виде xH2O • ySiO2 – полимерные соединения
Известны:
H2SiO3 (H2OSiO2) – метакремниевая (не существует реально)
H4SiO4 (2H2OSiO2) – ортокремниевая (простейшая реально существующая только в растворе)
H2Si2O5 (H2O2SiO2) – диметакремниевая.
Кремниевые кислоты – плохо растворимые вещества, для H4SiO4 характерно коллоидное состояние, как кислота слабее угольной (Si менее металличен, чем С).
В водных растворах идет конденсация ортокремневой кислоты, в результате образуются поликремниевые кислоты.
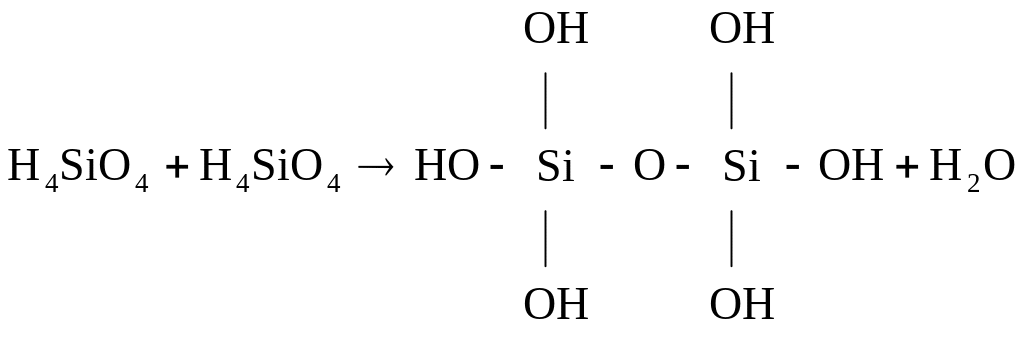
Силикаты – соли кремневых кислот, в воде нерастворимы, кроме силикатов щелочных металлов.
Растворимые силикаты гидролизуются по уравнению
![]()
Желеобразные растворы натриевых солей поликремневых кислот называются «жидким стеклом». Широко применяются как силикатный клей и в качестве консерванта древесины.
Сплавлением Na2CO3, CaCO3 и SiO2 получают стекло, которое является переохлажденным взаимным раствором солей поликремниевых кислот.
6SiO2 + Na2CO3 + CaCO3 Na2O CaO 6SiO2 + 2CO2 Силикат записан как смешанный оксид.
Силикаты больше всего используются в строительстве. 1 место в мире по выпуску силикатной продукции – цемент, 2-е – кирпич, 3 – стекло.
Строительная керамика – облицовочная плитка, керамические трубы. Для изготовления санитарно-технических изделий – стекло, фарфор, фаянс, глиняная керамика.
