
- •Завдання й розділи фізичної хімії
- •Основні термодинамічні поняття й визначення
- •Перший закон термодинаміки
- •Робота розширення при різних процесах
- •Закон гесса.
- •Теплоємність.
- •Тепоємність рідин і твердих речовин.
- •Залежність теплоємності від температури
- •Залежність теплового ефекту хімічної реакції від температури
- •Другий закон термодинаміки. Ентропія.
- •Математичне об’єднання першого і другого законів термодинаміки для термодинамічно оборотних процесів
- •Розрахунок зміни ентропії для різних процесів. Постулат планка.
- •Енергія гіббса, енергія гельмгольца. Рівняння гіббса-гельмгольца.
- •Самодовільне протікання хімічної реакції. Розрахунок зміни енергії гіббса в хімічних реакціях.
- •Хімічний потенціал. Активність і летючість. Розрахунок хімічного потенціалу
- •2. Для суміші ідеальних газів:
- •Термодинаміка хімічної рівноваги. Константа хімічної рівноваги. Закон діючих мас.
- •Принцип ле-шателье.
- •Ізотерма хімічної реакції.
- •Зв'язок стандартної зміни енергії гіббса реакції з константою рівноваги. Розрахунок rG и rG0.
- •Рівновага в гетерогенних реакціях
- •Вплив температури на хімічну рівновагу. Рівняння ізохори й ізобари хімічної реакції.
Зв'язок стандартної зміни енергії гіббса реакції з константою рівноваги. Розрахунок rG и rG0.
Якщо в момент змішання газів, що вступають у реакцію
![]() ,
,
парціальні тиски (концентрації) кожного учасника дорівнюють одиниці (всі речовини вступають у реакцію у своїх стандартних станах), те рівняння ізотерми Вант-Гоффа перетворюється в рівняння для розрахунку енергії Гіббса в стандартних умовах:
![]() .
.
Воно характеризує здатність різних речовин вступати в хімічну взаємодію й не залежить від шляху процесу, а визначається тільки природою речовин. Знак r o указує на напрямок мимовільного процесу, що протікає в стандартних умовах. Ніж більше негативна ця величина, тим більше Кр, тим глибше йде процес. При рівновазі величина r дорівнює нулю, тобто подальша мимовільна зміна в системі виключено.
Стандартний ізобарний потенціал хімічної реакції (або хімічна спорідненість речовин) дорівнює ізобарному потенціалу хімічної реакції
![]() (20)
(20)
за умови, що парціальні тиски всіх речовин реакції, рівні рo = 1 атм = 101325 Па.
У загальному випадку (для реальних і ідеальних систем) справедливо:
![]() ,
,
де ai – активність компонента або відношення парціального тиску газу до стандартного тиску (ai – безрозмірна величина) тобто
![]() . (21)
. (21)
Величину
![]() при Т = 298.15
До знаходять на підставі довідкових
даних:
при Т = 298.15
До знаходять на підставі довідкових
даних:
1)
![]() ,
де
,
де
![]() – стандартна вільна енергія Гіббса
утворення речовини.
– стандартна вільна енергія Гіббса
утворення речовини.
2)
![]() .
.
Аналогічно проводять розрахунок при інших температурах з урахуванням температурної залежності ентальпії й ентропії реакції:
![]() , (22)
, (22)
![]() . (23)
. (23)
При
відомих значеннях
![]() і початкових парціальних тисках або
активностях речовин, що беруть участь
і початкових парціальних тисках або
активностях речовин, що беруть участь
![]() у реакції, розрахунок проводять по
формулах:
у реакції, розрахунок проводять по
формулах:
, (24)
. (25)
Рівновага в гетерогенних реакціях
Дотепер мова йшла про гомогенні реакції ( що протікають в одній фазі). Розглянемо гетерогенні реакції, у яких не всі речовини перебувають у газоподібному стані. У випадку гетерогенних систем, у яких рідкі або тверді речовини не утворять розчинів один з одним і з газоподібними речовинами, хімічні потенціали цих конденсованих речовин при постійній температурі будуть постійними, також як і тиск насичених пар над кожною з таких речовин у суміші. Тому у вираження для констант рівноваги входять летючості або тиску тільки газоподібних речовин. Тверді або рідкі фази є індивідуальними сполуками, активність і хімічний потенціал яких залежать тільки від температури.
Наприклад,
для реакції
![]()
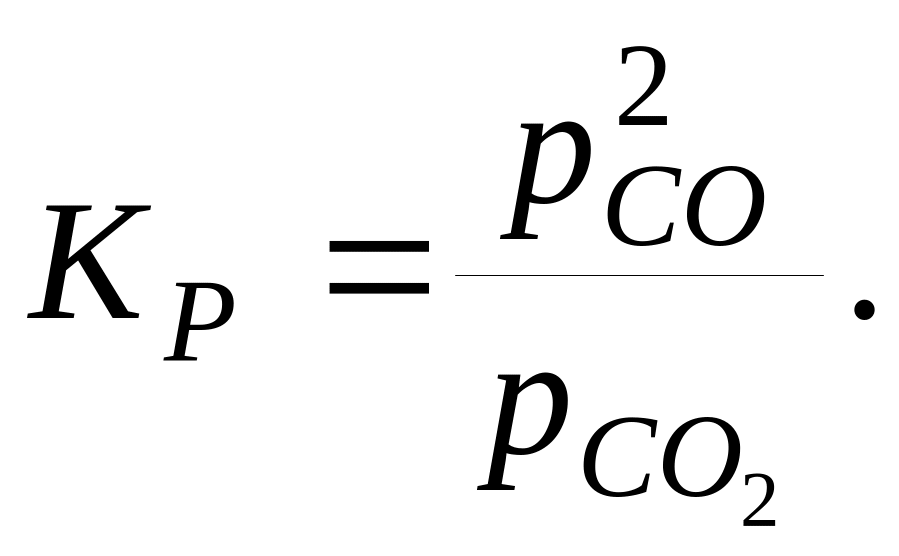
У випадку, якщо в реакції беруть участь розчинені речовини, у вираження для констант рівноваги також входять активності (концентрації) цих речовин.
Вплив температури на хімічну рівновагу. Рівняння ізохори й ізобари хімічної реакції.
Продиферинцуємо рівняння ізотерми хімічної реакції (4.15) по температурі:
![]() ,
,
![]() . (26)
. (26)
Підставимо
отриману похідну
![]() в рівняння Гіббса – Гельмгольца
в рівняння Гіббса – Гельмгольца
![]()
і після скорочення подібних членів одержимо співвідношення:
![]() , (27)
, (27)
що устанавлюває зв'язок між зміною константи рівноваги з температурою й тепловим ефектом реакції, що протікає при постійному тиску. Це співвідношення називають рівнянням ізобари хімічної реакції або ізобарою Вант-Гоффа.
Для процесів, що протікають при постійному об'ємі, можна за аналогією одержати рівняння ізохоры хімічної реакції або ізохоры Вант-Гоффа:
![]() . (28)
. (28)
Рівняння (27) і (28) у диференціальній формі виражають зміна константи рівноваги з температурою й називаються рівняннями Вант-Гоффа. Згідно із цими рівняннями вплив температури на константу рівноваги визначається знаком ентальпії реакції rН або зміною внутрішньої енергії rU. Наприклад, при проведенні реакції в умовах сталості тиску:
якщо rН < 0 (екзотермічна реакція), то підвищення температури зменшує величину КР (мал. 1), зміщаючи рівновагу реакції вліво, тобто убік утворення вихідних речовин;
я кщо
rН > 0
(ендотермічна реакція), то ріст температури
приводить до збільшення КР
(мал. 1), зміщаючи рівновагу реакції
вправо.
кщо
rН > 0
(ендотермічна реакція), то ріст температури
приводить до збільшення КР
(мал. 1), зміщаючи рівновагу реакції
вправо.
Рис. 1. Вплив температури на величину константи
рівноваги хімічної реакції.
Для кількісної оцінки впливу температури на константу рівноваги рівняння ізобари (ізохори) (27) і (28) необхідно інтегрувати в необхідному інтервалі температур (наприклад, уважаючи тепловий ефект у цьому інтервалі температур постійним і рівним стандартному). Після інтегрування одержуємо наступне рівняння:
![]() , (29)
, (29)
де
![]() й
й
![]() – константи рівноваги при T1
і T2,
– константи рівноваги при T1
і T2,
![]() – середній
тепловий ефект реакції в інтервалі
температур від Т1
до Т2.
На підставі рівняння (29) можна також
розрахувати константу рівноваги при
будь-якій температурі, якщо відомі
тепловий ефект хімічної реакції і
константа рівноваги при якій-небудь
одній температурі.
– середній
тепловий ефект реакції в інтервалі
температур від Т1
до Т2.
На підставі рівняння (29) можна також
розрахувати константу рівноваги при
будь-якій температурі, якщо відомі
тепловий ефект хімічної реакції і
константа рівноваги при якій-небудь
одній температурі.
