
- •Қазақстан республикасының білім және ғылым министрлігі қ.Жұбанов атындағы ақтөбе өңірлік мемлекеттік университеті
- •5В070900 – «Металлургия» мамандығының күндізгі және сырттай бөлімінің 3 курс студенттеріне арналған «металлургия өндірісінің технологиясы - 2» пәні бойынша практикалық сабақтарға әдістемелік нұсқау
- •Оттекті - конвертерлі балқытудың үрлеу тәртібі
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •3. Үрлеу қарқындылығы немен мінезделеді?
- •Балқытудағы материалдық тепе - теңдік элементтерін есептеу
- •3. Есеп шығару мысалдары
- •4. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Марганецтің тотығуы үшін қажет техникалық оттегінің санын анықтау
- •Сыйымдылығы 300т конвертор үшін кремнийдің тотығуына алынған қождың санын анықтау
- •1,2 · 300 · 10 3700Кг, немесе 3,70т.
- •Өзіндік жұмысқа арналған тапсырмалар
- •Қорытпаның жылулық режимі
- •2. Есеп шығару мысалдары
- •3. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Болаттың қышқылсыздануы
- •3. Есеп шығару мысалдары
- •4. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Оттектік фурма соплоларын есептеу
- •4. Есеп шығару мысалдары
- •5. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Болат өндірісіндегі технико - экономикалық көрсеткіштері
- •3. Есеп шығару мысалдары
- •4. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Болат балқыту үрдісінің қождары
- •3. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •1. Темір тотығының белсенділігін есептеу әдісі
- •1.1 Чипмен әдісі бойынша есептеу (молекулалық теория)
- •1.2 Мүлтiксiз иондық ерiтiндiлердiң теориясы бойынша есептеу
- •1.3 Тсир Самарин және Шварцманның түзетуі бойынша есептеу
- •1.5 Кожеуров әдісі бойынша есептеу (жүйелi иондық ерiтiндiлердiң теориясы):
- •Өзіндік жұмысқа арналған тапсырмалар
- •Газдарды есептеу
- •3. Есеп шығару мысалдары
- •4. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •(8.10, A) теңдігіне қойып, өрнектейміз:
- •Е сеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Конвертерлік ваннаның араластыру қуатын есептеу
- •3. Есеп шығару мысалдары
- •4. Өзіндік жұмысқа арналған тапсырмалар
- •2. Үрлеу қарқындылығы - уақыт бірлігіндегі үрлеуге шығындалатын оттегімен мінезделетін шама. Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Аралық шөміштің негізгі өлшемдерінің есебі
- •3. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Бастапқы мәліметтер
- •Өзіндік жұмысқа арналған тапсырмалар
- •Металл емес қосындыларды жою
- •3. Есеп шығару мысалдары
- •4. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Үздіксіз құюдың негізгі параметрлері
- •3. Есеп шығару мысалдары
- •4. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Сапалы болаттың құйылуы
- •4. Есеп шығару мысалдары
- •5. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Құйманың қатуындағы жеңілдетілген есеп
- •2. Есеп шығару мысалдары
- •3. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Болатты құю
- •2. Есеп шығару мысалдары
- •3. Өзіндік жұмысқа арналған тапсырмалар
- •Теориялық бөлім
- •Есеп шығару мысалдары
- •Өзіндік жұмысқа арналған тапсырмалар
- •Қолданылған әдебиеттер
- •Мазмұны
1. Темір тотығының белсенділігін есептеу әдісі
Қож құрамы, моль %:
FeO |
MnO |
CaO |
MgO |
SiO2 |
P2O5 |
15 |
10 |
40 |
10 |
20 |
5 |
Тәжірибе шарты tо = 1600оС; L0 = 0,023; [О] = 0,075%;
Тәжірибелік мағынасы: а(FеО) = [О] / L0 = 0,362м.д. = 32,6моль %.
1.1 Чипмен әдісі бойынша есептеу (молекулалық теория)
1 - тотықтардың моль санын анықтаймыз 100г қож үшін және темір тотығының мольдік үлесін анықтаймыз Х(FеО):
nFeO = 15 / 72 = 0,208; nMnO = 10 / 71 = 0,141;
nCaO = 40 / 56= 0,715; nMgO = 10 / 40 = 0,25;
nSiO2 = 20 / 142 = 0,140; nP2O5 = 5 / 142 = 0,035;
ХFeO
=
 .
.
2 - Бос тотықтардың және байланыстардың (қосарланған молекулалар түзелгенін ескере отырып) моль / 100г концентрациясын анықтаймыз:
n(FеО) = 0,208;
n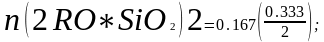 (4RO
∙ Р2О5)2
= 0,018;
(4RO
∙ Р2О5)2
= 0,018;
n(4Roсв) = (0,715 + 0,141 + 0,25) - (2 ∙ 0,333 + 4 ∙ 0,035) = 0,3,
∑n = 0,3 + 0,208 + 0,167 + 0,0 + 8 = 0,693.
3 - Белсенділік: а(FeO) = n(FeO) / ∑n = 0,3 м.д. = 30 моль, %.
4 - γ(FеО) = а(FеО) / Х(FеО) = 0,3 / 0,123 = 2,44.
Есептелінген а(FеО) тәжірибелік мәнге сейкес келеді.
1.2 Мүлтiксiз иондық ерiтiндiлердiң теориясы бойынша есептеу
Қождың г / ион / 100г санын есептеу үшін және FeO белсенділігін есептеуде келесі формуланы қолдананамыз (7.1 - 7.9):
n(FеО) = 15 / 72 = 0,208;
nFе++ = n(FеО) = 0,208;
∑n+ = n(FеО) + n(MnО) + n(СаО) + n(МgО) = 0,208 + 10 / 71 + 40 / 56 + 10 / 40 =
= 0,208 + 0,141 + 0,715 + 0,25 = 1,314;
nО²- = ∑n+ - 2n(SiО2) - 3n(Р2О5) = 1,314 - (2 · 20 / 60) - 3 · 0,035 = 0,543;
∑n- = ∑n+ - n(SiО2) - n(Р2О5) = 1,314 - 0,333 - 0,035 = 0,946.
а(FеО) есептік мағынасы тәжірибеліктен 3,6 есе аз.
1.3 Тсир Самарин және Шварцманның түзетуі бойынша есептеу
7.11 - ші теңдеу бойынша:
lg(γFе++ γО²-) = 1,53(Х(SiO4-)) + Х(PO4³-) - 0,17 =

γFе++ γО²- = 3,02; а(FеО) = ХFe³+ Х(O²‾)γFе²+ γО²- = 0,09 · 3,02 = 0,27м.д. = 27%.
а(FеО) есептік мағынасы тәжірибеліктен 1,2 есе аз.
1.4 12 - ші формула бойынша есептеу М.Я. Меджибожский:
а(FeO) = 15 / 1,3 · 40 + 5 + 10 - 1,8(20 + 5 - 10) = 0,3 м.д. = 30 моль.
1.5 Кожеуров әдісі бойынша есептеу (жүйелi иондық ерiтiндiлердiң теориясы):
1. 100г қож үшін катион - г санын анықтаймыз ∑n+ және иондық үлестерін (Хi):
∑n+ = n(FеО) + n(MnО) + n(СаО) + n(МgО) + n(SiО2) = 0,208 + 0,141 + 0,715 + 0,25 + 0,333 + 0,07 = 1,717.
Х1 = 0,208 / 1,717 = 0,122; Х2 = 0,141 / 1,717 = 0,082; Х3 = 0,715 / 1,717 = 0,415.
2. 1873 оК кезінде:
lgХ1 = 0,534[2,18 · 0,082 · 0,194 + 5,9(0,415 + 0,145)0,194 + 10,3 · 0,415 · 0,041] = 0,456.
γ1 = 2,86а(FеО) = ХFе²+ ХО²- γFе²+ = Х1Х2 = 0,122 · 2,86 = 0,35м.д. = 35моль %.
Х4 = 0,25 / 1,717 = 0,145; Х5 = 0,333 / 1,717 = 0,194; Х6 = 0,07/1,717 = 0,041.
Тәжірибелік мәліметтерге жақын нәтижелер алынды.
Кожурев әдісі бойынша фосфордың және марганецтің а(Р2О5), а(MnО) металдағы құрамын қанағаттанарлықтай есептеуге болады қожбен тепе - теңдік жағдайында.
