
- •Содержание
- •1.ВВедение.
- •Цели и задачи изучения дисциплины
- •Программа дисциплины
- •Конспект лекций строение атома
- •Периодическая система д.И. Менделеева в свете теории строения атома
- •Общие закономерности в изменении атомных радиусов, энергии ионизации, энергии сродства к электрону и электроотрицательности в периодах и группах
- •Химическая связь
- •Принцип гиллеспи
- •Поляризуемость
- •Химическая термодинамика
- •Тепловые эффекты химических реакций
- •Термохимические уравнения
- •Закон Гесса
- •Термохимические расчеты
- •Решение
- •Решение
- •Растворы
- •Растворы электролитов
- •Слабые электролиты. Константа и степень диссоциации
- •Реакции обмена в растворах электролитов
- •Гидролиз солей
- •Степень и константа гидролиза
- •Окислительно-восстановительные реакции
- •Метод электронного баланса
- •Комплексные соединения
- •Классификация лигандов
- •Строение комплексных соединений
- •Строение атома. Химическая связь
- •Вопрос 1. Приведите характеристику элемента на основании его положения в Периодической системе.
- •Вопрос 2.Укажите тип связи в данных молекулах:
- •Вопрос 3. По мвс постройте молекулы AsН3s , ВеCl2
- •Классы неорганических соединений
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3 Осуществить превращения
- •Решение
- •Решение
- •Решение
- •Реакции обмена в растворах электролитов. Гидролиз.
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3.
- •Вопрос 1
- •Вопрос 2
- •Химические и электрохимические свойства металлов
- •Вопрос 2 По методу валентных связей постройте комплексный ион [AuCi4] - , охарактеризуйте его свойства :
- •2.Экзаменационный билет № 1
- •Список рекомендованной литературы
- •Приложение 2
- •Приложение 3
Решение
Тепловой эффект реакции равен разности между суммой теплот образования конечных и суммой теплот образования начальных веществ. Так как стандартные теплоты образования относятся к 1 моль вещества, их умножают на соответствующие стехиометрические коэффициенты в уравнении реакции.
Решение задачи начинаем с выписывания справочных данных:
( H2 ) = 0,
(CO) = –110,53 кДж/моль ,
( CH3OH(ж) ) = –238,57 кДж/моль , тогда
= –238,57 – 2 х 0 - (–110,53) = –128,04 кДж.
Пример 2. Вычислите DНо и DGо (энергию Гиббса), DFо (энергию Гельмгольца) для химической реакции:
2H2+ CO = CH3OH(г).
Определите, в каком направлении пойдет реакция при стандартном давлении и 298 К.
Решение
Для расчета энергию Гиббса используем уравнение:
DG0298 = DH0298 - ТDS0298 ,
где DH0298 - тепловой эффект реакции при стандартных условиях и температуре Т=298 К.
DS0298 - изменение энтропии реакции при стандартных условиях и температуре Т = 298 К.
где ni - число молей i-го вещества, соответствующее стехиометрическому коэффициенту перед этим веществом в уравнении реакции.
Энергию Гельмгольца рассчитывают по уравнению:
DF0298 = DG0298 - DnRT,
где: Dn - изменение числа молей газообразных веществ в результате реакции.
По справочнику находим
( H2 ) = 0 ,
(CO) = –110,53 кДж/моль ,
( CH3OH( г) ) = –201,00 кДж/моль , тогда
= –201,00 – 0 – (–110,53) = –90,47 кДж.
DS0298 ( H2 ) =130,52 Дж / моль х К
DS0298 (CO) = 197,15 Дж / моль х К
DS0298 ( CH3OH( г) Дж / моль х К
= 239,76 – 2 ´ 130,52 – 197,15 = –218,43 Дж/К.
DG0298 = –90470 – 298´ (–218,43) = –25377,86 Дж.
(Dn =1–2–1= –2)
DF0298 = –25377,86 – (–2) ´298´8,314 = –20422,66 Дж.
DG0298 < 0 и DF0298 < 0, следовательно реакция протекает в прямом направлении.
Задание 4 ОБЩИЕ СВОЙСТВА РАСТВОРОВ
Общие методические указания.
Домашнее задание. При выполнении заданий необходимо знать:
1) что называется растворами;
2 ) классификацию растворов;
3) способы выражения концентрации растворов;
4) чем отличаются сильные электролиты от слабых?
5) что означает и как называется показатель рН?
6) что такое активность и ионная сила сильных электролитов?
7) что такое произведение растворимости?
Решите следующие задачи:
1. Определить массовую долю (в %) серной кислоты в растворе, приготовленном из 2,5 моль серной кислоты и 14 моль воды.
2. Найти объём (мл) 30%-й хлорводородной кислоты (плотность 1,15 г/ см3), необходимый для приготовления 500 мл раствора с концентрацией разведённого вещества 1 моль/л.
3. После упаривания 2 л 6,2%-го раствора гидроксида калия (плотность 1,055 г/ см3) масса раствора уменьшилась на 650 г. Определить массовую долю (в %) соли в растворе после упаривания.
4. В 1 л воды растворили 54 г глюкозы. Рассчитайте как изменится : а) давление насыщенного пара над раствором ( р0 =100 кПа); б) изменение температуры кипения и температуры замерзания раствора, осмотическое давление раствора при 298 К, учитывая, что 1 Дж/л = 1 кПа.
5. Смешали 0,2 л 18%-го раствора азотной кислоты (плотность 1,1г/мл) и 180 г 45%-го раствора этой же кислоты. Определить массовую долю (в %) азотной кислоты в конечном растворе.
6. Из 280 г 25%-го раствора некоторой соли выделилось при охлаждении 32,9 г осадка. Определить массовую долю (в %) соли в оставшемся растворе.
7. Рассчитайте ионную силу раствора, содержащего 0,01 моль/ дм3 СаCI2 и 0,01 моль/ дм3 КCI. Определите активность ионов К+, Са2+ и CI- в этом растворе.
8. Определите концентрацию ионов ОН- в 0,01 М NH 4 ОН . Рассчитайте рН этого раствора при 295 К.
9. К 400 г 15,2%-го раствора соляной кислоты добавили 350 г раствора, содержащего 0,8 моль того же вещества. Определить конечную массовую долю растворенного вещества (в %).
10. Определить объем воды, который надо добавить к 361,1 мл 12%-го раствора нитрата серебра (плотность 1,108 г/ см3), чтобы приготовить 5%-ный раствор.
11. В воде массой 100 г при температуре 10ºС растворяется соль массой 5 г, а при температуре 60ºС — массой 8 г. Рассчитайте массу соли, которая выпадает в осадок, если раствор соли массой 200 г, насыщенный при температуре 60ºС , охладить до 10ºС .(Ответ: 5,56 г)
12. Определите степень гидролиза 0,001 н раствора соли CH3COOK и pH этого раствора, если константа диссоциации уксусной кислоты равна 1,754∙10-5. Ответ: β=0,755∙10-3, pH=7,9
13.Вычислите: а) процентную (С%); б) молярную (См); нормальную или эквивалентную (Сн) концентрации раствора H3PO4, полученного при растворении 18 г кислоты в 282 мл воды. Если плотность его 1,031г/ см3. Чему равен титр Т этого раствора? Ответ: С%=6%, См=0,63 моль/л, Сн=1,89 г-экв/л, Т=0,06186 г/ см3
14. Рассчитайте рН раствора, содержащего 0,01 моль / дм3 HNO3
и 0,01 моль / дм3 СаCI2 .
15. 14.Вычислите массу SO3, которую надо добавить к 120 мл 30%-го раствора H2SO4 (ρ=1,2 г/ см3 ),чтобы получить 40%-й раствор H2SO4 в воде. Ответ: 17,5 г.
16.Вычислите массы 40%-го и 20%-го растворов HCl, которые нобходимы для приготовления 200 г раствора с массовой долей HСl 25%. Ответ: 50 г 40%-го раствора и 150 г 25%-го раствора.
17.Содержание сульфата железа (ІІ) в растворе (ρ=1,122 г/см3) составляет 12 мас. долей,%. Вычислите молярную и нормальную концентрацию сульфата железа (ІІ) в растворе. (Ответ: 0,886 моль/ дм3; 1,772 г-экв/ дм3)
18.Растворимость Ag3PO4 в воде при 20ºС равна 0,0065 дм/ см3. Рассчитайте величину произведения растворимости. (Ответ: 1,77·10-18)
19.Произведение растворимости MgS при t=25ºС равно 2,0·10-15. Образуется ли осадок сульфида магния при смешивании равных объемов 0,004 н раствора нитрата магния и 0,0006н раствора сульфида натрия. Степени диссоциации этих электролитов приняты за 1.
20. Вычислите число ионов в растворе, содержащем 3,42 г сульфата алюминия. Ответ: 3∙1022
21. Рассчитать константу гидролиза хлорида аммония NH4Cl, если константа диссоциации NH4OH равна 1,77∙10-5. Ответ: 5,65∙10-10
22.Определите водородный показатель рН водного раствора гидро-ксида калия, содержащего 4,2∙10-3 моль/ дм3 КОН. Степень диссоциации равна 1. Ответ: рН=11,62
23. Вычислите нормальность, молярность10%-го раствора CuSO4, плот-ность которого ρ=1107 кг/м3. (Ответ: См=0,693 моль/ дм3, Сн=1,386 г-экв/ )
24.Сколько литров 30%-го раствора HNO3 ( ρ=1180 кг/м3) требуется для приготовления 20 л 0,5М раствора этой кислоты. (Ответ: 1,78 л 30%-го раствора HNO3)
25. К 100 г 10%-го раствора хлорида кальция добавили 100 г 10%-го раствора нитрата серебра (I). Определить массу (г) полученного осадка.
Примеры выполнения задания
Пример 1. Сколько граммов 30 % (по массе) раствора NaCl надо добавить к 300 г воды, чтобы получить 10 % раствор соли? (ответ: 150 г).
Дано |
Решение |
w1(NaCl) = 30 % |
Массовая доля (w) – отношение количества граммов растворенного вещества к массе раствора.
|
w2(NaCl) = 10 % |
|
m¢(H2O) = 300 г |
|
m1(NaCl) =? |
![]()
m2(р-ра) = m1(р-ра) + m¢(H2O) = m + 300
![]()
30m = 10m + 3000
20m = 3000
m = 150.
ответ: чтобы получить 10 % раствор соли, необходимо взять 150 г 30 % раствора NaCl.
Пример 3. Вычислите молярную, нормальную и моляльную концентрации 16 %-го раствора хлорида алюминия плотностью 1,149 г/см3. Объем раствора 4 л.
Дано |
Решение |
w(AlСl3) = 16 % |
Массовая доля (w) AlСl3 – отношение количества граммов растворенного вещества к массе раствора. Поэтому расчет навески AlСl3 можно проводить по следующей формуле: |
r(р-ра) = 1,149 г/см3 |
|
Cм (AlСl3) =? |
|
Cн (AlСl3) =? |
|
Cm(AlСl3) = ? |
![]() ,
m(р-ра)=
V(р-ра)
´
r(р-ра)
Þ
,
m(р-ра)=
V(р-ра)
´
r(р-ра)
Þ
![]()
![]() .
.
1. Молярная концентрация – число молей растворенного вещества в 1 л раствора:
![]()
![]() .
.
2. Нормальная концентрация – число эквивалентов растворенного вещества в 1 л раствора
m ( AlCl3 )
С N = ___________________
1/3 М( AlCl3 ) х V ( р-ра)
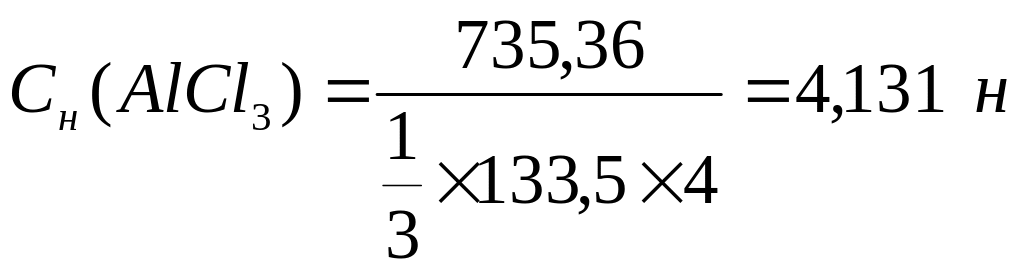
3. Моляльная концентрация – показывает, сколько молей растворенного вещества содержится в 1 килограмме растворителя.
Массу AlСl3 в 1000 г воды (растворителя) находим из соотношения:
-
(100 – 16) г Н2О
–
16 г AlСl3
1000 г Н2О
–
m г AlСl3
![]() Þ
Þ
![]() .
.
![]() ,
[моль/1
кг Н2О]
,
[моль/1
кг Н2О]
![]() .
.
Пример 4. Раствор содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296 °С. Температура кристаллизации бензола 5,5 °С. Криоскопическая константа 5,1°. Вычислите мольную массу растворенного вещества.
Дано |
Решение |
m(X) = 0,512 г |
Согласно 2 закону Рауля понижение температуры кристаллизации раствора (Dt) по сравнению с температурами кристаллизации выражаются уравнением
|
m(C6H6) = 100 г |
|
t(р-р) = 5,296 °С |
|
t(C6H6) = 5,5 °С |
|
K = 5,1 ° |
|
M(X) =? |
где K – криоскопическая постоянная.
m и М – соответственно масса растворенного вещества и его мольная масса; m1 – масса растворителя.
![]()
Dt = t(C6H6) – t(р-р)
![]()
Ответ:
мольная масса растворенного вещества
![]() .
.
Пример 5.
Рассчитайте
степень гидролиза и значение рН в 0,1 М
растворе ацетата натрия,
![]() .
.
Дано |
Решение |
|
CH3COONa + H2O Û CH3COOH + NaOH CH3COO– + H2O Û CH3COOH + OH– 1. Константа гидролиза соли:
|
|
|
h = ? |
|
pH = ? |
2. Степень гидролиза соли:
 или 0,00758 %.
или 0,00758 %.
3. Молярная концентрация гидроксид-ионов:
![]()
4. Водородный показатель:
pH = 14 + lg[ОН–] = 14 + lg7,58´10–6 = 8,88
Ответ: степень гидролиза h = 0,00758 %, pH = 8,88.
Пример 6. Образуется ли осадок хлорида свинца, если смешать равные объемы растворов соляной кислоты с концентрацией 0,02 моль/дм3 и нитрата свинца с молярной концентрацией 0,01 моль/дм3?

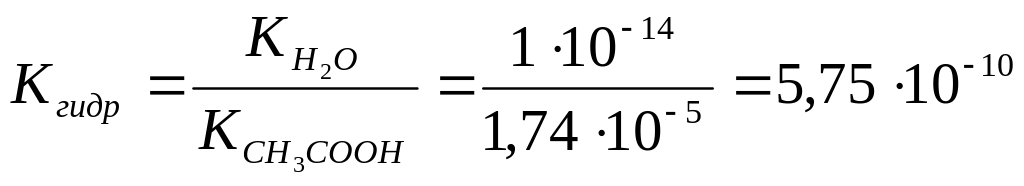 .
.