
- •Анодное растворение металлов Исследование поляризационных кривых при анодном растворении металлов.
- •Случай 2: Растворение при практически равновесном потенциале металла.
- •Экспериментальная часть. Исследование кинетики анодного растворения кадмия
- •Содержание работы
- •Методика измерений
- •Порядок работы
- •Обработка результатов
Обработка результатов
1. Поляризационные кривые, полученные при анодном растворении кадмия в 0,5М растворе H2SO4, строят в координатах E – lgi. Определяют наклон линейного участка зависимости “b” и делают заключение о природе медленной стадии электродного процесса при анодном растворении кадмия.
По величине Есам - стационарного потенциала само растворяющегося кадмиевого электрода определяют скорость диффузии ионов кадмия в раствор при отсутствии внешней поляризации, т.е. скорость саморастворения кадмия. Для этого на экстраполированном участке прямой Е, lg i находят плотность тока, которая отвечает стационарному потенциалу само растворяющегося кадмия. Это и будет скорость саморастворения iсам.
2. При анодном растворении кадмия в растворе серной кислоты с добавкой CdSO4 (раствор 5.10-3 M CdSO4 + 0,5M H2SO4) зависимость между E и i описывается уравнением (12), которое удобно записать в виде
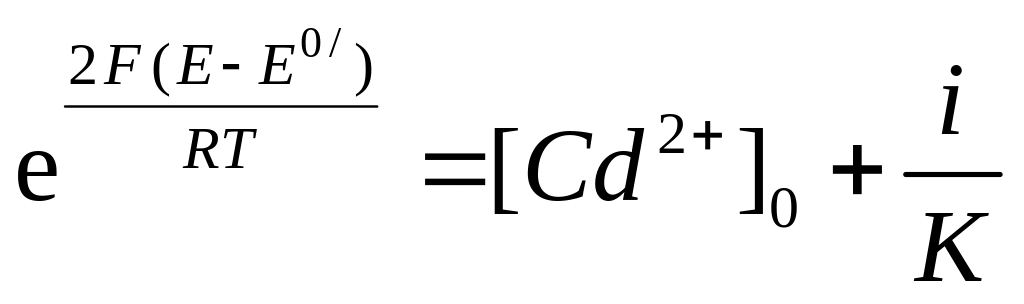 ,
(14)
,
(14)
где E0/ - формальный потенциал системы. Последний можно рассчитать с использованием значения стационарного практически равновесного потенциала кадмиевого электрода (Е0), измеренного в растворе 5.10-3 M CdSO4 + 0,5M H2SO4 при отсутствии поляризующего тока (i=0) по уравнению
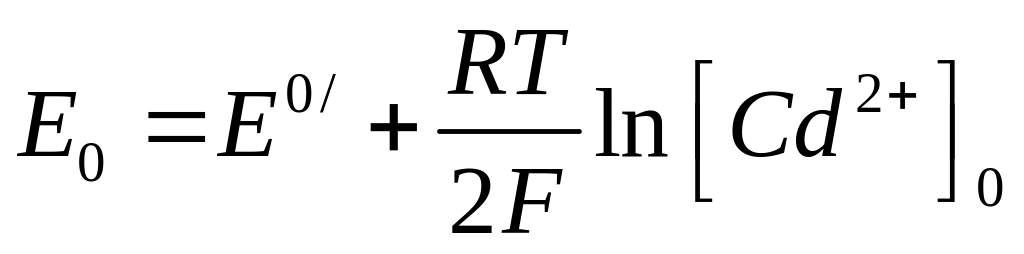 , . (15)
, . (15)
где [Cd2+]0 = 5.10-3 моль/л, а значение RT/2F = 12 мВ (250С).
Зависимость
E
– i,
полученную с раствором 5.10-3
M
CdSO4
+ 0,5M
H2SO4,
строят на графике в координатах
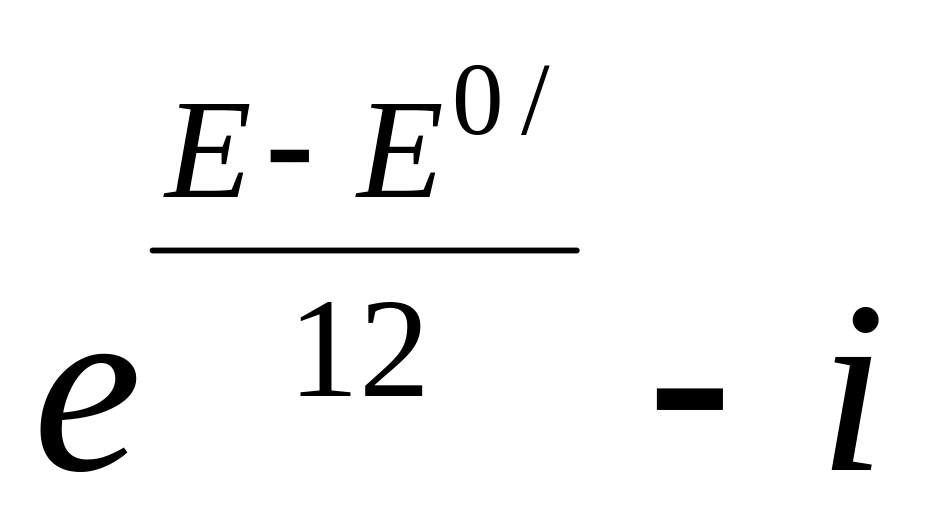 (где E
и E0/
выражены в милливольтах, а i в А/см2).
Из наклона линейного участка такой
зависимости в соответствии с уравнением
(14) рассчитывают коэффициент К.
(где E
и E0/
выражены в милливольтах, а i в А/см2).
Из наклона линейного участка такой
зависимости в соответствии с уравнением
(14) рассчитывают коэффициент К.
С использованием полученного значения коэффициента К в соответствии с уравнением [12] строят график зависимости в координатах Е - lg([Cd2+]o + i/K). Определяют угловой коэффициент прямолинейного участка полученной зависимости и сопоставляют его с теоретическим значением b=2,3RT/zF.
Для отчета строят следующие графики
экспериментальная кривая Е-t, (один любой график)
расчет bk для чистой кислоты (один любой, но указать все рассчитанные bk)
расчет К для раствора к-та+ добавка Cd (один любой)
расчет bk для раствора к-та+ добавка Cd ((один любой, но указать все рассчитанные bk)
Обязательно подписать все оси на графиках!! Перенести графики в word , поместив по 2 графика на лист.
