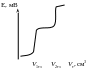- •7. Титрование с электрохимическим фиксированием точки эквивалентности
- •7.1 Электроды
- •Классификация и примеры индикаторных электродов
- •7.2. Потенциометрическое титрование
- •Виды интегральных кривых титрования, полученных с различными индикаторными электродами при титровании хлорида натрия нитратом серебра.
- •Общий алгоритм выбора индикаторного электрода
Виды интегральных кривых титрования, полученных с различными индикаторными электродами при титровании хлорида натрия нитратом серебра.
Определяемый ион |
Индикаторный электрод |
Вид интегральной кривой титрования |
||
1 |
2 |
3 |
||
Na+ |
Натрий–селективный |
Ионы Na+ содержится в исходном растворе, в реакции с титрантом они не участвуют, поэтому их концентрация растворе в процессе титрования практически не меняется (немного уменьшается за счет разбавления), поэтому аналитический сигнал натрий–селективного электрода в процессе титрования практически не изменяется – точку эквивалентности определить невозможно. |
|
|
NO3– |
Нитрат– селективный |
Ионы NO3– добавляют к раствору при титровании, в реакции с титруемым веществом они не участвуют, поэтому их концентрация растворе в процессе титрования постепенно увеличивается – точку эквивалентности определить невозможно |
Е, мВ
|
|
Окончание табл. 17
1 |
2 |
3 |
|
Cl– |
Хлоридсеребряный ненасыщенный |
Ионы Cl– содержатся в исходном растворе, при взаимодействии с титрантом они образуют осадок. Их концентрация в титруемом растворе в процессе титрования уменьшается до точки эквивалентности, а за точкой эквивалентности определяется концентрацией хлорид-ионов в насыщенном растворе над осадком |
|
Хлорид-селективный |
|||
Ag+ |
Серебряный |
При титровании ионы Ag+ постепенно добавляют к титруемому раствору. Взаимодействуя с титруемым веществом они образуют осадок, их концентрация растворе до точки эквивалентности определяется концентрацией ионов серебра в насыщенном растворе над осадком, а за точкой эквивалентности Ag+ накапливаются |
Е, мВ
|
Аргентум-селективный |
|||
– хлоридсеребряный ненасыщенный и хлоридсеребряный насыщенный;
Из приведенного примера следует, что в качестве индикаторного необходимо выбирать электрод, равновесный потенциал которого зависит от ионов, участвующих в реакции (концентрация которых изменяется при титровании) – Ag+ и Cl–.
Общий алгоритм выбора индикаторного электрода
определяем тип реакции титрования;
для окислительно-восстановительного титрования в качестве индикаторного выбирают индифферентные электроды, обычно платиновый;
для кислотно-основного, комплексонометрического и осадительного титрования необходимо написать уравнение реакции в ионном виде. В качестве индикаторного электрода выбирают электроды, потенциал которых зависит от концентрации ионов, участвующих в реакции (титруемый ион или ион титранта).
при комплексонометрическом титровании следует помнить, что для большинства титруемых ионов металла несмотря на выделяющиеся в реакции ионы водорода нельзя применять рН-стеклянный электрод, так как большинство комплексонатов (lg20) неустойчивы в кислой среде и титрование следует проводить в присутствии буферных растворов, при которых потенциал рН-индикаторного электрода не изменяется.
На интегральной кривой потенциометрического титрования расположение точки эквивалентности не всегда очевидно. Существуют несколько способов более точного определения Vтэ:
1) Наиболее распространенным способом обработки данных титрования является построение дифференциальной кривой титрования Е/V = ƒ(Vт). Точке эквивалентности на такой кривой соответствует максимальное значение (экстремум) дифференциала Е/V (рис. 11).
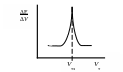
Рис. 11. Общий вид дифференциальной кривой потенциометрического титрования
После установления Vтэ для количественной оценки состава анализируемого раствора применяют закон эквивалентов (с. 10).
При потенциометрическом титрование в одной пробе могут быть раздельно определены несколько совместноприсутствующих компонентов (условия селективного титрования см. на с. 124). Интегральная и дифференциальная кривые титрования смеси двух веществ, титрующихся последовательно, приведены на рис. 14.
|
|
а |
б |
Рис. 14. Общий вид интегральной (а) и дифференциальной (б) кривых титрования смеси двух селективно титрующихся веществ
Так как второй компонент смеси титруется после того, как первый полностью оттитрован, то объем титранта, затраченный на его титрование будет равен разности объемов, соответствующих второй и первой точкам эквивалентности (V2тэ – V1тэ), масса компонентов рассчитывается по закону эквивалентов.