
- •Оглавление
- •Тема 1. 12
- •Тема 2. 48
- •Тема 3. 97
- •Тема 8. 161
- •Тема 9. 170
- •Тема 10. 184
- •Тема 11 204
- •Тема 12 211
- •Введение
- •Тема 1. Гематологические исследования
- •Забор крови
- •Определение содержания гемоглобина
- •Метод Сали
- •Унифицированный гемоглобинцианидный метод
- •Эритроциты
- •Подготовка счетной камеры
- •Общий объем эритроцитов
- •Унифицированный микрометод
- •Лейкоциты
- •Лейкоцитарная формула
- •Унифицированный метод морфологического исследования форменных элементов крови с дифференцированным подсчетом лейкоцитарной формулы
- •Тромбоциты
- •Автоматизированный подсчет форменных элементов крови
- •1. Последовательность работы на аппарате Laboscale
- •2. Последовательность работы на аппарате Laboscale
- •Свертывающая система крови
- •Методы исследования тромбоцитарно-сосудистого (первичного) гемостаза Время кровотечения
- •Метод Дьюке
- •Резистентность (ломкость) капилляров
- •Манжеточная проба Румпеля-Лееде-Кончаловского
- •Методы исследования свертывания крови (коагуляционного гемостаза)
- •Определение времени свертывания крови по Ли-Уайту
- •Время рекальцификации стабилизированной плазмы
- •Определение протромбинового времени, индекса
- •Нормальные величины
- •Определение концентрации фибриногена «а» в плазме
- •Контрольные вопросы
- •Тема 2. Электромиографические исследования
- •Понятие двигательной единицы
- •Структурная организация нервно-мышечной системы
- •Задачи эмг – исследования
- •Суммарная поверхностная эмг
- •Стимуляционная электромиография
- •Исследование моторного ответа мышцы
- •Скорость распространения возбуждения по двигательным волокнам (срВм) на разных участках нерва
- •Мигательный рефлекс
- •Ритмическая стимуляция
- •Игольчатая эмг
- •Изучение спонтанной активности
- •Потенциал фибрилляции
- •Положительные острые волны (пов)
- •Потенциалы фасцикуляций (пФц)
- •Регистрация и анализ потенциалов двигательных единиц (пде)
- •Особенности изменений параметров пде при патологии нервно-мышечного аппарата
- •Первично-мышечные поражения
- •Вторичные поражения мышц
- •Контрольные вопросы
- •Тема 3. Исследование рефлексов
- •Рефлексы, вызываемые со слизистых и надкостницы
- •Сухожильные рефлексы
- •Оценка рефлексов
- •Вегеторефлексы Вагальные рефлексы
- •Вегетативные рефлексы положения
- •Характеристики состояния отделов вегетативной нервной системы
- •Контрольные вопросы
- •Тема 4. Изучение общих гемодинамических показателей
- •Проба Летунова
- •Нормотонический тип реакции
- •Гипертонический тип реакции
- •Гипотонический тип реакции
- •Дистонический тип реакции
- •Реакция со ступенчатым подъемом максимального ад
- •Контрольные вопросы
- •Тема 5. Электрокардиографическое исследование
- •Основные узлы и технические характеристики электрокардиографа
- •Общие правила регистрации и оформления электрокардиограммы
- •Контрольные вопросы
- •Тема 6. Фонокардиографическое исследование
- •Методика регистрации фкг
- •Тема 7. Реовазографические исследования
- •Общие принципы регистрации и анализа реографических кривых
- •Условия снятия рг
- •Интерпретация рг Качественная характеристика
- •Тема 8. Определение скорости распространения пульсовой волны
- •Необходимые теоретические предпосылки
- •Контрольные вопросы
- •Тема 9. Кардиоинтервалографические исследования
- •Общие принципы
- •Методы, используемые при анализе киг
- •Статистические: используемые общие показатели
- •Графические методы
- •3. Спектральный анализ
- •Контрольные вопросы
- •Тема 10. Исследование функций внешнего дыхания
- •Легочные объемы и емкости
- •Правила спирометрии
- •5. Растворимость газов в жидкостях – закон Генри
- •1. Приведение vatps к vbtps
- •2. Приведение vatps к vstpd н ормальные параметры респираторной функции
- •Расчет показателей спирограммы
- •Контрольные вопросы
- •Тема 11 электроэнцефалографические исследования цель занятия:
- •Студенты должны знать:
- •Тема 12 психофизиологические исследования
- •Рекомендуемая литература:
Эритроциты
Эритроциты – красные, наиболее многочисленные форменные элементы крови, основное содержание которых составляет гемоглобин. В качестве унифицированных методов подсчета эритроцитов в крови приняты два: подсчет в счетной камере и в автоматическом счетчике.
Унифицированный метод подсчета эритроцитов
в счетной камере
Принцип. Подсчет эритроцитов под микроскопом в определенном количестве квадратов счетной сетки.
Реактивы. 0, 9% раствор хлорида натрия.
Оборудование. Счетная камера Горяева. Микроскоп.
Ход исследования. Разводят исследуемую кровь в 200 раз. Для этого в сухую пробирку наливают 4 мл 0,9% р-ра хлорида натрия и помещают в р-р пипеткой 0,02 мл крови, тщательно промывают пипетку в верхнем слое физ. р-ра, перемешивают.
Подготовка счетной камеры
Счетную камеру и покровное стекло протирают сухой марлей. Стекло притирают к камере так, чтобы появились разводы по краям (это свидетельствует о требуемой высоте камеры – 0,1 мм). Тщательно встряхивают содержимое пробирки, затем пипеткой или палочкой отбирают каплю разведенной крови и подносят ее к краю покровного стекла, следя за тем, чтобы под стекло не попали пузырьки воздуха, и жидкость равномерно заполнила камеру, не проникая в бороздки. Заполненную камеру оставляют в горизонтальном положении на одну минуту для оседания эритроцитов. Подсчет эритроцитов производят под микроскопом с опущенным конденсором и малым увеличением (объектив 8*, окуляр 10*). Счет ведётся по диагонали камеры в пяти больших квадратах, разделенных на 16 малых, т.е. в 80 малых квадратиках. Для того, чтобы избежать повторного подсчета клеток, лежащих на линиях, принято считать клетки, располагающиеся на левой и верхней линиях квадрата.
Расчет
количества эритроцитов в 1 мкл крови
производят, исходя из разведения крови
(200), объема малого квадрата
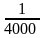 мм3,
числа сосчитанных квадратов (80):
мм3,
числа сосчитанных квадратов (80):
г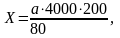 де
Х – число эритоцитов в 1 мкл крови, а –
число сосчитанных эритроцитов. В
результате сокращения Х = а • 10000.
де
Х – число эритоцитов в 1 мкл крови, а –
число сосчитанных эритроцитов. В
результате сокращения Х = а • 10000.
Общий объем эритроцитов
(Ht - гематокрит)
Гематокритная величина, или показатель гематокрита, дает представление о соотношении между объемами плазмы и форменных элементов, в основном эритроцитов. Принято гематокритной величиной выражать объем эритроцитов.
Унифицированный микрометод
Принцип. Центрифугирование крови в течение определенного времени при постоянном числе оборотов центрифуги с последующим определением результата по градуированным капиллярам.
Реактивы. Антикоагулянты – гепарин 5000 ед/мл разводят дистиллированной водой в соотношении 1: 5.
Оборудование. Центрифуга. Пипетки от аппарата Панченкова длиной 10-11 см.
Ход определения. В обработанную антикоагулянтом и высохшую пипетку набирают кровь из пальца до верхней метки (100 делений). Пипетку укупоривают, обтягивая ее резиновым кольцом, и центрифугируют 30-40 минут при 3000 оборотов в минуту.
Результат отмечают по градуировке капилляра, вычитая из 100 высоту столбика эритроцитов.
Цветной показатель
Цветной показатель отражает относительное содержание гемоглобина в эритроцитах. Падение его ниже нормы называется гипохромией, повышение – гиперхромией, нормальная величина цветного показателя – нормохромией.
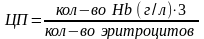
(первые 3 цифры)
Скорость оседания эритроцитов (СОЭ)
Исследование СОЭ является одним из самых распространенных в клинической практике. Как правило, оно проводится одновременно с определением концентрации НB и количества лейкоцитов при профилактических осмотрах.
Унифицированный микрометод Панченкова
Принцип. Смесь крови с цитратом при стоянии разделяется на два слоя (нижний – эритроциты, верхний – плазма). СОЭ, т.е. величина столбика плазмы, будет различной в зависимости от физико-химических свойств крови. Обычно при воспалительных заболеваниях СОЭ повышается. В таких случаях столбик плазмы будет выше.
Реактивы. 5% раствор трехзамещенного цитрата натрия. Раствор должен быть нейтральным или слабощелочным.
Оборудование. Аппарат Панченкова, состоящий из штатива и капилляров.
Ход определения. Перед использованием химически чистый капилляр промывают цитратом натрия, затем набирают цитрат до метки 0,75 и выливают его в пробирку. Далее набирают кровь в капилляр до метки 0 и смешивают ее с цитратом, при этом получается соотношение крови и цитрата 4:1. Полученную смесь набирают в капилляр до метки и, плотно закрыв верхний конец пальцем, ставят капилляр в штатив, следя за тем, чтобы кровь не вытекла из капилляра. Капилляр закрепляют в штативе. Через один час отмечают скорость оседания эритроцитов по величине отстоявшегося слоя плазмы в миллиметрах.
